Навигация
Перевірка завдання № 1
1. Перевірка завдання № 1.
2. Знаючи, що залізо – метал, опишіть його фізичні властивості. (Залізо – сріблясто-сірий метал, ковкий, пластичний, має магнітні властивості, с =7,87 г/см3, tпл.=15390С, при температурі 60000С переходить у газоподібний стан (на Сонці)).
3. Перевірка завдання № 2.
Чи лише металеві властивості має залізо? Визначте властивості заліза. (Основні, атмосферні, кислотні).
Для заліза валентністю ІІ і ІІІ майже однаковою мірою характерними є одні й ті самі властивості, тому залежно від умов сполуки Fe2+ можуть виступати в ролі відновників, а Fe3+ - окисників.
![]()
відновник окисник
ІІ
Fe(OH)2
ОсноваІІ
Fe(OH)3
Амфотерн
IV
FeO2(OH)2 або (H2FeO4)
Фериста кислота
Висновок: залізу притаманні загальні властивості металів і в той самий час він, проявляючи валентність ІІІ, є амфотерним.
4. Перевірка завдання № 3
В яких же випадках залізо проявляє ступінь окислення +3?
Запам’ятайте!
1) При взаємодії з киснем утворюється змішаний оксид:
![]()
2) При взаємодії з галогенами Fe проявляє ступінь окислення +3:
![]()
3) При взаємодії з водою:
![]()
4) При взаємодії з кислотами:

За н.у. Fe пасивує взаємодію з концентрованою кислотою H2SO4 та HNO3, оскільки утворюється міцна оксидна плівка.
5. Питання.
Які властивості буде мати ферум (ІІІ) гідроксид? Де ми вже зустрічалися з поняттям „Амфотерні сполуки?” Які амфотерні елементи та сполуки ви знаєте? Доведіть амфотерний характер Fe(OH)3.
Демонстрація експерименту (проводять учні).
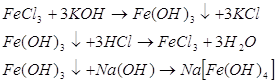
Отже, ми з вами дійшли висновку: сполуки заліза зі ступенем окислення +3 амфотерні.
6. Перевірка завдання № 4.
7. Знаючи, що для заліза ступені окислення +2 та +3 є характерними приблизно однаковою мірою, ідентифікуйте речовини: ферум (ІІ) хлорид та ферум (ІІІ) хлорид.
Демонстрація експерименту (проводять учні)
![]()
колір осаду?
![]()
колір осаду?
8. Де використовується залізо?
Яким є його значення для організму?
ІІІ. Закріплення та узагальнення.
1. Відповіді на питання (на підвісній дошці)
Схеми на дошці коментує вчитель.
Металургія
Пірометалургія (огняний спосіб)
![]()
(+O2) (+H2, C, CO, Me)
Гідрометалургія
1) Мокрий спосіб:

2) Електроліз
Електроліз
Что такое электролиз?
Рассказать я не боюсь.
Значит так: берется полюс.
Этот полюс будет «плюс».
Нужен нам и полюс «минус».
Это тоже электрод.
Если, соль в раствор закинув,
Цепь замкнуть, то ток пойдет.
У катода всем подряд
Выдаются электроны.
Металлический отряд
Получают из ионов.
![]()
А анод, наоборот,
Электроны отберет.
В этом месте всякий раз
Выделяться будет газ.

або
![]()
Результат всего процесса
Очень даже интересен:
Если ток включается –
Соли разлагаются.
![]()
Хімічна активність зменшується
![]()
Хімічна активність зменшується
1. Питання до учнів.
Правила перевезення концентрованої сульфатної кислоти в стальних цистернах суворо вимагають, щоб після зливання кислоти з цистерн випускний кран і люк були негайно закриті. Чому? (концентрована сульфатна кислота за звичайної температури не вступає в реакцію із залізом і тому перевозиться в стальних цистернах. При відкритому крані та люку сульфатна кислота швидко поглинає вологу з повітря й перетворюється на розчин кислоти, що енергійно роз’їдає стінки цистерни).
2. Робота за міні-тестами.
Тест з теми „Залізо та його сполуки”.
Варіант І.
1.Назвіть сполуки, в яких залізо має ступінь окислення +2:
а) FeО; в) Fe(NO3)2;
б)NaFeO2; г) FeCl3
2. Назвіть речовини, з якими реагує залізо:
а) O2; в) H2SO4;
б) Na2O; г) CO2
3. Назвіть речовини, які утворюються при взаємодії Fe(OH)3 з HNO3:
а) H2O;в) FeO;
б) Fe(NO3)2;г) Fe(NO3)3
4. Назвіть метали, які є більш активними за залізо:
а) Cu;в) Hg;
б) Caг) K.
5. Назвіть речовини, в яких розчиняється Fe2O3:
а) H2O;в) HCl;
б) NaOH (розч.);г) NaCl (розч.).
Варіант ІІ.
1. Назвіть сполуки, в яких залізо має ступінь окислення +3:
а) FeO;в) Fe2(SO4)3;
б) NaFeO2г) FeCl2.
2. Назвіть речовини, з якими реагує залізо:
а) Cl2;в) HNO3 (конц.)
б) H2O;г) CaO.
3. Назвіть речовини, що утворюються при взаємодії Fe(OH)3 та H2SO4:
а) H2O;в) Fe2(SO4)3;
б) FeSO4г) FeS.
4. Назвіть метали, які є більш пасивними за залізо:
а) Cu;в) Hg;
б) Ca;г) K.
5. Назвіть речовини, в яких розчиняється Fe(OH)3:
а)H2O;в) HCl (розч.);
б) NaOH (розч.);г) NaCl (розч.).
IV. Підбиття підсумків
V. Домашнє завдання
Під час виплавки сульфатних руд (FeS2) у повітря потрапляє близько 0,8% усього (за масою) сульфур (IV) оксиду, що утворився. Обчисліть об’єм повітря, який буде забруднено при одержанні 100 т заліза ГДК SO2 у повітрі – 0,5 мг/см3.
2.7 Сплави заліза: чавун і сталь. Застосування сплавів і сполук Феруму
Мета: ознайомитися з промисловим виробництвом чавуну і сталі.
1. Прочитайте текст підручника [2] п.29 зверніть увагу на сировину, з якої виплавляють чавун. Дайте відповіді на питання:
- Що таке шихта, який її склад та призначення?
- Які основні процеси відбуваються під час виплавки чавуну? Напишіть відповідні рівняння реакцій. Звірте з навчальним матеріалом міні-підручника.
- Чому під час даного процесу утворюється метал з високим вмістом Карбону? Яка роль шлаку в доменному процесі?
Напишіть рівняння реакцій утворення шлаку.
Розв’яжіть задачу:
Варіант І. № 185
Варіант ІІ. № 187
2. Взаємо перевірте розв’язані задачі. Поясніть, що означає запис:
![]()
Мета: ознайомитися з процесом виплавки сталі.
3. Опрацюйте текст підручника [2] п.29, с. 114.
Зверніть увагу на принципову різницю виплавки чавуну та сталі. (Доменний процес – процес відновлення; виплавка сталі – процес окиснення).
- мета виплавки сталі – зменшити вміст Карбону та інших домішок неметалів у металі.
4. Запишіть хімізм сталеплавильного процесу в зошит, використовуючи
підручник [2] та міні-підручник.
Мета: ознайомитись зі способами виплавки сталі.
- які характерні ознаки кожного зі способів? Використайте міні-підручник.
- Розв’яжіть задачу.
Варіант І. № 191
Варіант ІІ. № 192
5. Взаємо перевірте, оцініть виконане.
6. Прочитайте мету. Яку частину матеріалу вам необхідно опрацювати?
Мета: вивчити застосування металу заліза та його сплавів у техніці.
7. Ознайомтеся з текстом підручника [2] (п.31, с.119; п.37, с.141, абзац 6).
Необхідну інформацію запишіть.
Домашнє завдання: підручник [2] п. 29, задача 186; п.29, задача 193, п.п. 22, 30-32.
2.8 Практична робота „Розв’язування розрахункових задач з теми „Метали”
Мета: удосконалити знання про метали, їх властивості та способи одержання; розвинути знання про сполуки металів та їх хімічні властивості, якісні реакції; навчитися здійснювати перетворення одних речовин та інші; закріпити вміння складати окисно-відновні рівняння реакцій, реакції йонного обміну у молекулярному, повному та скороченому йонному вигляді.
Використовуючи підручник [3], виконати завдання:
Варіант І. Завдання 1, 5, 12;
Варіант ІІ. Завдання 2, 6, 10;
Варіант ІІІ. Завдання 3, 7, 11;
Варіант IV. Завдання 4, 8, 9.
Будьте обережні! Ви працюєте з кислотами, лугами, солями!
Згадайте:
а) правила поводження в хімічному кабінеті;
б) правила роботи з їдкими речовинами – кислотами, лугами;
в) правила поводження з відкритим полум’ям.
У разі необхідності прочитайте фрагменти тексту (підручник [3], с. 5-8). Після виконання практичної роботи запишіть у зошит висновки про виконану роботу та приберіть своє робоче місце.
2.9 Атестація з теми „Метали побічних підгруп. Залізо”
Мета: перевірити рівень знань, умінь і навичок, одержаних учнями при вивченні теми.
Завдання 1 (2 бали). Напишіть рівняння реакцій взаємодії заліза з простою та складною речовинами. Визначте окисник та відновник.
Варіант І.
а)хлор; б)сульфатна кислота.
Варіант ІІ.
а)хлоридна кислота; б)бром.
Варіант ІІІ.
а)купрум(ІІ)сульфат; б)гідроген флюорит.
Варіант IV.
а)сірка; б)меркурій(ІІ) нітрат.
Варіант V.
а)концентрована нітратна кислота; б)кисень.
Варіант VI.
а)водяна пара; б)йод.
Завдання 2 (3 бали). Напишіть рівняння реакцій, що лежать в основі схеми.
Варіант І.
![]() .
.
Варіант ІІ.
![]() .
.
Варіант ІІІ.
![]() .
.
Варіант IV.
![]()
Варіант V.
![]()
Варіант VI.
![]()
Завдання 3 (3 бали). Розв’яжіть розрахункові задачі на знаходження формул хімічних сполук.
Варіант І. Масові частки Феруму й Оксигену в природному мінералі становить відповідно 72,36% і 27,64%. Знайдіть формулу мінералу і назвіть його.
Варіант ІІ. Масові частки Феруму та Оксигену в природному мінералі становить відповідно 69,9% і 30,1%. Знайдіть хімічну формулу мінералу і назвіть його.
Варіант ІІІ. Масова частка кристалізаційної води у кристалогідраті Ферум(ІІІ) хлориду становить 39,92%. Знайдіть формулу кристалогідрату.
Варіант IV. Масова частка Феруму в природному мінералі піриті становить 46,67%. Крім Феруму, до складу піриту входить Сульфур. Визначте формулу піриту.
Варіант V. Хромовий залізняк містить хром(ІІІ) оксид і ферум(ІІ) оксид. Масова частка останнього в мінералі становить 32,14%. Визначте формулу мінералу.
Варіант VI. Масова частка Хлору в хлориді тривалентного металу становить 65,5%. Який це метал? Напишіть формулу хлориду.
Завдання 4 (4 бали). Розв’яжіть експериментально-розрахункові задачі.
Варіант І. Маючи ферум(ІІ) хлорид, одержіть ферум(ІІ) гідроксид. Обчисліть масу ферум(ІІ) гідроксиду, якщо в реакцію вступив ферум(ІІ) хлорид масою 1,27 г.
Варіант ІІ. Маючи ферум(ІІІ) сульфат, одержіть ферум(ІІІ) хлорид. Яка маса осаду, якщо в реакцію вступив ферум(ІІІ) сульфат масою 2 г?
Варіант ІІІ. Маючи ферум(ІІІ) оксид, одержіть ферум(ІІІ) хлорид. Яка маса солі утвориться, якщо в реакцію вступив ферум(ІІІ) оксид масою 1,6 г?
Варіант IV. Маючи ферум(ІІІ) оксид, одержіть ферум(ІІІ) нітрат. Яка маса солі утвориться, якщо в реакцію вступив ферум(ІІІ) оксид масою 0,8 г?
Варіант V. Маючи ферум(ІІ)гідроксид, одержіть ферум(ІІ)сульфат. Яка маса сульфатної кислоти витратиться, якщо в реакцію вступив ферум(ІІ) гідроксид масою 0,9 г?
Варіант VI. Маючи ферум(ІІ) сульфат, одержіть ферум(ІІІ) гідроксид. Яка маса натрій гідроксиду витратиться, якщо прореагував ферум(ІІ) сульфат масою 1,52 г?
Завдання 5. Розв’яжіть експериментальні задачі.
Варіант І. Маючи необхідні реактиви та обладнання, одержіть ферум(ІІ) хлорид.
Доведіть експериментально, що до оксиду одержаної солі входять катіони Феруму(ІІ) та хлорид-аніони. Опишіть спостереження. Напишіть рівняння реакцій.
Варіант ІІ. Маючи необхідні реактиви й обладнання, одержіть ферум(ІІ) сульфат.
Доведіть експериментально, що до цієї солі входять катіони Феруму (ІІ) та сульфат-аніони. Опишіть свої спостереження. Напишіть рівняння реакцій.
Варіант ІІІ. Маючи необхідні реактиви й обладнання, одержіть ферум(ІІІ) хлорид.
Доведіть експериментально, що до складу одержаної солі входять катіони Феруму(ІІІ) та хлорид-аніони. Опишіть спостереження. Напишіть рівняння реакцій.
Варіант IV. Маючи необхідні реактиви й обладнання, одержіть ферум(ІІІ) сульфат.
Доведіть експериментально, що до складу цієї солі входять катіони Феруму(ІІІ) та сульфат-аніони. Опишіть спостереження. Напишіть рівняння реакцій.
Варіант V. Одержіть реакцію обміну ферум(ІІ) гідроксид.
Одержаний осад розлийте у дві пробірки. Одну залишіть на деякий час на повітрі. До другої долийте розчин кислоти. Опишіть спостереження. Напишіть рівняння реакцій.
Варіант VI. Одержіть реакцію обміну ферум(ІІІ) гідроксид.
Одержаний осад розлийте у дві пробірки. До однієї долийте розчин кислоти. Вміст другої пробірки перелийте до розчину лугу. Опишіть спостереження. Напишіть рівняння реакцій.
Похожие работы
... і для розвитку пізнавального інтересу 7-10-річних учнів, оскільки в процесі пошуку учні мають можливість виявити активність мислення, ініціативу, утвердити себе. Для розвитку пізнавальних інтересів молодших школярів у навчальному процесі необхідно забезпечити правильне співвідношення репродуктивної і продуктивної діяльності, уміле включення емоціогенного матеріалу, постійне стимулювання в учнів ...
... є чи методичне необґрунтоване використання на уроках етапу первинного сприймання нового. Актуалізація даної проблеми потребує аналізу передового педагогічного досвіду. 2.2 Забезпечення оптимального первинного сприймання навчального матеріалу у передовому педагогічному досвіді Як показує аналіз передового педагогічного досвіду, проведення підготовчої роботи до сприйняття нового матеріалу на ...
... класах проходить по-різному. Необхідна її адаптація до конкретних умов проведення [20]. РОЗДІЛ 3. МЕТОДИЧНІ ЗАБЕЗПЕЧЕННЯ ПРОВЕДЕННЯ УРОКІВ З ТЕМИ „МЕТАЛИ” 3.1 Тематичне планування теми „Метали” Тема „Метали” вивчається в 9 класі в середині другого семестру навчального року, на вивчення теми передбачено програмою 22 години. Тематичне планування представлено в табл. 3.1. Таблиця ...
... і і розвитку пізнавальної активності молодших школярів на уроках рідної мови. Розділ ІІ. Методичне забезпечення вивчення прикметника як засобу формування пізнавальної активності молодших школярів 2.1 Методика вивчення теми «Прикметник» як вияв пізнавальної активності молодших школярів Одним з основних положень програми з української мови є всебічний розвиток усного й писемного мовлення ...

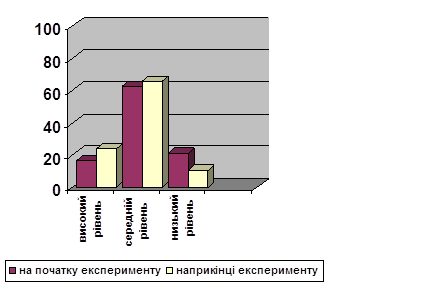
0 комментариев