Навигация
Железо не взаимодействует с…
29. Железо не взаимодействует с…
а) соляной кислотой;
б) кислородом воздуха;
в) оксидом калия. +
30. Найдите сокращенное ионное уравнение, соответствующее левой части молекулярного уравнения: Fe(OH)2+2HNO3![]()
а) Fe (OH)2+2H+![]() Fe 2++2H2O
Fe 2++2H2O
б) OH-+H+![]() H2O
H2O
в) Fe 2++2NO3-![]() Fe (NO3)2 +
Fe (NO3)2 +
31. Реакцией замещения является
а)Fe + CuCl2 → FeCl2 + Cu
б)FeCl3 + Cu → CuCl2 + FeCl2
в)FeCl2 + Cl2 → FeCl3
г)FeCl2 + NH3 + H2O → Fe(OH)2 + NH4Cl +
д)Fe(OH)2 → FeO + H2O
32. Составьте уравнение по схеме:
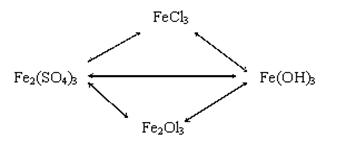
33. Массовая доля железа в пирите равна:
а) 0,549
б) 0,382
в) 0,728 +
г) 0,467
34.Число неспаренных электронов в основном состоянии атома железа равно:
а) 2
б) 4 +
в) 3
г) 1
35. С водными растворами каких веществ будет реагировать железо?
а) хлорид калия
б) нитрат кальция
в) хлороводород +
г) нитрат серебра (I) +
36. Гидроксид железа (II) можно получить взаимодействием:
а) оксида железа (II) и воды
б) хлорида железа (II) и щелочи +
в) сульфата железа (II) и гидроксида натрия +
г) гидроксида железа (III)
37. Процесс ржавления железа может быть описан уравнением: ![]() Какие утверждения справедливы относительно этого процесса?
Какие утверждения справедливы относительно этого процесса?
а) кислород восстанавливается +
б) железо окисляется +
в) степень окисления железа повышается +
г) степень окисления кислорода понижается +
38. Для превращения магнетита в оксид железа (III) необходимо, чтобы магнетит прореагировал с:
а) водородом
б) кислородом +
в) оксидом углерода (II)
г) коксом
39. В каком из природных соединений железа его массовая доля наибольшая?
а) магнетит +
б) гематит +
в) пирит +
г) сидерит
40. Для железа в соединениях наиболее характерны степени окисления, равные:
а) +8
б) +3 +
в) +1
г) +2 +
41. В отличие от гидроксида железа (III) гидроксид железа (II) реагирует с:
а) соляной кислотой
б) концентрированным раствором щелочи
в) кислородом во влажном воздухе +
г) разбавленной серной кислотой
42. С водными растворами каких солей реагирует железо?
а) ![]()
б) ![]() +
+
в) ![]() +
+
г) ![]()
43. Отметьте формулы веществ, с которыми реагирует водный раствор сульфата железа (III):
а) соляная кислота
б) медь
в) гидроксид калия +
г) цинк +
44. Различить между собой пробирки, содержащие водные растворы ![]() и
и ![]() можно с помощью:
можно с помощью:
а) лакмуса
б) нитрата серебра (I)
в) серной кислоты
г) гидроксида натрия +
45. Растворы каких веществ имеют кислую реакцию среды (pH меньше 7):
а) ![]() +
+
б) ![]()
в) ![]()
г) ![]() +
+
46. Какие из указанных металлов являются более активными, чем железо?
а) медь
б) кальций +
в) ртуть
г) калий +
47. В чем растворяется ![]() ?
?
а) вода
б) раствор гидроксида натрия
в) раствор соляной кислоты +
г) раствор хлорида натрия
48. Какие из указанных металлов являются менее активными, чем железо
а) натрий
б) олово +
в) никель +
г) барий
49. В чем растворяется ![]() ?
?
а) вода
б) раствор соляной кислоты +
в) раствор нитрата калия
г) раствор гидроксида калия разбавленный
50. С какими из указанных веществ реагирует ![]() ?
?
а) вода
б) соляная кислота +
в) оксид натрия
г) оксид серы (IV) +
ЛИТЕРАТУРА
1. Фельдман Ф.Г., Рудзитис Г.Е. Химия. Учебник для 9 класса общеобразовательных учебных учреждений. М.: Просвещение, 1999;
2. Хомченко Г.П. Химия для поступающих в вузы. М.: Высшая школа, 1993.
3. Ахметов Н.С. Химия. Учебник для 9 класса общеобразовательных учебных учреждений М.: Просвещение, 2001;
4.Малышкина В. Занимательная химия. – Санкт-Петербург, “Тригон”, 2001;
5.Книга для чтения по неорганической химии. Сост. В.А.Крицман, М.: Просвещение, 1984;
6.Программно-методические материалы. Химия 8-11 классы. – М.: Дрофа, 2001.
7.Степин Б.Д., Аликберова Л.Ю. Книга по химии для домашнего чтения. – М.: Химия, 1995;
8. Я иду на урок Химии. Книга для учителя. – М.: “Первое сентября, 2000.
9. Исидоров В.А. Экологическая химия: Учебное пособие для вузов.
– СПб: Химиздат, 2001;
10. Кузьменко Н.Е., Еремин В.В. Химия. 2400 задач для школьников
и поступающих в вузы.- М.: Дрофа, 1999;
11. Химия: Большой справочник для школьников и поступающих в вузы/
Е. А. Алферова, Н.С. Ахметов – М.: Дрофа, 1999;
Похожие работы
... учащихся Диаграмма 2. Динамика успеваемости и качества обучения Таким образом, можно сделать вывод, что предложенная в работе гипотеза, что разработка и реализация новых методических подходов к изучению темы «Бериллий» позволят заметно повысить уровень знаний, научной культуры, уверенности в своих способностях школьников нашла свое подтверждение в результате наших исследований. ЛИТЕРАТУРА ...
... . - Формирование навыков техники выполнения эксперимента, умения решать расчетные и качественные задачи, составлять уравнения химических реакций, протекающих при электролизе растворов и расплавов электролитов.- Воспитание самостоятельности, организованности, формирование умения работать в группе, развитие творческих способностей, логического мышления, внимания, памяти. Оборудование: компьютер, ...
... письменных контрольных работ представляет не меньше трудности для учителя, чем устный опрос. Перед составлением планов по предмету на полугодие каждый учитель уточняет тот объем знаний, умений и навыков по химии, который должен иметь учащийся, и определяет те основные вопросы, по которым будут проводиться письменные контрольные работы. Сроки проведения контрольных работ учитель указывает в ...
... полученные химические знания и умения они могли успешно применить в практике нашего коммунистического строительства. Производственный материал в курсе химии средней школы должен не мешать, а наоборот, содействовать нормальному процессу освоения теоретических основ химии. Ознакомление учащихся с химическими производствами может иметь успех лишь в том случае, если оно осуществляется не в отрыве, ...




0 комментариев