Навигация
2. Положение железа в ПСХЭМ.
Выясняем положение железа в ПСХЭМ, заряд ядра и распределение электронов в атоме.
3. Физические свойства железа.
– Какие физические свойства железа вы знаете?
Железо – это серебристо-белый металл с температурой плавления 1539оС. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твердость методами термического и механического воздействия, например, с помощью закалки и прокатки.
Различают химически чистое и технически чистое железо. Технически чистое железо, по сути, представляет собой низкоуглеродистую сталь, оно содержит 0,02 -0,04% углерода, а кислорода, серы, азота и фосфора – еще меньше. Химически чистое железо содержит менее 0,01% примесей. Химически чистое железо – серебристо-серый, блестящий, по внешнему виду очень похожий на платину металл. Химически чистое железо устойчиво к коррозии (вспомним, что такое коррозия? Демонстрация коррозионного гвоздя) и хорошо сопротивляется действию кислот. Однако ничтожные доли примесей лишают его этих драгоценный свойств.
4. Химические свойства железа.
Исходя из знаний о химических свойствах металлов, как вы думаете, какими химическими свойствами будет обладать железо?
| +2 | +3 |
| Взаимодействие с неметаллами | |
| Fe + S= FeS | 2Fe +3CL2 = 2FeCL3 |
| С кислотами | |
| Fe + 2HCL= FeCL2 + H2 | |
| С солями | |
| Fe + CuSO4 = FeSO4 + Cu | |
| С водой | |
| 3 Fe + 4H2O (пары) = Fe3O4 + 4H2 | При температуре 700-900оС |
Демонстрация опытов.
· Взаимодействие железа с серой.
Практическая работа.
· Взаимодействие железа с соляной кислотой.
· Взаимодействие железа с сульфатом меди (II).
5. Применение железа.
Беседа по вопросам:
– Как выдумаете, каково распространение железа в природе?
Железо – один из самых распространенных элементов в природе. В земной коре его массовая доля составляет 5,1%, по этому показателю оно уступает только кислороду, кремнию и алюминию. Много железа находится и в небесных телах, что установлено по данным спектрального анализа. В образцах лунного грунта, которые доставила автоматическая станция “Луна”, обнаружено железо в неокисленном состоянии.
Железные руды довольно широко распространены на Земле. Названия гор на Урале говорят сами за себя: Высокая, Магнитная, Железная. Агрохимики в почвах находят соединения железа.
– В виде, каких соединений железо встречается в природе?
Железо входит в состав большинства горных пород. Для получения железа используют железные руды с содержанием железа 30-70% и более. Основными железными рудами являются: магнетит – Fe3O4 содержит 72% железа, месторождения встречаются на Южном Урале, Курской магнитной аномалии; гематит – Fe2O3 содержит до 65% железа, такие месторождения встречаются в Криворожском районе; лимонит – Fe2O3*nH2O содержит до 60% железа, месторождения встречаются в Крыму; пирит – FeS2 содержит примерно 47% железа, месторождения встречаются на Урале. (Работа с контурными картами).
– Какова роль железа в жизни человека и растений?
Биохимики открыли важную роль железа в жизни растений, животных и человека. Входя в состав чрезвычайно сложно построенного органического соединения, называемого гемоглобином, железо обусловливает красную окраску этого вещества, от которого в свою очередь, зависит цвет крови человека и животных. В организме взрослого человека содержится 3 г чистого железа, 75% которого входит в состав гемоглобина. Основная роль гемоглобина – перенос кислорода из легких к тканям, а в обратном направлении – CO2.
Железо необходимо и растениям. Оно входит в состав цитоплазмы, участвует в процессе фотосинтеза. Растения, выращенные на субстрате, не содержащем железа, имеют белые листья. Маленькая добавка железа к субстрату – и они приобретают зеленый цвет. Больше того, стоит белый лист смазать раствором соли, содержащей железо, и вскоре смазанное место зеленеет.
Так от одной и той же причины – наличия железа в соках и тканях – весело зеленеют листья растений и ярко румянятся щеки человека.
Примерно 90% используемых человечеством металлов – это сплавы на основе железа. Железа выплавляется в мире очень много, примерно в 50 раз больше, чем алюминия, не говоря уже о прочих металлах. Сплавы на основе железа универсальны, технологичны, доступны, дешевы. Железу еще долго быть фундаментом цивилизации.
3. Сообщение домашнего материала
4. Закрепление изученного материала
1. Используя опорную схему, записанную на доске, сделайте вывод: что же представляет собой железо и каковы его свойства?
2. Графический диктант (заранее приготовить листочки с начерченной прямой, разделенной на 8 отрезков и пронумерованной соответственно вопросам диктанта. Отметить шалашиком “^” на отрезке номер положения, которое считается верным).
Вариант 1.
1. Железо – это активный щелочной металл.
2. Железо легко куется.
3. Железо входит в состав сплава бронзы.
4. На внешнем энергетическом уровне атома железа 2 электрона.
5. Железо взаимодействует с разбавленными кислотами.
6. С галогенами образует галогениды со степенью окисления +2.
7. Железо не взаимодействует с кислородом.
8. Железо можно получить путем электролиза расплава его соли.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Вариант 2.
1. Железо – это металл серебристо-белого цвета.
2. Железо не обладает способностью намагничиваться.
3. Атомы железа проявляют окислительные свойства.
4. На внешнем энергетическом уровне атома железа 1 электрон.
5. Железо вытесняет медь из растворов ее солей.
6. С галогенами образует соединения со степенью окисления +3.
7. С раствором серной кислоты образует сульфат железа (III).
8. Железо не подвергается коррозии.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
После выполнения задания учащиеся меняются своими работами и проверяют их (ответы к работам вывешены на доске, или показать через проектор).
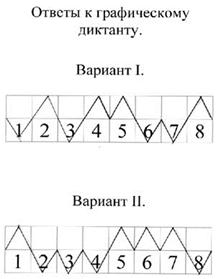
Критерии отметки:
· “5” – 0 ошибок,
· “4” – 1-2 ошибки,
· “3” – 3-4 ошибки,
· “2” – 5 и больше ошибок.
Приложения
Интересный материал к уроку
Знаете ли вы, что?
Железо – один из важнейших элементов жизни. Кровь содержит железо, и именно оно определяет цвет крови, а также ее основное свойство – способность связывать и отдавать кислород. Такой способностью обладает комплексное соединение – гем – составная часть молекулы гемоглобина. Кроме гемоглобина железо в нашем организме есть еще в миоглобине – белке, запасающем кислород в мышцах. Есть также железосодержащие ферменты.
Близ г. Дели в Индии стоит железная колонна без малейшего пятнышка ржавчины, хотя ее возраст почти 2800 лет. Это знаменитая Кутубская колонна высотой около семи метров и массой 6.5 т. Надпись на колонне говорит о том, что она была поставлена в IX в. До н. э. Ржавление железа – образование метагидроксида железа – связано с взаимодействием его с влагой и кислородом воздуха.
Однако эта реакция при отсутствии в железе различных примесей, и прежде всего углерода, кремния и серы, не протекает. Колонна была изготовлена из очень чистого металла: железа в колонне оказалось 99,72%. Этим и объясняется ее долговечность и коррозионная устойчивость.
В 1934 г. в "Горном журнале" появилась статья "Улучшение железа и стали посредством...ржавления в земле". Способ превращения железа в сталь через ржавление в земле известен людям с глубокой древности. Например, черкесы на Кавказе закапывали полосовое железо в землю, а откопав его через 10-15 лет, выковывали из него свои сабли, которые могли перерубить даже ружейный ствол, щит, кости врага.
Гематит
Гематит, или красный железняк – основная руда главного металла современности – железа. Содержание железа достигает в нем 70%. Гематит известен с давних пор. В Вавилоне и Древнем Египте он использовался в украшениях, для изготовления печатей, наряду с халцедоном служил излюбленным материалом в качестве резного камня. У Александра Македонского был перстень с вставкой из гематита, который, как он полагал, делал его неуязвимым в бою. В древности и в Средние века гематит слыл лекарством, останавливающим кровь. Порошок из этого минерала издревле использовали для золотых и серебряных изделий.
Название минерала происходит от греческого дета – кровь, что связано с вишневым или сургучно-красным цветом порошка этого минерала.
Важной особенностью минерала является способность стойко хранить цвет и передавать его другим минералам, в которые попадает хотя бы небольшая примесь гематита. Розовый цвет гранитных колонн Исаакиевского собора – это цвет полевых шпатов, которые в свою очередь окрашены тонкораспыленным гематитом. Живописные узоры яшмы, используемой при отделке станций столичного метро, оранжевые и розовые сердолики Крыма, кораллово-красные прослойки сильвина и карналлита в соляных толщах – все обязаны своим цветом гематиту.
Издавна из гематита делали красную краску. Все известные фрески, выполненные 15-20 тыс. лет назад, – замечательные бизоны Альтамирской пещеры и мамонты из знаменитой Капской пещеры – выполнены и коричневыми оксидами и гидроксидами железа.
Магнетит
Камень, чье имя магнит, залегает в земле троглодитов;
Впрочем, не меньше того им богаты индийские страны.
Он узнается легко по бурому ржавому цвету
И потому как он тянет к себе железные вещи.
М. Реннский
Магнетит, или магнитный железняк – минерал, содержащий 72% железа. Это самая богатая железная руда. Замечательное в этом минерале его природный магнетизм – свойство, благодаря которому он был открыт.
Как сообщал римский ученый Плиний, магнетит назван в честь греческого пастуха Магнеса. Магнес пас стадо возле холма над р. Хинду в Фессалии. Неожиданно посох с железным наконечником и подбитые гвоздями сандалии притянула к себе гора, сложенная сплошным серым камнем. Минерал магнетит дал в свою очередь название магниту, магнитному полю и всему загадочному явлению магнетизма, которое пристально изучается со времен Аристотеля и по сей день.
Магнитные свойства этого минерала и сегодня используются, прежде всего для поиска месторождений. Именно так были открыты уникальные месторождения железа на площади Курской магнитной аномалии (КМА). Минерал тяжелый: образец магнетита размером с яблоко весит 1,5 кг.
В древности магнетит наделяли всевозможными лечебными свойствами и способностью творить чудеса. Его использовали для извлечения металла при ранениях, а Иван Грозный среди своих сокровищ наравне с другими камнями хранил его непримечательные кристаллы.
Пирит – минерал, подобный огню
Не все золото, что блестит. Пословица
Пирит – один из тех минералов, увидев который хочется воскликнуть: "Неужели это так и было?" Трудно поверить, что высший класс огранки и полировки, поражающий нас в рукотворных изделиях, в кристаллах пирита – щедрый дар природы.
Пирит получил свое название от греческого слова "пирос" – огонь, что связано с его свойством искрить при ударе стальными предметами. Этот красивый минерал поражает золотистым цветом, ярким блеском на почти всегда четких гранях. Благодаря своим свойствам пирит известен с глубокой древности, а во время эпидемий золотой лихорадки пиритовые блестки в кварцевой жиле вскружили не одну горячую голову. Да и сейчас начинающие любители камня нередко принимают пирит за золото.
Железо и его соединения
Лабораторная работа № 4Тема. Железо и его соединения.
Цель:
· познакомить с некоторыми химическими свойствами соединений железа в различных степенях окисления.
Реактивы: железные опилки Fe, соль Мора (NH4)2SO4·FeSO4·6H2O, раствор хлорида железа (III) FeCl3, раствор гексационоферрата (III) калия K3[Fe(CN)6], раствор гексационоферрата (II) калия K4[Fe(CN)6], раствор роданида калия KCNS, раствор соляной кислоты HCl (концентрированный и разбавленный), раствор серной кислоты H2SO4 (концентрированный и разбавленный), раствор азотной кислоты HNO3 (концентрированный и разбавленный), раствор гидроксида натрия NaOH (концентрированный и разбавленный).
Посуда и оборудование: спиртовка, держатель для пробирок, штатив для пробирок, шпатель, пробирки, стеклянная палочка.
Ход работы
Опыт 1. Свойства металлического железа
Испытайте действие на железо концентрированных и разбавленных кислот при обычных условиях и при нагревании.
Для этого поместите железные опилки в пробирку и прилейте несколько капель разбавленной соляной кислоты, запишите наблюдаемые явления и дайте им объяснения. Опыт повторите с разбавленными растворами серной и азотной кислот. Осторожно нагрейте те пробирки, в которых не происходит взаимодействие железа с кислотой. Отметьте наблюдения.
Повторите опыт с концентрированными растворами кислот. Запишите наблюдаемые явления, обратите внимание на цвет и запах выделяющихся газов и на цвет растворов.
| № эксп. | Порядок выполнения | Наблюдения | Уравнение реакции | Выводы |
| 1 | 1. В пробирку поместили железные опилки и прилили несколько капель разбавленной соляной кислоты. 2. … | Наблюдается выделение бесцветного газа, раствор окрашивает-ся в бледно-зеленый цвет | Fe + 2HCl = FeCl2 + H2 Fe0 – 2e 2H+ + 2e окислитель | Железо взаимодействует с соляной кислотой, проявляя восстановитель-ные свойства, в результате реакции образуется соль – хлорид железа (II)и выделяется бесцветный газ - водород |
Опыт 2. Гидроксид железа (II), получение и свойства
Вскипятите немного воды, охладите ее и добавьте несколько кристаллов соли Мора (NH4)2SO4·FeSO4·6H2O. В пробирку со свежеприготовленным раствором соли Мора прилейте раствор гидроксида натрия до выпадения осадка. Отметьте цвет осадка. Оставьте осадок на воздухе и наблюдайте за быстрым изменением окраски.
Запишите уравнение реакции получения гидроксида железа (II) (в уравнении учитывайте только FeSO4) в молекулярной и ионной форме и уравнение окисления гидроксида железа (II) кислородом воздуха. Сделайте вывод об устойчивости ионов двухвалентного железа.
Опыт 3. Гидроксид железа (III), получение и свойства
В пробирку поместите несколько капель раствора хлорида железа (III) и прибавьте по каплям раствор гидроксида натрия до выпадения осадка. Отметьте цвет осадка. Полученный осадок разделите на две части. К первой прилейте по каплям раствор соляной кислоты, ко второй – концентрированный раствор гидроксида натрия. Запишите наблюдаемые явления.
Запишите уравнения получения гидроксида железа (III). Приведите уравнения растворения гидроксида железа (III) в кислоте и в щелочи, сделайте вывод о кислотно-основных свойствах гидроксида железа (III).
Опыт 4. Качественные реакции на ионы Fe (II) и Fe (III)
Взаимодействие соли железа (II) с гексационоферратом (III) калия (качественная реакция на ионы Fe2+)
В пробирку с раствором соли Мора (NH4)2SO4·FeSO4·6H2O прилейте несколько капель раствора гексационоферрата (III) калия (красной кровяной соли). Отметьте цвет осадка. Запишите уравнение реакции, дайте название образовавшемуся соединению KFe+2[Fe+3(CN)6] (используйте справочную литературу).
Взаимодействие соли железа (III) с гексационоферратом (II) калия (качественная реакция на ионы Fe3+)
В пробирку с раствором хлорида железа (III) прилейте несколько капель раствора гексационоферрата (II) калия (желтой кровяной соли). Отметьте цвет осадка. Запишите уравнение реакции, дайте название образовавшемуся соединению KFe+3[Fe+2(CN)6] (используйте справочную литературу).
Взаимодействие соли железа (III) с роданидом калия (качественная реакция на ионы Fe3+)
В пробирку с раствором хлорида железа (III) прилейте несколько капель раствора роданида калия. Отметьте цвет раствора. Запишите уравнение реакции.
Сделайте общий вывод по работе.
Урок 2 "Пришелец из космоса". "Железо и его соединения"
Цели урока:
· в процессе исследования изучить физические и химические свойства железа и его соединений;
· развивать дальнейшие умения составлять молекулярные и ионные уравнения химических реакций;
· учить сравнивать, обобщать, анализировать и делать выводы;
· развивать познавательную деятельность через эксперимент и посредством заданий развивающего характера;
· развивать коммуникативные качества личности.
Метод обучения: проблемно-поисковый
Организационные формы: беседа, самостоятельная и практическая работа, сообщения учащихся
Средства обучения: таблицы, химическое оборудование и реактивы, медиапроектор.
Программное обеспечение: компьютерная презентация к уроку (Приложение №1)
Эпиграф к уроку:
Другого ничего в природе нет
Ни здесь, ни там, в космических глубинах:
Все от песчинок малых до планет –
Из элементов состоит единых.
С. Щипачев
I. Введение в тему. Вступительное слово учителя.
Ребята! Сегодня мы с вами отправимся в далёкое путешествие, чтобы познакомиться с Пришельцем из космоса. А какой металл считается Пришельцем? Почему его так назвали? Во время путешествия нам предстоит сделать несколько остановок по требованию.
II. Первая остановка “Космическая” (появление железа на Земле). Сообщение ученика.
Знакомство человека с железом произошло в давние времена. Есть основания полагать, что образцы железа, которые держали в руках первобытные люди, были неземного происхождения. Входя в состав некоторых метеоритов - вечных странников океана Вселенной, случайно нашедших приют на нашей планете, - метеоритное железо было тем материалом, из которого человек изготовил впервые железные изделия. Железо в самородном состоянии встречается на земле главным образом в виде метеоритного, “космического” железа.
- 18 октября 1916 года вблизи с. Богуславки Дальневосточного края наблюдали падение метеорита, два его осколка весили по 256 кг.
- 1920 год - Юго-Западная Африка, метеорит “Гоба” весом около 60 тонн.
- 30 июня 1908 г. упал знаменитый Тунгусский метеорит весом 50 тыс. тонн.
III. Вторая остановка. “Составление визитки для железа как химического элемента” (работа в парах).
Учитель: Работая с Периодической таблицей химических элементов, составьте визитную карточку для железа по алгоритму:
Порядковый номер:
Период:
Группа:
Подгруппа:
Электронная формула:
(После работы в парах на экране появляется слайд № 1 “Визитная карточка”), учитель выслушивает ответы учащихся.
? Исходя из строения атома железа, определить его валентные электроны.
Учитель. Железо имеет 8 валентных электронов (два из них на 4s- и шесть на 3d-АО). Однако валентность 8 для железа не характерна; неустойчивы и соединения с шестивалентным железом, например производные железной кислоты H2FeO4, являющиеся сильнейшими окислителями. Обычно железо проявляет валентности равные двум и трем и соответствующие степени окисления.
? Какими свойствами обладает железо как простое вещество?
(Учитель предлагает совершить следующую остановку).
IV. Третья остановка “Физические свойства”( работа в парах). Учащиеся работают с учебником, справочной литературой и записывают в тетрадь характерные физические свойства:
Цвет:
Металлический блеск:
Твердость:
Пластичность:
Теплопроводность:
Электропроводность:
Плотность:
Температура плавления:
Железо - серебристо-белый или серый металл, твердый, с высокой пластичностью, теплопроводностью и электропроводностью, плотность его равна 7,87 г/см3, тугоплавкий-1540?С. Это самый распространенный химических элементов в природе. В земной коре его массовая доля составляет 5,1%.
Учитель проверяет выполненную работу в виде беседы с классом.
? Какими ещё свойствами обладает железо?
Учитель. Да, в отличие от других металлов, железо способно намагничиваться, оно обладает ферромагнетизмом.
Демонстрация опыта: намагничивание железных опилок.
? Какова активность железа?
Учитель обращает внимание учащихся на электрохимический ряд напряжения металлов. Для того, чтобы узнать активность железа по отношению к другим веществам, мы совершаем с вами очередную остановку.
V. Четвёртая остановка. Экспериментальная. “Химические свойства железа”.
Учитель. Железо взаимодействует как с простыми, так и сложными веществами. Предлагаю вам провести эксперименты с серой, соляной кислотой, сульфатом меди, объяснить свои наблюдения и составить уравнения химических реакций.
? Чем является железо в данных уравнениях реакций? (На экране появляется второй слайд).
Похожие работы
... учащихся Диаграмма 2. Динамика успеваемости и качества обучения Таким образом, можно сделать вывод, что предложенная в работе гипотеза, что разработка и реализация новых методических подходов к изучению темы «Бериллий» позволят заметно повысить уровень знаний, научной культуры, уверенности в своих способностях школьников нашла свое подтверждение в результате наших исследований. ЛИТЕРАТУРА ...
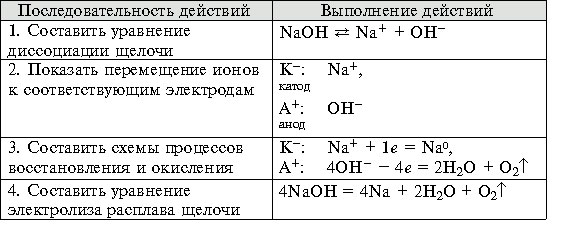
... . - Формирование навыков техники выполнения эксперимента, умения решать расчетные и качественные задачи, составлять уравнения химических реакций, протекающих при электролизе растворов и расплавов электролитов.- Воспитание самостоятельности, организованности, формирование умения работать в группе, развитие творческих способностей, логического мышления, внимания, памяти. Оборудование: компьютер, ...
... письменных контрольных работ представляет не меньше трудности для учителя, чем устный опрос. Перед составлением планов по предмету на полугодие каждый учитель уточняет тот объем знаний, умений и навыков по химии, который должен иметь учащийся, и определяет те основные вопросы, по которым будут проводиться письменные контрольные работы. Сроки проведения контрольных работ учитель указывает в ...
... полученные химические знания и умения они могли успешно применить в практике нашего коммунистического строительства. Производственный материал в курсе химии средней школы должен не мешать, а наоборот, содействовать нормальному процессу освоения теоретических основ химии. Ознакомление учащихся с химическими производствами может иметь успех лишь в том случае, если оно осуществляется не в отрыве, ...




0 комментариев