ВВЕДЕНИЕ
Бериллий был обнаружен в 1798 г. знаменитым французским химиком Л. Вокленом в полудрагоценном камне берилле. Отсюда и название элемента. Впрочем, Воклен выделил только новую «землю» - оксид неизвестного металла. Относительно чистый бериллий в виде порошка был получен только через 30 лет независимо Ф. Вёлером в Германии и Э. Бюсси во Франции.
Долгое время многие химики считали, что бериллий - трехвалентный металл с атомной массой 13,8. Для такого металла не находилось места в периодической системе, и тогда, несмотря на очевидное сходство бериллия с алюминием, Д. И. Менделеев поместил этот элемент во вторую группу, изменив его атомную массу на 9. Вскоре шведские ученые Л. Нильсон и О. Петерсон нашли, что атомная масса бериллия 9,1, что соответствовало предположениям Д. И. Менделеева. Во второй половине XX в. Бериллий - стал необходим во многих отраслях техники. Этот металл и его сплавы отличаются уникальным сочетанием различных свойств. Конструкционные материалы на основе бериллия обладают одновременно и легкостью, и прочностью, и стойкостью к высоким температурам. Будучи в 1,5 раза легче алюминия, эти сплавы в то же время прочнее многих специальных сталей. Эти качества и сам бериллий, и многие его сплавы не утрачивают при температуре 700-800°С, поэтому они используются в космической и авиационной технике.
Бериллий необходим и в атомной технике: он стоек к радиации и выполняет роль отражателя нейтронов.
ГЛАВА 1. СОСТОЯНИЕ ИЗУЧАЕМОГО ВОПРОСА В СОВРЕМЕННОЙ РОССИЙСКОЙ ШКОЛЕ
Для осознанного понимания химических процессов огромное значение имеет представление о химических элементах. Эти вопросы всегда были самыми сложными не только для учащихся, но и для учителей. Учебный материал темы поделен на 4 урока, поскольку давно известно, что на одном уроке нельзя ознакомить учащихся более чем с двумя понятиями [2].
Преподавание темы «Бериллий» начинается с 9 класса, первого полугодия. При изучении этой темы пользуются учебником химии под редакцией Г. Е. Рудзитис, Ф.Г. Фельдман, также учебником за 8 - 9 класс под редакцией Н. С. Ахметова. Дидактическим материалом служит книга по химии для 8 - 9 классов под редакцией А. М. Радецкого, В. П. Горшкова; используются задания для самостоятельной работы по химии за 9 класс под редакцией Р. П. Суровцева, С. В. Софронова; используется сборник задач по химии для средней школы и для поступающих в вузы под редакцией Г. П. Хомченко, И. Г. Хомченко. В 9 классе на изучение закономерностей протекания химических реакции отводится 4 ч [3, 4].
ГЛАВА 2. ТЕОРЕТИЧЕСКАЯ ПОДДЕРЖКА ТЕМЫ «БЕРИЛЛИЙ»Соединения бериллия в виде драгоценных камней были известны еще в древности. С давних пор люди искали и разрабатывали месторождения аквамаринов, изумрудов и бериллов. Есть свидетельства о том, что еще во времена Египетских фараонов разрабатывались изумрудные прииски в Аравийской пустыни. Но только в конце 18 века химики заподозрили, что в бериллах есть какой-то новый, не известный элемент. В 1798 году французский химик Воклен выделил из берилла окись "La terree du beril", отличавшуюся от окиси алюминия. Эта окись придавала солям сладкий вкус, не образовывала квасцов, растворялась в растворе карбоната аммония и не осаждалась оксалатом или тартратом калия. Металлический бериллий был впервые получен в 1828 году известным немецким ученым Велером и одновременно французским ученным Блюссеном, который получил порошок металлического бериллия восстановлением хлористого бериллия металлическим калием. Промышленное получение бериллия началось только в 20-х годах нашего столетия. До сороковых годов масштабы производства и применения бериллия были не велики. Однако с открытием свойств бериллия, обусловивших его использование в атомной энергетике спрос на него сильно возрос. Что в свою очередь стало причиной широкого развития исследовательских и геологоразведочных работ в этой области.
Химические и химико-физические свойства бериллия
Бериллий (Be) - имеет атомный номер 4 и атомный вес 9.0122. Он находится во втором периоде периодической системы и возглавляет главную подгруппу 2 группы, в которую также входят магний, кальций, стронций, барий и радий. Электронная структура атома бериллия 1s 2s. На внешней оболочке он имеет два электрона, что является характерным для элементов этой группы. Электронная структура внешней оболочки иона каждого из этих элементов с зарядом +2 соответствует электронной структуре инертного газа с атомным номером на две единицы меньше номера рассматриваемого элемента. Бериллий вещество серо-стального цвета; при комнатной температуре металлический бериллий имеет плотно упакованную гексагональную решетку, подобную решетке магния. Атомный (металлический) радиус бериллия равен 1.13 А. Увеличение массы и заряда ядра при сохранении конфигурации электронных оболочек служит причиной резкого уменьшения атомного и ионного радиусов бериллия по сравнению с соседним литием. После отрыва валентных электронов атом бериллия образует ион типа благородных газов, и несет, подобно литию, всего одну электронную оболочку, но характеризуется значительно меньшими размерами и компактностью. Истинный ионный радиус бериллия - 0,34 А является наименьшим среди металлов. Потенциалы ионизации у бериллия равны (соответственно для первого, второго, третьего и четвертого электронов) I1-9,28; I2-18,12; I3-153,1; I4-216,6 эВ. На кривой потенциалов ионизации бериллий занимает одно из верхних мест. Последнее соответствует его малому радиусу и характеризует бериллий как элемент не особенно охотно отдающий свои электроны, что в первую очередь определяет степень химической активности элемента. Этот же фактор имеет решающее значение в образование того или иного типа химической связи при соединение бериллия с другими элементами. С точки зрения электроотрицательности бериллий наряду с алюминием может рассматриваться как типичный переходный элемент между электроположительными атомами металлов, легко отдающих свои электроны, и типичными комплексообразователями, имеющими тенденцию к образованию ковалентной связи. В нейтральных растворах гидрокcилы бериллия дисcоциируют по схеме:
Be2+ + OH- <=> Be(OH)2 <=> H2BeO2 <=> 2H+ + [BeO2]2-
В щелочных растворах, содержащих атомы щелочных элементов, осуществляется возможность возникновения более прочной ковалентной связи между анионом и атомом амфотерного элемента. Происходит образование комплекса, прочность которого в первую очередь определяется концентрацией элементов с низким значением электроотрицательности, то есть щелочей. Бериллий в этих условиях ведет себя как комплексообразователь. В кислых растворах, характеризующихся высокой концентрацией водородного иона, элементы с низким значение электроотрицательности, подобные бериллию, могут находится в форме свободных, положительно заряженных ионов, т.е. являются катионами. Свойства основности элемента, как известно характеризуются также величиной ионного потенциала w/r, выражающего энергию силового поля иона. Как и следовало ожидать, маленький ион бериллия отличается большой величиной ионного потенциала, равной 5,88. Таким образом, по характеру своих химических свойств, всецело определяемых особенностями строения электронных оболочек атома, бериллий относится к типичным амфотерным элементам. Металлический бериллий растворяется в соляной и разбавленной азотной кислоте, а также в водных растворах гидроокисей натрия и калия с выделением водорода и образованием бериллатов с общей формулой М2ВеО2. Наибольший интерес с точки зрения возможной точки зрения возможной роли в природных процессах представляют галоидные и карбонатные соединения. Фтористый и хлористый бериллий представляет собой устойчивые соединения, очень хорошо растворимые в воде. Оба они легкоплавки (температура плавления фтористого бериллия 577, хлористого бериллия 405) и относительно легко сублимируются. В то же время нейтральный карбонат бериллия почти нерастворим в воде и является весьма непрочным соединением. В слабо щелочной и кислой среде в присутствии определенного количества электроположительных атомов щелочных металлов характерным для бериллия является образование комплексов. При этом все комплексы бериллия являются мало прочными соединениями, которые могут существовать только в определенных интервалах щелочности растворов. Таким образом на основании общего обзора химических свойств бериллия могут быть сделаны следующие предварительные выводы, характеризующие возможную роль различных соединений бериллия в геохимической истории этого элемента.
1) в условиях существенно кислой среды при низкой концентрации в растворах электроположительных атомов щелочей бериллий, вероятнее всего, может мигрировать в форме прекрасно растворимых и легколетучих галоидных соединений - фторидов и хлоридов;
2) в слабокислой и щелочной средах в присутствии достаточного количества электроположительных атомов щелочей миграция бериллия может осуществляться в форме различных комплексных бериллатов, обладающих разной устойчивостью в зависимости от характера среды;
3) существенно щелочная среда в некоторых случаях также может способствовать миграции бериллия в форме бериллатов или карбонатбериллатов, легко распадающихся при понижении щелочности раствора;
4) миграция растворимых в воде соединений бериллия может осуществляться как в истинных, так и в надкритических растворах, поскольку соединения, растворимые в жидкой воде, легко растворяются и в надкритической фазе воды, давая ненасыщенные такими соединениями растворы;
Заканчивая характеристику отдельных свойств бериллия, без внимательного анализа которых вряд ли возможно правильно представить его минералогию и понять особенности поведения в природных процессах, необходимо отметить, что свойства многих соединений бериллия, интересных в геохимическом отношении, изучены совершенно недостаточно.
Распространение и минералогия бериллия
Бериллий несмотря на малый ионный номер относится к редким элементам. Содержание его в земной коре оценивается в настоящее время от 6x10-4 до 2x10-4. Такую малую распространенность бериллия объясняют его способностью взаимодействовать с протонами и нейтронами высоких энергии. В пользу этого объяснения говорит тот факт, что бериллия мало в атмосфере солнца и звезд, а в межзвездном пространстве, где условия для ядерных реакции неблагоприятны его количество резко возрастает. Но наряду с процессом непрерывного распада его атомов, также в результате многочисленных ядерных реакций идет процесс новообразования его изотопов. Бериллий имеет только один устойчивый изотоп, но кроме него также известны изотопы с массой 7,8,9,10.
Изотопы бериллия
| Изотопы | Масса | Период полураспада |
| 7Ве 8Ве 9Ве 10Ве | 7.0192 8.0078 9.0150 10.0168 | 52.9 дня < 5x10-14 сек стабилен 2.7х106 лет |
Содержание изотопов бериллия в метеоритах подтверждают гипотезу космической дефицитности бериллия. Но в отдельных метеоритах отмечается содержание бериллия близкое к его среднему содержанию в земной коре. Для вывода среднего содержания бериллия в земной коре был использовано большое количество средних объединенных проб систематически отобранных по разным магматическим массивам. На основание этих данных был вычислен кларк бериллия, который оказался равен 3.5x10-4. При формирование земной коры бериллий концентрировался в остаточной магме в процессе ее затвердевания. Такое концентрирование в остаточных магматических породах имеет большое значение, поскольку благодаря ему элемент оказывается более доступным, чем можно было бы ожидать учитывая его малую распространенность в земной коре. В природе минералы бериллия образуются в весьма различных условиях, присутствуя во всех типах минеральных месторождений, за исключением собственно магматических. При этом наибольшее число бериллиевых минералов известно в пегматитах. В настоящее время в природе известно 40 минералов бериллия, изученных в большинстве своем совершенно недостаточно. Подавляющее большинство бериллиевых минералов являются редкими или очень редкими и известны лишь в одном или двух месторождениях земного шара. Распределение бериллиевых минералов по классам химических соединений весьма неравномерно и определяется литофильностью его атома при полном отсутствии халькофильности. Главную роль среди минералов играют силикаты 65% от общего числа минералов, меньшее значение имеют окислы и фосфаты. Сульфиды среди минералов бериллия отсутствуют полностью, что подчеркивает литофильность этого элемента.
Распределение бериллиевых минералов по классам
| Классы | Типичные представители | Кол-во | % |
| Окислы Силикаты Бораты Антимонаты Фосфаты Карбонаты | Хризоберилл Гельвин, Даналит, Берилл, Фенакит, Гадолинит Родицит Сведенборгит Бериллонит Бериллийтенгерит | 3 26 2 1 7 1 | 7.5 65.0 5.0 2.5 17.5 2.5 |
Геохимия бериллия
В геохимических процессах бериллий ведет себя как типично литофильный элемент. По классификации Перельмана бериллий относится к слабо мигрирующим элементам.
Содержание бериллия в горных породах
| Наименование породы | Содержание бериллия x10-4 |
| Ультраосновные породы Габбро-нориты Габбро Средние породы Кислые породы Щелочные породы | Менее 0,2 Менее 0,2 0,3 0,8 - 0,9 1 - 32 (ср 5) 5 - 20 (ср 7) |
При рассмотрение распространения бериллия в магматических горных породах, следует отметить, что бериллий не накапливается не в ультраосновных, не в основных магмах, присутствую в них во много раз меньших количествах, чем его среднее кларк в земной коре. Таким образом геохимическая история бериллия в земной коре всецело связана с историей образования кислых и щелочных магм, заключающих в себе более 95% атомов бериллия. При этом особенности поведения бериллия в процессах кристаллизации кислых и щелочных магм определяются в первую очередь геохимической спецификой этих существенно отличных друг от друга процессов. Ничтожное содержание бериллия в гранитном расплаве исключает возможность образование индивидуализированных бериллиевых минералов. В то же время отсутствие в расплаве высоковалентных катионов, которые могли бы компенсировать вхождение бериллия в кристаллическую решетку силикатов, затрудняет и ограничивает захват бериллия породообразующими минералами гранитов. Таким образом, ограниченное рассеяние бериллия в продуктах главной фазы кристаллизации гранитной магмы приводит к его накоплению в продуктах конечной стадии кристаллизации. Особенно резкое, скачкообразное обогащение поздних магматических продуктов бериллием, по-видимому, происходит в процессе кристаллизации кварца гранитов, практически не принимающего бериллия в свою решетку. С этим процессом связано появление на поздних стадиях формирования гранитов расплавов, эманации и растворов, в различной стадии обогащенной бериллием. Дальнейшая судьба этих образований, определяющаяся общими закономерностями становления конкретного магматического очага и геохимической спецификацией, крайне разнообразна. Следы их деятельности мы видим в широко распространенных процессах мусковитизации и грейзенизации гранитов, когда в процессе изменения гранитов концентрации бериллия возрастает в два раза по сравнению с количеством в биотитовых и прочих гранитов, не затронутых процессом мусковитизации. Наиболее ярко эти процессы протекают в процессе образования постматических месторождений бериллия, приводящих к образованию месторождений содержащих многие тысячи тонн этого элемента. Наивысшее возможное содержание бериллия, присутствующего в качестве изоморфной примеси в минералах гранитов может достигать 15x10-4-20x10-4%. Несколько повышенное рассеяние бериллия наблюдается в гранитах с повышенным содержание редких земель. Останавливаясь на особенностях поведения бериллия в щелочных магмах необходимо подчеркнуть следующие факторы, влияющие на судьбу бериллия в этих процессах:
1) высокий кларк редких земель
2) длительное участие высоковалентных катионов в процессах минералообразования повышенная щелочность среды
3) Указанные факторы облегчают изоморфный захват бериллия в процессе кристаллизации породообразующих элементов, препятствуя концентрации бериллия. Несмотря, на значительно более высокое содержание бериллия по сравнению со средним кларком литосферы, наиболее типичной особенностью его поведения в щелочных породах является рассеяние. Появление концентрации бериллия в щелочных породах можно ожидать в процессе перераспределения бериллия в процессе широкомасштабной альбитизации пород, содержащих повышенное количество бериллия. Геохимическая история бериллия в пегматитовом процессе может служить ярким примером послемагматической концентрацией рассеянного элемента. Накапливаясь по мере развития пегматитового процесса после формирования зон графического и среднезернистого пегматита, и выделения крупных мономинеральных блоков микроклин-пертитов, бериллий концентрируется в остаточных обогащенных летучими порциях пегматитового расплава-раствора. Наконец в определенный момент, обычно отвечающий окончанию формирования крупных мономинеральных блоков, в условиях сильного пресыщения кремнием, накопления натрия и летучих компонентов начинается формирование главного бериллиевого минерала гранитных пегматитов - берилла, продолжающегося в стадии пневматолито-гидротермальных замещений. В период формирования пегматитов особенности концентрации и миграции бериллия тесно связаны с поведением летучих составных частей пегматитового расплава-раствора. Подобная связь четко проявляется в образование наиболее высоких концентраций бериллиевых минералов в апикальных участках пегматитовых тел. В обстановке относительно высокой концентрации щелочей, характерной для рассматриваемого периода формирования пегматитов, а также в присутствии галоидов и углекислоты, играющих роль активных экстракторов-минерализаторов, перенос бериллия осуществляется в форме подвижных комплексных соединений типа хлорбериллатов, фторбериллатов и карбонат бериллатов щелочных металлов мигрирующих в процессе формирование пегматита в надкритических, а позднее в водных растворах в центральные части пегматитовых тел и в верхнии горизонты пегматитовой инъекции. Таким образом, при переносе бериллия в форме мобильных комплексных галоидных или карбонатных соединений с щелочными металлами выпадения бериллия в твердую фазу в виде бериллиевых минералов можно представить как сложный процесс распада подвижных соединений бериллия и связывание его в форме трудно растворимых силикатах бериллия и алюминия. Решающее значение, по-видимому, имеет изменение режима кислотно-щелочности растворов в сторону увеличения рН, а также появления жидкой фазы, легко вызывающую гидролиз таких непрочных соединений, как хлорбериллаты и др. Роль осадителя бериллия также играет фосфор, образующий с бериллием ряд устойчивых в обычных гидротермальных условиях минералов. В скарнах высокая концентрация фтора, при сравнительно низкой концентрации щелочей приводит к переносу бериллия в виде фторидов и фторбериллатов. При этом важное значение в уменьшение миграционной способности бериллия имеет увеличение значения pH минералообразующего раствора, происходящее под влиянием связывания атомов фтора кальцием вмещающих пород. Геохимическая история бериллия в мезо- и эпитермальном процессе изучена слабо, однако наличие концентрации бериллия, связанных со сравнительно низкотемпературными карбонатными жилами, а также присутствие бериллиевых минералов в жилах альпийского типа говорит о достаточно широком диапазоне его миграции в гидротермальных условиях. В жильных образованиях, формирование которых происходило в обстановке высокой концентрации карбонат иона, перенос бериллия осуществлялся в карбонатной форме. Особенности миграции бериллия в области гипергенеза изучены еще не достаточно. При этом следует отметить тот факт, что большинство бериллиевых минералов, имеющих значительное распространение, весьма устойчиво по отношению к агентам химического выветривания. Все эти минералы в процессе выветривания содержащих их пород подвергаются в основном механическому разрушению, рассеиваясь в процессе эрозии с обломочным материалом. Незначительный удельный вес минералов бериллия препятствует образованию россыпных месторождений бериллия. В бокситах отмечается незначительное увеличение концентрации бериллия, как этого можно было бы ожидать, учитывая сходство бериллия и алюминия.
ГЛАВА 3. МЕТОДИЧЕСКИЕ РАЗРАБОТКИ ПО ТЕМЕ «СОЕДИНЕНИЯ БЕРИЛЛИЯ»
Задачи:
1. Повторить на примере соединений кальция свойства основных оксидов и гидроксидов, реакции ионного обмена. Изучить качественные реакции на ионы кальция.
2. Раскрыть роль соединений кальция и магния в практической жизни.
3. Развивать экспериментальные навыки работы с веществами, умение наблюдать, анализировать, делать выводы, выделять нужную информацию.
4. Формировать коммуникативные навыки, воспитывать аккуратность.
Планируемый результат: учащиеся знают важнейшие соединения кальция, магния и области их применения, могут объяснить свойства соединений, знают качественные реакции на ионы кальция.
Форма урока: комбинированный ИКТ - урок
Использование ЦОР:
1)Комплект ЦОР Фирма «1С» Химия 9 класс, Габриелян О.С., 1-2 четверть,
2) НФПК Химия 8-11. Виртуальная лаборатория.
План урока.
| Этап урока | Содержание деятельности | Применение ЦОР |
| Организационный момент. 2мин | Приветствие, обсуждение целей и задач урока, видов и форм работы. | |
| Опрос 8 мин | *Общая характеристика металлов 2 группы *Химические свойства кальция – запись молекулярных уравнений реакций на доске * окислительно-восстановительные реакции – выполнение задания за компьютером 2-4 человека в зависимости от количества рабочих компьютеров. | «Уравнение реакции магния с кислородом», «Уравнение реакции магния с водой» (1) |
| Изучение нового материала. 27 мин | * Знакомство с внешним видом оксидов и гидроксидов металлов 2 группы, химические и тривиальные названия, применение, получение. Прогнозирование химических свойств. | фото «Оксид кальция», «Гидроксид кальция» (1) |
| Доказательство химических свойств оксида и гидроксида кальция экспериментально. Лабораторный эксперимент в парах по карточкам – заданиям (Приложение 1). | ||
| Обсуждение результатов эксперимента, вывод о характере оксида и гидроксида кальция. Демонстрация видео – опытов по ходу обсуждения Качественная реакция на гидроксид кальция | «Взаимодействия оксида кальция с водой», «Взаимодействие гидроксида кальции с углекислым газом» (1) | |
| Соли бериллия, магния и щелочноземельных металлов и их применение. Демонстрация видео Заполнение пропусков в тексте (Приложение 2) | (2) Коллекция - Свойства неорганических веществ -Щелочные и щелочноземельные металлы - CaCO3 и т.д. | |
| Качественная реакция на ион кальция, ионные уравнения Демонстрационный опыт «Взаимодействие нитрата и хлорида кальция с карбонатом натрия» | ||
| Итог урока 3 мин | Что нового вы узнали на уроке? Чему научились? Чем урок был для вас интересен? В чем вы сегодня убедились? Д.З. п. 14, упр.4. творческое задание- презентация о биологической роли кальция и магния | Домашняя презентация |
ГЛАВА 4. ТЕСТОВЫЕ ЗАДАНИЯ ПО ТЕМЕ «БЕРИЛЛИЙ»
Уровень «I»
1. Среди перечисленных веществ отметьте нерастворимое основание:
1) гидроксид бария;
2) гидроксид железа (II);
3) гидроксид натрия;
4) гидрокарбонат аммония
2. Гидроксид цинка может реагировать со всеми веществами пары:
1) сульфат кальция и оксид серы (VI);
2) гидроксид натрия (р-р) и соляная кислота;
3) вода и хлорид натрия;
4) сульфат бария и гидроксид железа (III).
3. В молекулярном уравнении реакции гидроксида цинка с соляной кислотой сумма всех коэффициентов равна:
1) 72) 53) 64) 4
4. Сумма коэффициентов в молекулярном уравнении реакций между гидроксидом алюминия и соляной кислотой равна:
1) 72) 8 3) 64) 4
5. Формулы только основных оксидов указаны в ряду:
1) K2O, SO2, CaO;
2) K2O, Na2O, CaO;
3) CO, SO3, P2O5;
4) CO, SO2, K2O.
6. Реакция FeCl3 + 3NaOH ® Fe(OH)3 + 3NaCl относится к реакциям:
1) соединения;
2) разложения;
3) замещения;
4) обмена.
7. При обычных условиях основания можно получить при взаимодействии с водой:
1) BaO, CuO, FeO;
2) Na2O, CaO, Li2O;
3) MgO, ZnO, Al2O3;
4) K2O, Li2O, Mn2O7.
8. Количеству вещества 1,5 моль равна масса гидроксида меди (II):
1) 98 г; 2) 196 г; 3) 147 г; 4) 980 г.
9. Реакции гидроксида железа (II) с серной кислотой отвечает сокращенное ионное уравнение:
1) FeO + 2H+ ® Fe2+ + H2O;
2) Fe(OH)3 + 3H+ ® Fe3+ + 3H2O;
3) Fe(OH)2 + 2H+ ® Fe2+ + 2H2O;
4) Fe2+ + 2OH- ® Fe(OH)2.
10. Основные свойства проявляет оксид:
1) марганца (VII);
2) кальция;
3) калия;
4) серы (IV)
5) фосфора
Уровень II
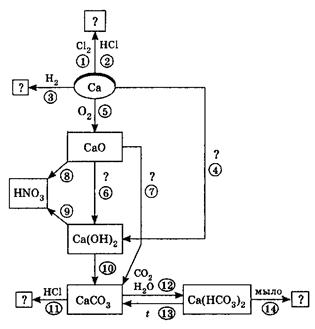
11. В схеме превращений
![]()
веществами А, Б, В являются соответственно:
1) Cl2, H2O, Na2O;
2) HCl, NaOH, NaOH(избыток);
3) HCl, H2O, NaOH;
4) Cl2, NaOH, Na2O.
12. Характер реакции среды водного раствора аммиака:
1) слабокислый;
2) сильнокислый;
3) нейтральный;
4) щелочной.
13. Гидроксид алюминия проявляет амфотерные свойства при взаимодействии:
1) только с щелочью;
2) с кислотой и щелочью;
3) только с кислотой;
4) с солью и кислотой
14. Раствор гидроксида натрия реагирует с каждым из веществ, указанных в паре:
1) оксид железа (II) и соляная кислота;
2) хлорид железа (III) и углекислый газ;
3) серная кислота и оксид кальция;
4) оксид цинка и хлорид калия.
15. Конечным продуктом в цепочке превращений на основе цинка является:
![]()
1) гидроксид цинка;
2) оксид цинка;
3) цинк;
4) цинкат калия
16. В сокращенном ионном уравнении реакции серной кислоты с гидроксидом натрия сумма коэффициентов равна:
1) 7;2) 5;3) 3; 4) 4.
17. Раствор гидроксида натрия взаимодействует с каждым веществом, указанным в ряду:
1) оксид кремния, сульфат натрия, хлоргидроксид алюминия;
2) оксид железа (II), медь, серная кислота, гидроксид алюминия;
3) оксид кремния, алюминий, соляная кислота, гидроксид цинка;
4) оксид железа (II), медь, аммиак, гидроксид цинка.
18. В водном растворе ступенчато диссоциируют:
1) KOH; 2) Cu(OH)2; 3) Ca(OH)2; 4) Al(OH)3.
19. Общая сумма всех коэффициентов в полном и сокращенном ионном уравнениях реакции между нитратом серебра и гидроксидом натрия равна ____________________ (ответ напишите цифрами– 10)
20. Гидроксид бария можно получить из
1) BaO и H2CO3;
2) BaSO4 и NaOH;
3) BaO и NaOH
4) BaO и Н2О
21. Установите соответствие:
| Реагенты | Протекает реакция |
| 1. Са(ОН)2 ® (t) … 2. NaHCO3 + NaOH(p) ® … 3. Al2O3 + Na2O ® (t) … 4. Al + H2O ® … 5. (CuOH)NO3 + HNO3 ® … 6. PbCl2 + HI ® … | А. Соединения (3) Б. Замещения (4) В. Разложения (1) Г. Нейтрализации Д. Ионного обмена (2, 5, 6) |
22. Щелочь, а затем кислоту используют при осуществлении следующих превращений:
1) CaO ® CaCO3 ® CO2;
2) FeCl2 ® Fe(OH)2 ® FeSO4;
3) K ® KOH ® K2SO4;
4) CuSO4 ® Cu(OH)2 ® CuO.
23. Сокращенным ионным уравнением Fe2+ + 2OH- = Fe(OH)2¯ может быть выражено взаимодействие между:
24.
25.
1) Fe + NaOH;
2) FeO + KOH;
3) FeCl2 + NaOH;
4) FeSO4 + Cu(OH)2.
26. Сокращенным ионным уравнением NH4++ OH- Û NH3 + H2O можно выразить результат взаимодействия веществ:
1) хлорида аммония и гидроксида натрия;
2) хлорида аммония и нитрата серебра;
3) аммиака и соляной кислоты;
4) сульфата аммония и гидроксида меди (II).
Обсуждение результатов эксперимента
В эксперименте принимали участие ученики 9 классов МОУ СОШ-лицей № 14 г. Нальчик (выборочная совокупность составляла 45 школьников и 51 студент).
В экспериментальных классах при раскрытии темы «Бериллий» были проведены разработанные уроки, приведенные в главе III. Занятия проводились с акцентом на прикладные и экологические аспекты, которые закреплялись в процессе формулирования, анализа и последующего решения целей и задач занятий.
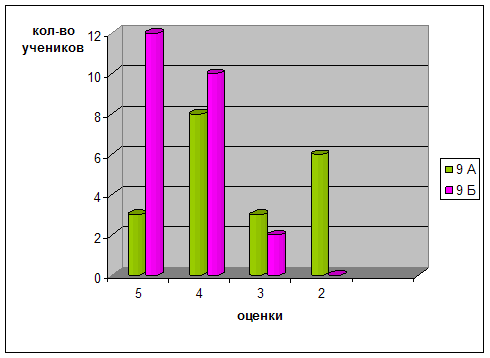
Для констатации результата после проведения разработанных занятий были проведены контрольные работы, состоящие из тестов, которые приведены в главе III. Результаты эксперимента в школе приведены в диаграммах, отражающих изменения качества знаний и успеваемости в контрольном (9 г) и экспериментальном (9 в) классах.
Диаграмма 1. Изменение успеваемости учащихся
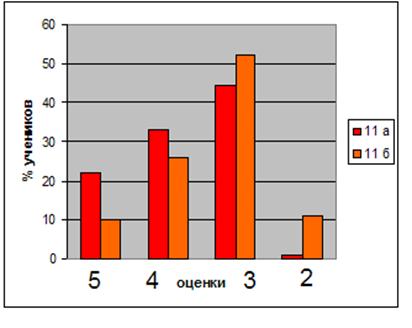
Диаграмма 2. Динамика успеваемости и качества обучения

Таким образом, можно сделать вывод, что предложенная в работе гипотеза, что разработка и реализация новых методических подходов к изучению темы «Бериллий» позволят заметно повысить уровень знаний, научной культуры, уверенности в своих способностях школьников нашла свое подтверждение в результате наших исследований.
ЛИТЕРАТУРА
1. О. В. Байдалина. О прикладном аспекте химических знании // Химия в школе, 2005, № 5, с. 45-47.
2. Ахметов Н. С. Методика преподавания темы «Закономерности протекания химических реакций» // Химия в школе. 2002, № 3, с. 15 – 18.
3. Ахметов Н. С. Учебник для 8 класса общеобразовательных учреждений. М.: Просвещение, 1998 г.
4. Рудзитис Г. Е., Фельдман Р. Г. Учебник для 8 класса средней школы. М.: Просвещение, 1992.
5. Материалы сайта www.1september.ru
6. О. С. Габриелян, Н. П. Воскобойникова, А. В. Ящукова. Настольная книга учителя. Химия. 8 класс. М.: Дрофа, 2003 г.
7. Малинин К. М. Технология серной кислоты и серы. М., Л., 1994.
8. Васильев Б. Г., Отвагина М. И. Технология серной кислоты. М., 1985.
9. Отвагина М. И., Явор В. И., Сретенская Н. С., Шарифов М. Ю. Промышленность минеральных удобрений и серной кислоты. М., НИИТЭХИМ. 1972. Выпуск № 4.
10. Резницкий И. Г. Возможности использования нитрозного способа для переработки газов автогенных процессов на серную кислоту / Цветные металлы. 1991. № 4.
11. Березина Л. Т., Борисова С. И. Утилизация фосфогипсов - важнейшая экологическая проблема // Химическая промышленность. 1999 г. № 12.
12. Громов А. П. Экологические аспекты производства серной кислоты // Экология и промышленность России. 2001, № 12.
13. Лидин Р. А. Химия: Руководство к экзаменам / Р. А. Лидин, В. Б. Маргулис. – М.: ООО Издательство «АСТ»: ООО «Издательство Астрель», 2003. с. 64 – 70.
14. Единый государственный экзамен 2002: Контрольные измерительные материалы: Химия / А. А. Каверина, Д. Ю. Добротин, М. Г. Снастина и др.; М.: Просвещение, 2002. – с. 39 – 51.
15. Химия: Большой справочник для школьников и поступающих в вузы / Е. А. Алферова, Н. С. Ахметов, Н. В. Богомолова и др. М.: Дрофа, 1999. с. 430-438
16. Р. П. Суровцева, С. В. Сафронов. Задания для самостоятельной работы по химии. М.: Просвещение, 1993 г.
ПРИЛОЖЕНИЕ 1
Вариант 1
1.Известно, что металлам соответствуют основные оксиды. Докажите, что оксид кальция – основной оксид, составив уравнения соответствующих реакций.
2.Докажите основные свойства оксида кальция, проводя соответствующие опыты
3.На воздухе кальций постепенно превращается в порошок белого цвета. Каков состав этого порошка? Приведите уравнения возможных реакций.
бериллий химический сплав урок методический
Вариант 2
1.Известно что металлам соответствует основной оксид и основание. Докажите, что гидроксид кальция – основание. Составьте уравнения соответствующих реакций, объясните их.
2.Докажите данное утверждение экспериментально, проведя не менее 2 опытов.
3.Для обнаружения углекислого газа используют раствор гидроксида кальция – известковую воду. Почему для этих целей не используют гидроксид натрия?
Приложение 2
Заполните пропуски в тексте, вставив нужные слова:
1) Мел, мрамор и известняк – это минералы в состав которых входит одно и тоже соединение ……..
2)BaSO4 – это………………………….каша
3)В какой минерал входит сульфат кальция-………………………..
4)Какой карбонат применяют в производстве цемента, стекла-…………
5)MgSO4 известен под названием ……………………соль
6)Фосфат кальция входит в состав фосфоритов, апатитов, ……………..
7)Эти соли входят в состав светящихся красок- фосфоров:…………….
Урок 2 Тема. Бериллий, магний и щелочно-земельные металлы
Цель: повторить и обобщить сведения о свойствах, способах получения и применении бериллия, магния и щелочно-земельных металлов и их соединений.
Оборудование: Периодическая система химических элементов Д.И. Менделеева (приведена в электронном учебном пособии).
Реактивы: металлический магний (лента), спиртовый раствор фенолфталеина, раствор хлорида бериллия, разбавленный раствор соляной кислоты, раствор гидроксида натрия.
Посуда и приборы: фарфоровая чашка, спиртовка, тигельные щипцы, большой стакан, ложечка для сжигания, стаканы на 200 мл (2 шт.), стеклянные палочки, магнитная мешалка.
Содержание урока соответствует части IV.3 электронного учебного пособия.
Знакомство с химией бериллия, магния и щелочно-земельных металлов и их соединений следует начать с истории открытия. Магний, кальций, стронций и барий были получены в 1808 г. английским ученым Г. Деви электролизом оксидов или гидроксидов. Бериллий был выделен в 1898 г. Лебо электролизом тетрафторбериллата натрия, хотя история его открытия насчитывает практически столетие. Радиоактивный радий открыт супругами Пьером и Марией Кюри в 1898 г. в минерале урановая смолка.
Обратить внимание, что групповое название элементов – щелочно-земельные металлы – относится только к кальцию, стронцию, барию и радию и связано с тем, что их оксиды раньше называли «землями», а при взаимодействии с водой они образуют щелочи.
Охарактеризовать положение бериллия, магния и щелочно-земельных металлов в Периодической системе химических элементов Д.И. Менделеева. Бериллий, магний и щелочно-земельные металлы относятся к s-элементам. На внешнем энергетическом уровне атомы элементов имеют 2 электрона, их электронная конфигурация ns2. Они легко отдают один электрон, проявляя степень окисления +2. Радиусы атомов возрастают при переходе от бериллия к радию, значения потенциала ионизации и относительной электроотрицательности уменьшаются. Все металлы в электрохимическом ряду напряжений располагаются до водорода и являются довольно сильными восстановителями, эта способность возрастает с увеличением заряда ядра атома.
Остановиться на распространенности металлов в земной коре, отметить, что в свободном состоянии бериллий, магний и щелочно-земельные металлы в природе не встречаются, наиболее распространенными являются магний и кальций. Содержание бериллия, стронция и бария значительно меньше. Все они входят в состав породообразующих минералов, содержатся в морской воде. Кальций входит в состав скелетных тканей живых организмов. Магний содержится в составе одного из важнейших веществ растительного мира – хлорофилле.
Отметить физические свойства металлов. Продемонстрировать образцы металлов: магния и кальция. В свободном состоянии все металлы – серебристо-белые вещества. Магний и щелочно-земельные металлы – ковкие и пластичные, довольно мягкие, хотя тверже щелочных. Бериллий отличается значительной твердостью и хрупкостью, барий при резком ударе раскалывается. Металлы имеют температуры плавления и кипения выше, чем у щелочных металлов, причем с увеличением порядкового номера элемента температура плавления металла изменяется немонотонно, что связано с изменением типа кристаллической решетки. Бериллий и магний покрыты прочной оксидной пленкой и не изменяются на воздухе. Щелочно-земельные металлы очень активны, их хранят в запаянных ампулах, под слоем вазелинового масла или керосина.
Рассмотреть химические свойства металлов. Металлы во всех химических реакциях проявляют восстановительные свойства, отдают два валентных электрона, превращаясь в положительно заряженный катион. В качестве окислителей могут выступать простые вещества – неметаллы, оксиды, кислоты, соли, органические вещества. Отметить, что бериллий и магний по свойствам значительно отличаются от щелочно-земельных металлов. При комнатной температуре они устойчивы к действию кислорода и воды благодаря наличию очень тонкой оксидной пленки.
Продемонстрировать горение магния на воздухе. Опыт провести следующим образом: предварительно очищенную наждачной бумагой магниевую ленту взять щипцами и поджечь в пламени спиртовки (опыт проводить в защитных очках), отметить яркую вспышку и большое выделение тепла. Горящую магниевую ленту держать над фарфоровой чашкой. Магний сгорает с образованием оксида:
2Mg + O2 = 2MgO.
Одновременно идет образование нитрида магния:
3Mg + N2 = Mg3N2.
Рассмотреть взаимодействие металлов с другими неметаллами (галогенами, водородом, азотом, углеродам и др.).
Обратить внимание на взаимодействие с водой. Продемонстрировать горение магния в воде. В ложку для сжигания веществ поместить магниевую пудру или мелко порезанную ленту, поджечь её в пламени спиртовки. Горящий магний опустить в стакан с водой, магний ярко вспыхивает, одновременно загорается водород:
Mg + 2H2O = Mg(OH)2 + H2.
Опыт демонстрирует химическую активность металлического магния.
Рассмотреть взаимодействие с кислотами и щелочами, отметить, что со щелочами реагирует только бериллий. Отметить восстановительные свойства магния и щелочно-земельных металлов: они могут быть использованы для получения менее активных металлов и некоторых неметаллов из их оксидов.
Рассмотреть особенности химии бериллия. Бериллий по своим свойствам значительно отличается от остальных элементов 2 группы Периодической системы химических элементов, ион Be2+ благодаря своему малому радиусу, высокой плотности заряда и большим значениям энергии ионизации устойчив только в газовой фазе. Поэтому химическая связь в бинарных соединениях бериллия обладает высокой долей ковалентности, поэтому соединения бериллия имеют довольно высокие температуры плавления и кипения. По многим свойствам бериллий похож на алюминий («диагональное сходство»). Металлический бериллий пассивируется концентрированной азотной кислотой и проявляет амфотерные свойства, реагирует с кислотами и щелочами, выделяя водород. Оксид и гидроксид бериллия также проявляют амфотерные свойства. Продемонстрировать амфотерные свойства гидроксида бериллия на примере его взаимодействия с кислотами и щелочами.
Опыт провести следующим образом. Стакан с раствором хлорида бериллия поставить на магнитную мешалку и включить перемешивание. Небольшими порциями осторожно прилить раствор гидроксида натрия до выпадения белого осадка:
BeCl2 + 2NaOH = Be(OH)2 + 2NaCl.
Прекратить перемешивание, гидроксид бериллия разделить на две части. К первой части прилить раствор соляной кислоты до растворения осадка:
Be(OH)2 + 2HCl = BeCl2 + 2H2O.
Ко второй части прилить раствор гидроксида натрия, также до растворения осадка:
Be(OH)2 + 2NaOH = Na2[Be(OH)4].
Обратить внимание учащихся, что амфотерный гидроксид бериллия реагирует и с щелочами, и с кислотами с образованием солей.
При изучении способов получения металлов особое внимание уделить получению бериллия в результате переработки берилла. Рассмотреть сернокислый, щелочной, хлоридный фторидный способы извлечения бериллия из берилла и электролиз солей бериллия. Обратить внимание, что магний и щелочно-земельные металлы очень активные и чаще всего их получают электролизом расплавов солей или алюмотермией.
Из соединений магния и кальция охарактеризовать их оксиды, гидроксиды и соли. Рассмотреть физические и химические свойства, способы получения. Оксиды магния и кальция являются основными. Гидроксид кальция малорастворим в воде, является довольно сильным основанием. Растворимость гидроксида магния еще ниже, он является основанием средней силы. Фториды, сульфаты, сульфиды, сульфиты, фосфаты и карбонаты металлов 2 группы плохо растворимы в воде, остальные соли – хорошо растворимы, проявляют все свойства солей.
Рассмотреть жесткость воды. Природная вода, содержащая ионы Ca2+, Mg2+, Sr2+ и Fe2+, называется жесткой, причем жесткость воды обуславливается главным образом ионами Ca2+ и Mg2+. Карбонатная (временная) жесткость связана с присутствием в воде гидрокарбонатов кальция и магния, некарбонатная (постоянная) жесткость – хлоридов и сульфатов. Общая жесткость воды рассматривается как сумма карбонатной и некарбонатной. Отметить способы устранения жесткости воды.
Остановиться на обнаружении щелочно-земельных металлов. Щелочно-земельные металлы и их соединения можно обнаружить по характерной окраске пламени: кальций окрашивает пламя в кирпично-красный цвет; стронций – в карминово-красный; барий – в желто-зеленый (яблочный).
Рассмотреть важнейшие области применения бериллия, магния, щелочно-земельных металлов и их соединений.
После изучения материала предложить учащимся самостоятельно познакомиться с примерами решения задач и выполнить задания для самостоятельного решения (приведены в электронном учебном пособии).
Урок 3. Роль химических элементов в организме человекаЗадачи:
· Развивать ловкость, смелость.
· Воспитывать любовь к своей земле, к национальным традициям.
Инвентарь: 2 удочки, 2 ведра, рыбки, 2 обруча, карточки с примерами (20шт), кубики, грибы 20 шт., гимнастические палки, 4 одеяла, грамоты 20 шт., скакалки(20шт.), 2 стула.
На спортивную площадку приглашаем, дети, вас! Праздник спорта и здоровья начинаем мы сейчас!
Учитель:
Сегодня вам предстоит участвовать в различных конкурсах, показать ловкость, силу, быстроту и смекалку.
Каждые 4 года проводятся олимпийские игры - самые важные спортивные соревнования. За все годы участия в олимпийских играх наши советские и российские спортсмены завоевали наибольшее кол-во золотых, серебряных и бронзовых медалей. А ведь все спортсмены -герои учились в школе, ходили на уроки физической культуры и в школе получили свои первые спортивные награды. Представим, что сильнейшие спортсмены прислали вам, новым физкультурникам, свой наказ, свои советы.
-Учиться трудно, еще труднее переучиваться. Старайся сразу все делать хорошо. Чем труднее тебе в учебе, тем легче будет на соревнованиях.
- Старайся победить, но не бойся проиграть.
- Если ты проиграл, но отдал победе все силы, нет в этом ничего постыдного; стыдись победы, для которой ты старался меньше товарищей.
- Борись за победу до последней секунды, не жалея сил, но честно.
- Не хвались, если у тебя что-то получается хорошо, помоги товарищу справиться с заданием.
- Мужество спортсмена не в том, чтобы ввязаться в драку, а в том, чтобы победить соперника в честном бою.
- Не кори товарища за ошибку, посочувствуй - он же не хотел этого.
- Будь опрятен, подтянут, ведь спортсмены всегда у всех на глазах.
-Запомни: легко ничего не дается. Чтобы добиться успеха, нужно много трудиться.
- Всегда внимательно учись, каждое слово учителя полезно - он стремится научить тебя.
Представление жюри.
За победу команда получает 3 очка, за поражение - 1.
Разминка.
Представление команд. Название. Приветствие.
Приветствие.
Команда "Спутник":
Мы приветствуем команду "Ракета"
И желаем слетать на другую планету,
Захватить с собой храбрость и смелость
И в игре показать умелость.
Приветствие.
Команда "Ракета":
А вам, наш "Спутник" дорогой,
Желаем от души,
Чтоб результаты ваши
Все были хороши.
Конкурсы.
1-й конкурс. Разминка. Карточки с примерами. Решить и передать эстафету. Листки брать с собой. Сдать карточку. Капитан передает жюри. За неправильный ответ 3 сек. штрафного времени. Одно очко тем, у кого меньше ошибок.
Объявить результаты.
2-й конкурс. "Насорил - убери". Конкурс аккуратных и прилежных. Добежать до обруча, высыпать из ведра мусор(кубики), добежать до поворотной сойки, на обратном пути "мусор" в ведро и передать эстафету.
3-й конкурс. "У медведя во бору грибы, ягоды беру". Лес-это не только место для прогулок, укрепления здоровья, но и добрая кладовая. В лесу растет много грибов и ягод. Какие грибы и ягоды растут в наших северных лесах? Собрать грибы в корзину.
Побеждает команда, закончившая раньше.
Загадка: Кто по снегу, по траве, носит лес на голове? (олень)
4-й конкурс: "Оленья упряжка" .Коренные жители Севера передвигаются по тундре на оленьих упряжках. А какие народы еще живут на Севере?
Бег в паре. Один олень - другой каюр(погонщик)
5-й конкурс: Викторина. После физической нагрузки следует отдохнуть и показать свои знания. Вопросы связаны с физической культурой и гигиеной человека.
Куда обычно ходят 1 раз в неделю, хорошо там погреются, моются и освежаются? И, конечно, помогают закаливанию организма? (баня)
Какая очень вредная привычка ухудшает здоровье и мешает хорошо учиться?(курение)
Как называется специальная спортивная обувь с резиновой подошвой? (кеды, кроссовки)
Какие зимние "друзья" помогают ребятам отдыхать и играть на горках? (лыжи, санки. А как называются сани у северных народов - нарты)
Что образуется на коже, делает её красивой если время от времени бываешь на солнце весной и летом? (загар)
Что необходимо сделать после учебы, работы, чтобы накопились новые силы? (отдохнуть)
Без чего невозможно обойтись ни человеку, ни животному, чтобы отдохнули мышцы, головной мозг и другие органы (без сна)
Как называется физ.упражнения, которые помогают перейти от сна к бодрствованию и получать заряд энергии на целый день? (зарядка)
Что считается самыми полезными продуктами, содержащими много витаминов? (овощи, фрукты).
Что считают ребята самым веселым временем, когда нет учебы в школе?(каникулы)
6-й конкурс. "Охотник". Жители Севера ходят на охоту, чтобы добыть себе пищу. Охотники ставят капканы, в которые попадается различная дичь. Одна команда - олени, другая - волки. Все участники встают в круг. Охотник в середине круга, крутит скакалку "волки" перепрыгивают, не задев ее. Кто коснулся ее - выходит. Побеждает команда, оставшаяся в большинстве. Затем меняются ролями. Каждая команда крутит скакалку 1,5 мин.
Итог конкурса.
7-й конкурс. "Ловись, рыбка, большая и маленькая"
В нашей области много озер и рек, в которых водится различная рыба, и , наверно, многие из вас уже помогали родителям ловить рыбу. И сейчас предоставляется возможность поймать ее. Осторожно бежать с удочкой. 1участник с удочкой и ведром, бежит до скамейки разматывает удочку и ловит рыбку(рыбка в обруче, скрепка во рту у рыбки, на удочке магнит),кладет ее в ведро , бежит обратно. Последний игрок сматывает удочку и возвращается обратно.
Насобирали мы грибов, наловили рыбы. Куда мы все это понесем? (домой)
В доме лишь одна стена,
Очень круглая она
До того она кругла,
Не единого угла
(Чум).
Правильно жители Севера живут в чуме.
8-й конкурс. С помощью подручных средств(одеяла, гимн.палок, скакалки)построить чум.
Хорошо мы сегодня посоревновались. И в заключении споем.
Игра "Веселый концерт"
"Спутник" поет: "В бане веники мочены"
"Ракета" поет: "Веретена не точены"
Хором: "Барыня, барыня, сударыня барыня"
Попробуем! Когда я подниму правую руку - поет 1-я команда. Если левую -2, если обе, то поем хором.
Молодцы! И петь вы умеете.
Соревновались все на славу,
Победители по праву
Похвал достойны и награды,
И мы призы, вручить вам рады.
Благодарим вас, за участье -
Вот сувениры вам на счастье! (Вручение наград и грамот)
Всем спасибо за вниманье,
За задор, за звонкий смех,
За огонь соревнований,
Обеспечивший успех.
Вот настал момент прощанья,
Будет краткой наша речь.
Говорим вам: "До свиданья,
До счастливых, новых встреч"
Похожие работы
... выше, нежели в предыдущем. Пищевые продукты, выращенные и полученные при соблюдении необходимых условий, обычно характеризуются допустимым содержанием ртути [17]. Глава III. МЕТОДИЧЕСКИЕ РАЗРАБОТКИ ПО ТЕМЕ «ЭЛЕМЕНТЫ II ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д.И.Менделеева» Эксперимент начался со знакомства с ученическим коллективом. При этом для получения представления об успеваемости класса по химии ...
... Просвещение, 1976. 35. Третьяков Ю.Д., Зайцев О.С. Программное пособие по общей и неорганической химии. М.: Юнити, 2005. 36. Фаязов Д.Ф. Формирование умений учащихся пользоваться химическим языком // Химия в школе. 1983. № 2. 37. Фигуровский Н.А. Открытие элементов и происхождение их названий. М.: Наука, 1970. 38. Цветков Л.А. Преподавание органической химии в средней ...
... такое риторика? Классический риторический канон. Общая структура публичной речи. Основной закон неориторики. Доводы к пафосу, логосу, этосу. Риторические тропы и фигуры. Цицерон об идеальном ораторе. Логика и риторика в их единстве. Термины Вербальное и невербальное общение, внешняя и внутренняя речь, дискурс, здравый смысл, идеал риторический, импровизация, инвенция, интуиция, классическая ...


0 комментариев