Навигация
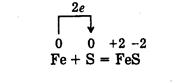
1. Fe + S = FeS
2. Fe + 2HCI = FeCI2 + H2
3. Fe + CuSO4 = FeSO4 + Cu
Fe0 - 2e = Fe+2 (восстановитель)
? Что вы наблюдали при проведении третьей реакции? (Железо вытеснило медь из раствора сульфата меди).
? Действует ли вода и кислород на железо?
Учитель. При обычных условиях вода не действует на железо, однако, в присутствии кислорода протекает следующая реакция: (на экране появляется слайд №3)

Fe(OH)3 - гидроксид железа (III) - основная часть ржавчины. Для протекания данной реакции необходимо одновременно присутствие воды и кислорода, в противном случае коррозия так и не наступит. Известно, что в течение многих столетий стоит знаменитая железная колонна в столице Индии Дели. Почему? (Там сухой воздух).
Учитель. Предлагаю учащимся провести опыт: реакцию обмена между сульфатом железа (II) и гидроксидом меди, записать уравнение химической реакции в молекулярном и ионном виде (на экране появляется слайд № 4).
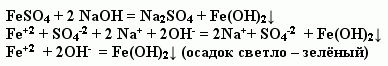
Учитель предлагает учащимся вновь вернуться к полученному осадку и посмотреть на изменение цвета.
? Как изменился цвет осадка? Что произошло?
Учитель. Соединение железа двухвалентного неустойчиво и окисляется, превращаясь в соединение железа трехвалентного бурого цвета (слайд № 5).
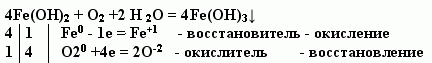
? Может вытеснять железо водород из воды?
Да, может, но только при сильном нагревании (запись на доске).
Fe + H2O = FeO +H2
Fe0 - 2e = Fe+2 - восстановитель - окисление
2H+ + 2е = Н2 - окислитель - восстановление
? Какие два оксида образует химический элемент железо? (FeO и Fe2O3)
? Какими свойствами они обладают? (Основными).
При окислении железа в высокотемпературном режиме образуется железная окалина:
3 Fe +2O2 = Fе 3O 4
Учитель. Что вы узнали во время данной остановки? Какими свойствами обладает железо как простое вещество? Сделайте вывод.
VI. Остановка № 5. “ Подумай!” (слайд № 6).
(Письменная работа, в результате которой учащиеся должны написать возможно протекающие реакции).
VII. Остановка № 6. “Значение железа” (сообщение ученика)
Биохимики раскрывают огромную роль железа в жизни растений, животных и человека. Входя в состав гемоглобина, железо обуславливает красный цвет этого вещества, от которого, в свою очередь, зависит цвет крови. В организме взрослого человека содержится 3 г железа, из них 75% входят в состав гемоглобина, благодаря которому осуществляется важнейший биологический процесс - дыхание. Железо необходимо и для растений. Оно участвует в окислительных процессах протоплазмы, при дыхании растений и в построении хлорофилла, хотя само и не входит в его состав.
Железо издавна применяется в медицине для лечения малокровия, при истощении, упадке сил.
Железо - основа всей металлургии, машиностроения, железнодорожного транспорта, судостроения, грандиозных инженерных сооружений - от башни Эйфеля до ажура железнодорожных мостов. Все, все - начиная от швейной иглы, гвоздя, топора и кончая паутиной железных дорог, плавающими крепостями - авианосцами и линкорами - и огнедышащими домнами, где рождается само железо, - состоит из железа. Железо - это металл созидания!
YIII. Подведение итогов урока. Рефлексия.
Учитель. В завершении путешествия поделитесь своими впечатлениями. Для этого допишите предложения, посвященные сегодняшнему уроку:
Сегодня я узнал (а)______________________________________
Я удивился (лась)_______________________________________
Теперь я умею _________________________________________
Я хотел (а) бы __________________________________________
Домашнее задание
3.2 Задачи
Важную роль в процессе подготовки к экзамену по химии играют задачи. Их решение способствует неформальному усвоению теоретического курса. Они включаются в экзаменационные билеты. При этом мы будем рассматривать некоторые наиболее типовые задачи с решениями [5, 11, 12].
1.Почему применение чистого железа ограничено?
Ответ Чистое железо достаточно легко корродирует, поэтому его надо каким-то образом защищать от коррозии- либо покрывать защитным покрытием, либо применять в виде сплавов.
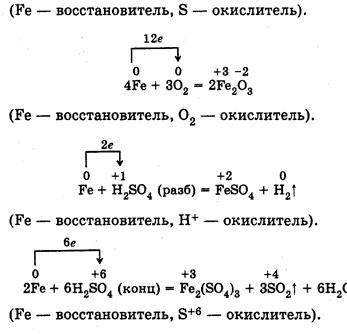
2. Составьте уравнения реакций железа с простыми и сложными веществами. Покажите переход электронов и поясните, что окисляется и что восстанавливается
3. Требуется скрепить железные детали. Какими заклепками следует пользоваться — медными или цинковыми, чтобы замедлить коррозию деталей? Ответ обоснуйте.
Ответ: Если скрепить железные детали медными заклепками, то процесс электрохимической коррозии железа усилится, поскольку медь — менее активный металл, чем железо. Поэтому надо пользоваться цинковыми заклепками, которые замедляют коррозию железа. При этом сами заклепки буду корродировать быстрее, чем в отсутствие железа.
4. Вычислите массовые доли железа в соединениях: ![]() ,
, ![]()
![]() ,
, ![]() . В каком из этих соединений массовая доля железа наибольшая?
. В каком из этих соединений массовая доля железа наибольшая?
5. Минерал содержит 72, 36% железа и 27, 64% кислорода. Определите формулу минерала.
6. Сколько граммов сульфата железа (II) можно получить при растворении 140г железа в разбавленной серной кислоте?
7. Сколько граммов гидроксида железа (III) можно получить при взаимодействии 120г гидроксида натрия с избытком хлорида железа (III)?
3.3 Тесты
1.Хлорид железа (II) получают реакцией:
а) ![]()
б) ![]() +
+
в)![]()
г) ![]()
2.Какова электронная конфигурация атома железа
а) ![]()
б)![]()
в)![]() +
+
г)![]()
3. С какими из указанных веществ реагирует железо
а) ![]() +
+
б)![]()
в)![]() +
+
г)![]()
4. Взаимодействие соляной кислоты с оксидом железа (II) относится к реакции:
а) разложения
б) соединения
в) замещения
г) обмена +
5. О простом веществе железо идет речь в выражении
а) железо входит в состав стали
б) железо входит в состав ржавчины
в) железо входит в состав железного купороса
г) железо притягивается магнитом +
6. Химическое равновесие в системе ![]()
сместится в сторону продукта реакции при
а) повышении давления
б) повышении температуры
в) понижении давления
г) использовании катализатора
7.Сумма коэффициентов перед формулами неэлектролитов в уравнении реакции ![]() равно
равно
а)2 +
б) 3
в) 4
г)5
8. Концентрированную азотную кислоту можно транспортировать в стальных цистернах так как :
а) железо не растворяется в кислотах
б) азотная кислота не действует на металлы
в) концетрированная азотная кислота не реагирует с железом +
г) азотная кислота является сильным электролитом
9. Коэффициент перед формулой восстановителя в уравнении реакции алюминия с оксидом железа (II) равен
а) 1
б)2 +
в)3
г)4
10. Химическое равновесие в системе ![]()
не смещается при
а) повышении давления +
б) повышении температуры
в) понижении температуры
г) добавлении водорода
11. Осадок образуется при взаимодействии растворов хлорида железа (III) и
а) гидроксида натрия +
б) сульфата натрия
в) соляной кислоты
г) нитрата меди (II)
12. Формула вещества, обозначенного «Х» в схеме превращений
![]()
а) ![]()
б) ![]()
в)![]() +
+
г)![]()
13. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между растворами сульфата железа (II) с гидроксидом бария равны
а) 9 и 5
б) 9 и 7
в) 7 и 5
г) 7 и 7 +
14. При нагревании 28г железа с 32г серы образуется сульфид железа ![]() (Mr=88) массой:
(Mr=88) массой:
а) 32г
б)38г
в)44г +
г)60г
15. Растворение желез в соляной кислоте будет замедляться при:
а) увеличении концентрации кислоты
б) раздроблении железа
в) разбавлении кислоты +
г)повышении температуры
16. Химическое равновесие в системе ![]() сместится в сторону исходных веществ при
сместится в сторону исходных веществ при
а) повышении давления
б) повышении температуры
в) понижении давления
г) понижении температуры +
17. При взаимодействии с хлором железо проявляет свойства
а) окислительные
б) кислотные
в) восстановительные +
г) основные
18. Сокращенное ионное уравнение ![]() соответствует взаимодействию:
соответствует взаимодействию:
а) раствора соли железа (II) с раствором щелочи +
б) раствора соли железа (II) со щелочью
в) раствора соли железа (II) с нерастворимым основанием
г) нерастворимой соли железа (II) с нерастворимым основанием
19. В уравнении реакции железа с хлором с образованием хлорида железа (III) коэффициент перед формулой соли равен:
а) 1
б) 2 +
в) 3
г) 4
20. Соляная кислота может взаимодействовать со всеми веществами группы
а) железо, оксид железа (III), гидроксид меди (II) +
б) цинк, оксид кремния (IV), гидроксид меди (II)
в) медь, оксид меди (II), гидроксид меди (II)
г) сера, оксид серы (IV), оксид серы (VI)
21. При пропускании водорода над раскаленным оксидом железа (III) водород играет роль:
а) восстановителя +
б) катализатора
в) окислителя
г) и восстановителя, и окислителя
22. В уравнении реакции, схема которой ![]() коэффициент перед формулой восстановителя равен:
коэффициент перед формулой восстановителя равен:
а)1
б) 2
в) 3
г) 4 +
23. В химических реакциях Fe2+выполняет роль:
а) окислителя;
б) восстановителя; +
в) окислителя или восстановителя в зависимости от условий.
24. FeCl3+NaOH![]()
а) Fe3+ +3OH- ![]() Fe(OH)3 +
Fe(OH)3 +
б) Fe2+ +2OH- ![]() Fe(OH)2
Fe(OH)2
в) Fe3+ + OH- ![]() Fe(OH)3
Fe(OH)3
25.Fe(NO3)2+K3PO4![]()
а) 2Fe3+ + 3PO42- ![]() Fe2(PO4)3
Fe2(PO4)3
б) 3Fe2+ +2PO43- ![]() Fe3(PO4)2 +
Fe3(PO4)2 +
в) Fe2+ + PO42- ![]() Fe PO4
Fe PO4
26. Fe2O3+HCl![]()
а) Fe2O3+6H+ ![]() 2Fe3+ +3H2O +
2Fe3+ +3H2O +
б) 2Fe3+ + O32+ +6H+![]() Fe3+ + 3Н2О
Fe3+ + 3Н2О
в) Fe2O3+6H+![]() 2Fe2+ + 3Н2О
2Fe2+ + 3Н2О
27. LiOH+FeCl2![]()
а) Fe2+ +2OH- ![]() Fe(OH)2
Fe(OH)2
б) Fe3+ + 3OH- ![]() Fe(OH)3
Fe(OH)3
в) Fe2+ +OH- ![]() Fe(OH)2 +
Fe(OH)2 +
28.
| № | Дана схема реакции | № ответа | Полуреакция в электронном балансе |
| 1. 2. 3. 4. 5. | Fe+Cl2 Li+H2 Fe+HCl Li+H2O FeO+HCl | А) Б) Г) Д) E) | H20 +2e- Cl20+2e- 2H++2e- 2Cl- - 2e- Fe0 -2e- Fe0 -3e- |
Похожие работы
... учащихся Диаграмма 2. Динамика успеваемости и качества обучения Таким образом, можно сделать вывод, что предложенная в работе гипотеза, что разработка и реализация новых методических подходов к изучению темы «Бериллий» позволят заметно повысить уровень знаний, научной культуры, уверенности в своих способностях школьников нашла свое подтверждение в результате наших исследований. ЛИТЕРАТУРА ...
... . - Формирование навыков техники выполнения эксперимента, умения решать расчетные и качественные задачи, составлять уравнения химических реакций, протекающих при электролизе растворов и расплавов электролитов.- Воспитание самостоятельности, организованности, формирование умения работать в группе, развитие творческих способностей, логического мышления, внимания, памяти. Оборудование: компьютер, ...
... письменных контрольных работ представляет не меньше трудности для учителя, чем устный опрос. Перед составлением планов по предмету на полугодие каждый учитель уточняет тот объем знаний, умений и навыков по химии, который должен иметь учащийся, и определяет те основные вопросы, по которым будут проводиться письменные контрольные работы. Сроки проведения контрольных работ учитель указывает в ...
... полученные химические знания и умения они могли успешно применить в практике нашего коммунистического строительства. Производственный материал в курсе химии средней школы должен не мешать, а наоборот, содействовать нормальному процессу освоения теоретических основ химии. Ознакомление учащихся с химическими производствами может иметь успех лишь в том случае, если оно осуществляется не в отрыве, ...




0 комментариев