Навигация
Электрохимическое перенапряжение
1.5.3 Электрохимическое перенапряжение
При рассмотрении теоретических сведений о концентрационной поляризации было допущено, что концентрация частиц, участвующих в электродной реакции, мала по сравнению с общей концентрацией раствора, и скорость электродного процесса определяется только доставкой разряжающихся частиц к поверхности электрода. Однако в достаточно концентрированных растворах в условиях перемешивания скорость доставки разряжающихся частиц к электроду настолько велика, что их концентрация практически не отличается от концентрации в глубине раствора. В данном случае поляризация электрода определяется замедленностью какой-либо из стадий электродной реакции (ионизация или разряд) и носит, название электрохимической поляризации.
Перенапряжение (поляризация) перехода (разряд или ионизация) возникает, как было отмечено выше, когда наиболее медленной стадией электродного процесса является собственно электрохимическая реакция.
Скорость катодной и анодной реакций
![]()
в электрохимической системе выражается соответственно уравнениями
 (1.15)
(1.15)
где ![]() – изменение энергии активации Гиббса, составляющее некоторую долю α от величины изменения энергии Гиббса реакции
– изменение энергии активации Гиббса, составляющее некоторую долю α от величины изменения энергии Гиббса реакции ![]() ; α - коэффициент переноса, показывающий, какую часть от разности энергии иона в кристаллической решетке металла и электролита раствора составляет энергия активации его электрохимической реакции.
; α - коэффициент переноса, показывающий, какую часть от разности энергии иона в кристаллической решетке металла и электролита раствора составляет энергия активации его электрохимической реакции.
При малых перенапряжениях уравнение поляризационной кривой оценивается уравнением

![]()
При высоких значениях перенапряжения, когда![]() , перенапряжению при катодной реакции приписывают отрицательный знак, при анодной реакции – положительный. Отсюда величины катодного и анодного токов выражаются уравнениями:
, перенапряжению при катодной реакции приписывают отрицательный знак, при анодной реакции – положительный. Отсюда величины катодного и анодного токов выражаются уравнениями:
![]() (1.16)
(1.16)
![]() (1.17)
(1.17)
![]()
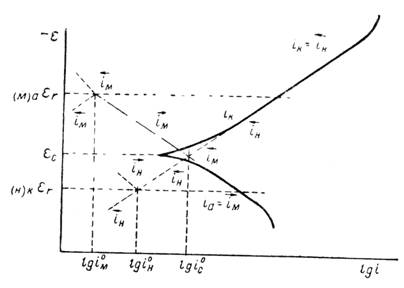
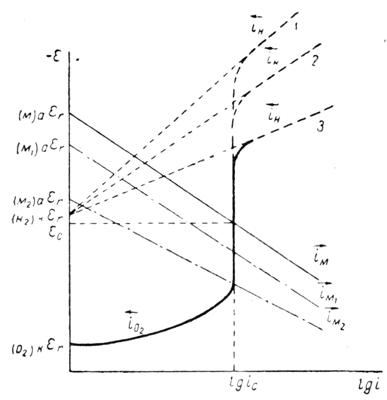
Последнее уравнение было получено Тафелем (1905) при экспериментальном определении перенапряжения водорода.
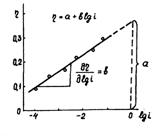
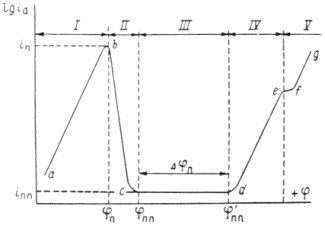
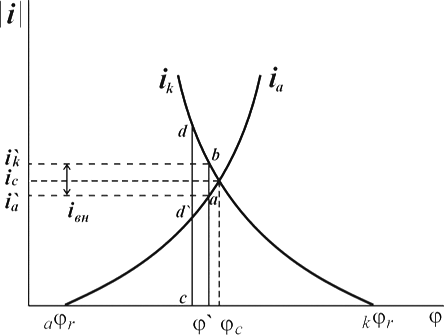
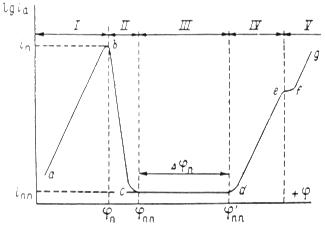
Рисунок 1.5 – Диаграмма для определения констант а, b в уравнении Тафеля.
Используя катодные и анодные поляризационные кривые, осуществляя экстраполяцию их линейных участков, подчиняющихся уравнению Тафеля, на η = 0, возможно найти плотности тока обмена, а также α – коэффициент переноса заряда по углам наклона прямолинейных участков в координатах η – lgi [31].
1.6 Методы защита металлов от коррозии
Основным условием противокоррозионной защиты металлов является уменьшение скорости коррозии. Уменьшить скорость коррозии можно:
• путем подбора соответствующих коррозионностойких сплавов;
• изменением состава агрессивной среды;
• применением защитных покрытий;
• изоляцией металла от агрессивной среды слоем более стойкого материала;
• электрохимическими методами защиты.
Первую группу методов защиты применяют на стадии изготовления металла, в процессе его термической и механической обработки. Принципы легирования и создания сплавов с определенными коррозионными и эксплуатационными характеристиками рассматривались ранее.
Вторая группа методов борьбы с коррозией — это обработка среды с целью уменьшения ее агрессивности путем введения ингибиторов коррозии. Эти методы находят все более широкое применение.
Нанесение изолирующего покрытия на поверхность металла позволяет в значительной степени снизить скорость его коррозии. Этот метод является универсальным и его давно применяют. Различают органические, например, лакокрасочные, и неорганические (гальванические, фосфатные и т.д.) покрытия. В ряде случаев для повышения защитного действия комбинируют неорганическое и органическое покрытие. Особенно часто применяют фосфатирование в качестве промежуточного слоя, обеспечивающего хорошую адгезию к металлу. В этом случае защитная способность органического покрытия возрастает в несколько раз.
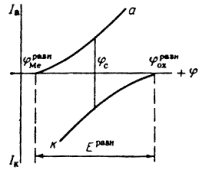
К электрохимическим методам борьбы с коррозией относятся такие, в основе которых лежит принцип непосредственного воздействия на скорость протекания сопряженных анодных и катодных реакций. Прежде всего это выражается в изменении потенциала защищаемого металла. Различают катодную и анодную электрохимическую защиту [28, 34].
Похожие работы
... составов, застойные воды и некоторые органические продукты. Электрохимическая коррозия подчиняется законам электрохимической кинетики. Скорость ее можно определить на основе законов Фарадея. Электрохимическая коррозия встречается чаще всего и наиболее опасна для металлов. Она может протекать в газовой атмосфере, когда на поверхности металла возможна конденсация влаги (атмосферная коррозия), в ...
... и их содержимым. Способ изящен, и его применение, по-видимому, будет расширяться, как только будут преодолены сложности измерения и контроля. Покрытия, как метод защиты металлов от коррозии. Защита металлов, основанная на изменение их свойств, осуществляется или специальной обработкой их поверхности, или легированием. Обработка поверхности металла с целью уменьшения коррозии проводится одним ...
... Основным критерием, характеризующим состояние поверхности металла, является электродный потенциал. Обычно возможность применения анодной защиты для конкретного металла или сплава определяют методом снятия анодных поляризационных кривых. При этом получают следующие данные: а) потенциал коррозии металла в исследуемом растворе; б) протяженность области устойчивой пассивности; в) плотность тока в ...
... обратимых потенциалов кислородного электрода при различных рН среды и Р P (атм) V ,B, при рН среды рН=0 рН=7 рН=14 0,21 +1,218 +0,805 +0,381 1 +1,229 +0,815 +0,400 Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой ...


0 комментариев