Навигация
Увеличение степени защиты стали от коррозии в нейтральных и кислых средах
Аннотация
Работа посвящена проблеме увеличения степени защиты стали от коррозии в нейтральных и кислых средах, при использовании фосфорсодержащих ингибиторов, а также совершенствованию дискретных методов определения скорости коррозии.
В первом разделе работы приведен анализ литературных данных по изучаемой проблеме.
Во втором разделе содержатся результаты расчета термодинамических параметров основной реакции.
В третьем разделе представлены результаты расчета материального баланса процесса получения борат метилфосфита.
Четвертый и пятый разделы, соответственно, посвящены расчету теплового баланса стадии синтеза, разработке структурно-функциональной схемы процесса и расчету одного из аппаратов.
Шестой раздел содержит описание объектов и методов исследования, результаты проведенных экспериментов.
Содержание
Введение
1. Литературный обзор1.1 Проблема коррозии
1.2 Механизм коррозионных разрушений1.3 Виды коррозионных разрушений
1.4 Термодинамическая оценка процесса электрохимической коррозии
1.5 Кинетическое обоснование процесса коррозии
1.5.1 Поляризация электродных процессов
1.5.2 Концентрационная поляризация
1.5.3 Электрохимическое перенапряжение
1.6 Методы защита металлов от коррозии
1.7 Классификация ингибиторов
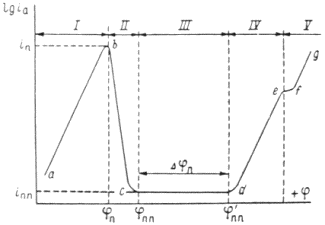
1.8 Методы определения скорости коррозии
1.9 Датчики скорости коррозии
2. Обсуждение результата термодинамического анализа
2.1 Эмпирические методы расчета термодинамических величин2.1.1 Метод Неймана-Коппа
2.1.2 Методы приближенного расчета энтропии и теплот образования веществ
2.2 Расчет термодинамических характеристик основной реакции3. Расчет материального баланса
4. Тепловой баланс стадии синтеза
5. Структурно-функциональная схема и расчет емкостного аппарата
5.1 Описание структурно-функциональной схемы
5.2 Расчет емкостного аппарата
6. Экспериментальная часть
6.1 Объекты и методы исследования
6.2 Синтез целевого продукта
6.3 Кинетические исследования
6.4 Определение степени защиты
7. Методическая часть
Выводы
1. Литературный обзор
1.1 Проблема коррозии
Коррозия металлов и сплавов в агрессивных средах наносит огромный ущерб. В результате коррозии преждевременно выходят из строя нефте-, газо- и водопроводы, металлические конструкции, аппараты, машины и оборудование. Прямые потери от коррозии (потери стоимости выбывших из строя основных фондов, затраты на противокоррозионную защиту, на капитальные и текущие ремонты по причине коррозии) в промышленно развитых странах составляют 2–5% национального дохода, потери металлофонда – 15–30% его ежегодной выплавки. Косвенные потери, согласно ориентированным расчетам превышают прямые в 1,5 – 2 раза [28].
Несмотря на большие возможности, которыми располагает современная техника защиты металлов, расходы, связанные с коррозией металлических изделий, конструкций и оборудования весьма велики.
Ежегодные затраты на защиту от коррозии оборудования из стали достигают примерно 20% стоимости вновь изготовленных сооружений и тенденция роста этих затрат не уменьшается [34]. Поэтому разработка мероприятий, направленных на повышение коррозионной стойкости металлов и изделий из них, является весьма актуальной задачей.
Научно-исследовательские работы по проблеме коррозии металлов в различных агрессивных средах ведутся, в основном, по следующим направлениям:
· создание новых коррозионно-стойких конструкционных материалов;
· разработка способов защиты от коррозии конструкций, оборудования и материалов [31].
В настоящее время, вызывает интерес разработка средств технического контроля и обеспечения защиты конструкций и оборудования от коррозии металлов. Наиболее важно это для химической и нефтехимической промышленности, с целью увеличения эксплутационных ресурсов химического оборудования путем своевременного диагностирования и защиты.
1.2 Механизм коррозионных разрушений
Самопроизвольное окисление металлов, вредное для промышленной практики (уменьшающее долговечность изделий), называется коррозией. Среда, в которой металл подвергается коррозии (корродирует), называется коррозионной, или агрессивной. При этом образуются продукты коррозии: химические соединения, содержащие металл в окисленной форме.
Термин «коррозия» имеет не столько научное, сколько инженерное значение. Правильнее было бы употреблять термин «окисление», независимо от того, вредно или полезно оно для нашей практики [33].
По механизму протеканию различают электрохимическую и химическую коррозии.
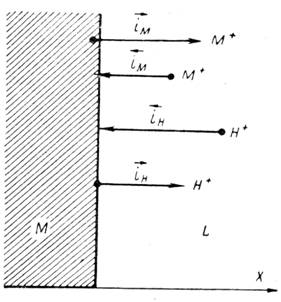
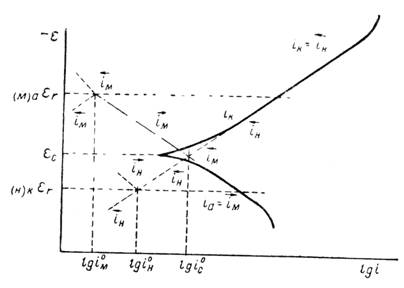
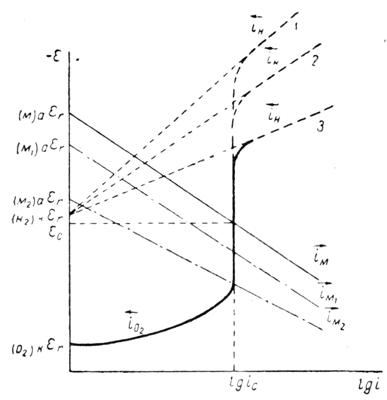
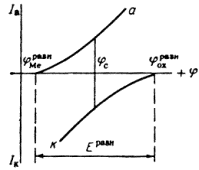
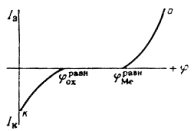
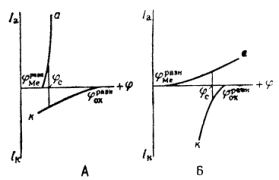
Электрохимическая коррозия металлов возникает при взаимодействии металлов с электролитами. Причиной ее является термодинамическая неустойчивость металлов в этих средах. Поверхностные атомы металла способны переходить в раствор электролита в виде ионов. Этому способствует гидратация ионов металла. Поэтому положительные ионы в растворе сосредоточиваются около поверхности металла. На границе металл – раствор образуется двойной электрический слой. В результате этого скорость перехода катионов металла в раствор приближается к скорости осаждения их из раствора на металле. Через некоторое время наступает динамическое равновесие и растворение металла прекращается. Однако в случае отвода избыточных электронов процесс растворения металла продолжится. Такой процесс возможен при образовании короткозамкнутых гальванических элементов. При этом одновременно протекают два электродных процесса:
· анодный процесс – переход ионов металла в раствор и накопление избыточных электронов в металле:
![]() (1.1)
(1.1)
· катодный процесс – ассимиляция избыточных электронов ионами, атомами или молекулами электролита (деполяризаторами– Д), которые при этом восстанавливаются:
![]() (1.2)
(1.2)
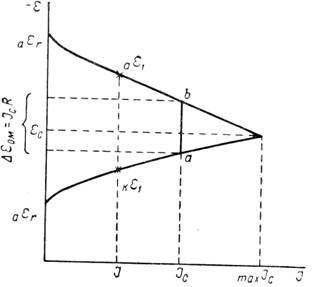
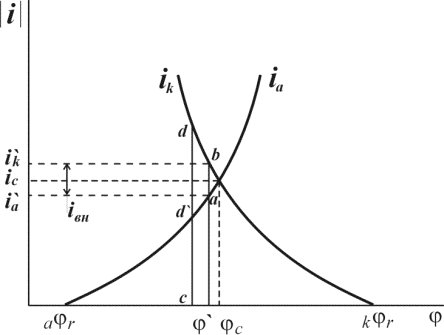
Эти две «полуреакции» составляют единый процесс. Согласно современной кинетической теории коррозии металлов являются сопряженными, то есть одна не может протекать без участия второй, и скорость всего процесса определеятся соотношением скоростей обеих реакций [10, 28].
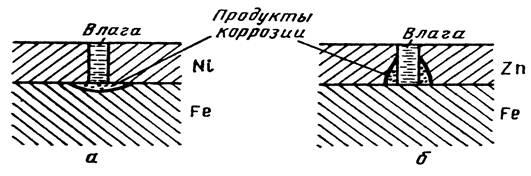
Окисление металла и восстановление окислителя могут протекать на одном и том же участке поверхности металла, но могу быть и разделены пространственно. В силу высокой электропроводности металлов, электроны легко мигрируют по поверхности электрода, зоны перемещения электронов очень подвижны и хаотичны. Например, под влиянием различных причин они могу локализоваться в одном месте, вызывая местную (неравно мерную) коррозию [31].
Особенностью химической коррозии является образование продуктов коррозии непосредственно в месте взаимодействия металлов с агрессивной средой. По условиям протекания процесса различают:
· газовую коррозию;
· коррозию в неэлектролитах (например, в сернистой нефти, крекинг-бензинах, сырых фенолах, спиртах и др.).
Наибольшее значение имеет газовая коррозия. Она проявляется при высоких температурах [5, 10].
Похожие работы
... составов, застойные воды и некоторые органические продукты. Электрохимическая коррозия подчиняется законам электрохимической кинетики. Скорость ее можно определить на основе законов Фарадея. Электрохимическая коррозия встречается чаще всего и наиболее опасна для металлов. Она может протекать в газовой атмосфере, когда на поверхности металла возможна конденсация влаги (атмосферная коррозия), в ...
... и их содержимым. Способ изящен, и его применение, по-видимому, будет расширяться, как только будут преодолены сложности измерения и контроля. Покрытия, как метод защиты металлов от коррозии. Защита металлов, основанная на изменение их свойств, осуществляется или специальной обработкой их поверхности, или легированием. Обработка поверхности металла с целью уменьшения коррозии проводится одним ...
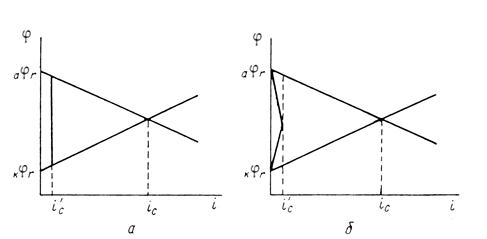
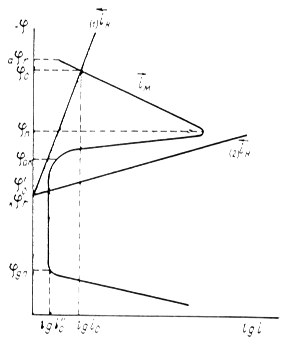
... Основным критерием, характеризующим состояние поверхности металла, является электродный потенциал. Обычно возможность применения анодной защиты для конкретного металла или сплава определяют методом снятия анодных поляризационных кривых. При этом получают следующие данные: а) потенциал коррозии металла в исследуемом растворе; б) протяженность области устойчивой пассивности; в) плотность тока в ...
... обратимых потенциалов кислородного электрода при различных рН среды и Р P (атм) V ,B, при рН среды рН=0 рН=7 рН=14 0,21 +1,218 +0,805 +0,381 1 +1,229 +0,815 +0,400 Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой ...


0 комментариев