Навигация
Экспериментальная часть
6. Экспериментальная часть
6.1 Объекты и методы исследования
Основными объектами исследования в данной работе является полученные при взаимодействии борной кислоты с диметилфосфитом – борат метилфосфит.
В работе изучалась кинетика процесса, с целью определения активационных параметров процесса, свойства и ингибирующая способность борат метилфосфита, в нейтральной и кислой средах двумя методами: с применением стандартных и новых разработанных методик.
Для исследования полученного соединения применялись следующие методы:
Исследование кинетики процесса проводили при мольном соотношении борной кислоты и диметилфосфита 1:3 по количеству выделившегося метанола.
Определение степени защиты от коррозии стали Ст3 в зависимости от концентрации борат метилфосфита в водных средах по ГОСТ 9.506-87 (СТ СЭВ 57733-86).
Определение степени защиты от коррозии стали Ст3 в зависимости от концентрации борат метилфосфита в кислоых средах по ГОСТ 9.505-87 (СТ СЭВ 5296-85).
Определение степени защиты от коррозии стали Ст3 в зависимости от концентрации борат метилфосфита в кислотных и нейтральных средах, с помощью индуктивного датчика.
6.2 Синтез целевого продукта
В данной работе проводится синтез борат метилфосфита по схеме:
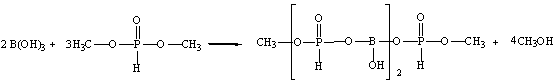
Взаимодействие протекало в интервале температур от 90 до 120оС в течение двух часов с одновременной отгонкой метилового спирта. При мольном соотношении борной кислоты и диметилфосфита 1:3. Не прореагировавший диметилфосфит отгоняли при температуре 180оС в течение трех часов. Полученную смесь охлаждали до 20оС. Продукт реакции представляет собой маловязкую неокрашенную жидкость, хорошо растворимую в воде, диметилформамиде, ацетоне, спиртах.
6.3 Кинетические исследования
С целью определения активационных параметров исследовали кинетику реакции. Кинетическое исследование проводили при соотношении диметилфосфита и борной кислоты 1:3 по количеству выделившегося метанола. Кинетические кривые представлены на рис.6.1. Порядок реакции определяли графическим методом (рис.6.2.). Установлено, что взаимодействие диметилфосфита и борной кислоты протекает в соответствии с кинетическим уравнением второго порядка, на основании которого рассчитаны константы скорости реакции.

Рисунок 6.1 – Зависимость выхода метанола от продолжительности реакции.
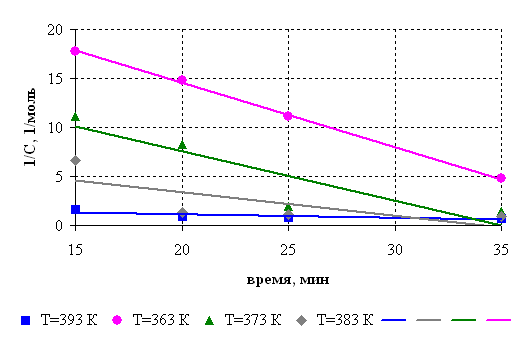
Рисунок 6.2 – Зависимость обратной величины количества реакционного метанола от времени.
Условия синтеза: борная кислота : диметилфосфит =1:3 (моль/моль), [СБК] = 0,93 моль, [Сдмф] = 2,79 моль. Температура: 363 К; 373 К; 383 К; 393 К.
Таким образом, скорость реакции пропорциональна концентрациям борной кислоты и диметилфосфита в первой степени и сопровождается образованием промежуточных комплексов.
Установлено, что кинетическая вязкость и молекулярная масса снижаются с увеличением количества диметилфофита в реакционной массе, что позволяет судить о прохождении реакции олигомеризации.
Поскольку анаморфоза в координатах ln(Кср) – ( 1/Т ) представлена линейной зависимостью, то активационные параметры поликонденсации подчиняются уравнению Аррениуса (рис.6.3).
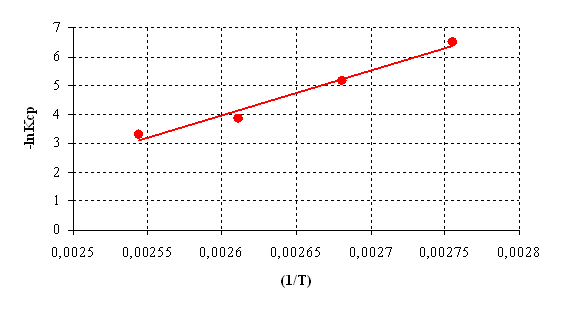
Рисунок 6.3 – Температурная зависимость скорости реакции борной кислоты с диметилфосфитом
Расчет энергии активации и термодинамических параметров реакции проводили с использованием метода наименьших квадратов. Полученные значения констант средних скоростей реакции сведем в таблицу.
Таблица 6.1 – Активационные параметры реакции
| Температура, К | Кср·102, л/моль·с | Еакт, кДж/моль |
| 363 | 0,1476 | 12,449 |
| 373 | 0,5699 | |
| 383 | 2,1197 | |
| 393 | 3,6655 |
Похожие работы
... составов, застойные воды и некоторые органические продукты. Электрохимическая коррозия подчиняется законам электрохимической кинетики. Скорость ее можно определить на основе законов Фарадея. Электрохимическая коррозия встречается чаще всего и наиболее опасна для металлов. Она может протекать в газовой атмосфере, когда на поверхности металла возможна конденсация влаги (атмосферная коррозия), в ...
... и их содержимым. Способ изящен, и его применение, по-видимому, будет расширяться, как только будут преодолены сложности измерения и контроля. Покрытия, как метод защиты металлов от коррозии. Защита металлов, основанная на изменение их свойств, осуществляется или специальной обработкой их поверхности, или легированием. Обработка поверхности металла с целью уменьшения коррозии проводится одним ...
... Основным критерием, характеризующим состояние поверхности металла, является электродный потенциал. Обычно возможность применения анодной защиты для конкретного металла или сплава определяют методом снятия анодных поляризационных кривых. При этом получают следующие данные: а) потенциал коррозии металла в исследуемом растворе; б) протяженность области устойчивой пассивности; в) плотность тока в ...
... обратимых потенциалов кислородного электрода при различных рН среды и Р P (атм) V ,B, при рН среды рН=0 рН=7 рН=14 0,21 +1,218 +0,805 +0,381 1 +1,229 +0,815 +0,400 Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой ...


0 комментариев