Навигация
Определение степени защиты
6.4 Определение степени защиты
Определение степени защиты борат метилфосфита в нейтральных средах определяли по ГОСТ 9.506-87 (СТ СЭВ 57733–86) гравиметрическим методом, на образцах изготовленных из стали Ст3 в виде полоски труб длинной 45 мм диаметром 20 мм и толщиной стенки 2 мм (по ГОСТ 1050–74). Заранее подготовленные образцы, отшлифованные до шероховатости 0,4 мкм, обезжиривают и взвешивают на аналитических весах.
В качестве коррозионной среды использовалась модель минерализованной пластовой воды, плотностью 1,12 г/см3, состава г/дм3:
кальций хлористый 6-водный –34,00
магний хлористый 6-водный по ГОСТ 4209-77 –17,00
натрий хлористый по ГОСТ 4233-77 –163,00
кальций сернокислый 2-водный по ГОСТ 3210-77 –0,14
Приготовленной на дистиллированной воде, используя реактивы квалификации ч.д.а.
Испытания проводили при температуре 40 оС, в течении 6 часов, в средах без ингибитора и с ингибитором концентрацией 200 мг/дм3 и 250 мг/дм3.
Результаты испытаний представим в таблице:
Таблица 6.2 – Результаты испытаний борат метилфосфита в нейтральной среде
| № | Концентрация ингибитора, мг/дм3 | mнач, г | mкон, г | Скорость коррозии, г/м2·час | Скорость коррозии средняя, г/м2·час | Защитный эффект % |
| 1 | --- | 30,0856 | 30,0714 | 0,838 | 0,838 | --- |
| 2 | 30,1247 | 30,1105 | 0,840 | |||
| 3 | 30,0985 | 30,0843 | 0,836 | |||
| 1 | 200 | 30,0758 | 30,0754 | 0,021 | 0,022 | 97,3 |
| 2 | 30,1054 | 30,1050 | 0,022 | |||
| 3 | 30,1197 | 30,1193 | 0,023 | |||
| 1 | 250 | 30,1612 | 30,1612 | 0 | 0 | 100 |
| 2 | 30,1143 | 30,1143 | 0 | |||
| 3 | 30,1529 | 30,1529 | 0 |
Определение степени защиты борат метилфосфита в кислых средах определяли по ГОСТ 9.505-87 (СТ СЭВ 5296–85) гравиметрическим методом, на образцах изготовленных из стали Ст3 в виде полоски труб длинной 45 мм диаметром 20 мм и толщиной стенки 2 мм (по ГОСТ 1050–74). Заранее подготовленные образцы, отшлифованные до шероховатости 0,4 мкм, протравливают в растворе серной кислоты, обезжиривают и взвешивают на аналитических весах.
В качестве агрессивной среды использовался 1,5н раствор соляной кислоты.
Испытания проводили при температуре 40оС, в течении 60 минут, в средах без ингибитора и с ингибитором концентрацией 500 мг/дм3 и 2000 мг/дм3.
Результаты испытаний представим в таблице:
Таблица 6.3 – Результаты испытаний борат метилфосфита в кислых средах
| № | Концентрация ингибитора, мг/дм3 | mнач, г | mкон, г | Скорость коррозии, г/м2·час | Скорость коррозии средняя, г/м2·час | Защитный эффект % |
| 1 | --- | 30,0905 | 29,3999 | 244,41 | 244,07 | --- |
| 2 | 30,1165 | 29,4267 | 243,85 | |||
| 3 | 30,1039 | 29,4148 | 243,94 | |||
| 1 | 500 | 30,0680 | 29,9639 | 36,66 | 36,61 | 86 |
| 2 | 30,1078 | 30,0043 | 36,58 | |||
| 3 | 30,1292 | 30,0261 | 36,59 | |||
| 1 | 2000 | 30,1712 | 30,1547 | 5,87 | 5,86 | 97,9 |
| 2 | 30,1133 | 30,0968 | 5,85 | |||
| 3 | 30,1607 | 30,1443 | 5,85 |
Исследование защитных свойств борат метилфосфита с помощью индуктивных датчиков
Как отмечалось выше, гравиметрический метод является дискретным. То есть значения скорости коррозии, полученные при использовании этого метода, являются усредненными. Ввиду этого устранение данного недостатка представляет собой нетривиальную задачу.
Решить поставленную задачу можно, путем установления функциональных зависимостей между массой образца и каким либо физическим параметром материала, который можно измерять непрерывно.
В данной работе использовалась схема дифференциального индуктивного преобразователя.

Рисунок 6.4 – Дифференциальная схема индуктивного преобразователя
Представленная схема подключения представляет собой двухплечевой мост, в котором две катушки индуктивности последовательно соединены с активными сопротивлениями. В одну из катушек вводят исследуемый образец, другую оставляют свободной.
Особенности данной схемы включения таковы, что она обеспечивает высокую чувствительность и линейную зависимость падения напряжения на катушки от ее индуктивности:
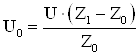 ,
,
где U – питающее напряжение = 3 В. Z1 – сопротивление катушки с сердечником (образцом), Z0 – сопротивление катушки без сердечника (величина постоянная). Общее сопротивление катушки Z равно:
![]() ,
,
где R – омическое сопротивление катушки, ω – угловая частота питающего напряжения, L – индуктивность катушки. Из формулы видно, что величины ω, R – в условиях опыта есть величины постоянные. Таким образом общее сопротивление катушки зависит от ее индуктивности L.
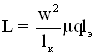 ,
,
где w – число витков в катушки, lк – длина катушки, μ – магнитная проницаемость образца, q – поперечное сечение катушки, lэ – эквивалентное линейное перемещение, под которой понимаем такое количество материала (массу), которое соответствует линейному перемещению на ширину одного витка. Таким образом, очевидно, что индуктивность катушки будет являться некоторой функцией от количества материала (массы) находящейся в ней или L = f(m), при условии что w, lк, q, μ – const.
И если линейные параметры катушки в действительности являются неизменными, то магнитная проницаемость системы будет меняться во времени. Ввиду того, что в процессе коррозионного разрушения, магнитная проницаемость среды будет меняться, и накладываться на общее значение индуктивности, это проблема была устранена установлением второй катушки без образца Z2, которая также находится в среде и является катушкой сравнения.
Так как при разрушении металла на его поверхности будут образовываться продукты окисления, то они также будут вносить вклад в общее значение индуктивности, но ввиду того, что магнитная проницаемость стали Ст3 на 3–4 порядка превосходит магнитную проницаемость продуктов окисления [32], то их влиянием можно пренебречь.
Таким образом, задача сводится в нахождении экспериментальной зависимости m=f(U0). Была произведена та же серия испытаний, что и для гравиметрического метода, в нейтральной и кислой средах, без ингибитора и в его присутствии согласно ГОСТ 9.506-87 и ГОСТ 9.505-86.
Полученные данные зависимости напряжения от условий опытов представлены в таблице 6.4.
Таблица 6.4 – Экспериментальные данные
| № | Среда | Концентрация ингибитора, мг/дм3 | mнач, г | mкон, г | U нач, мВ | U кон, мВ | Скорость коррозии, г/м2·час |
| 1 | Нейтральная | --- | 30,0835 | 30,0693 | 600,0 | 598,8 | 0,836 |
| 2 | 30,1172 | 30,1030 | 602,7 | 601,5 | 0,839 | ||
| 3 | 30,1058 | 30,0916 | 601,7 | 600,6 | 0,836 | ||
| 1 | 200 | 30,0665 | 30,0662 | 598,6 | 598,6 | 0,02 | |
| 2 | 30,1166 | 30,1162 | 602,6 | 602,6 | 0,022 | ||
| 3 | 30,1267 | 30,1263 | 603,4 | 603,4 | 0,022 | ||
| 1 | 250 | 30,1688 | 30,1688 | 606,8 | 606,8 | 0 | |
| 2 | 30,1172 | 30,1172 | 602,7 | 602,7 | 0 | ||
| 3 | 30,1446 | 30,1446 | 604,8 | 604,8 | 0 | ||
| 1 | Кислая – соляная кислота 1,5 н | --- | 30,0905 | 29,3999 | 599,3 | 576,3 | 244,41 |
| 2 | 30,1165 | 29,4267 | 601,4 | 578,3 | 243,85 | ||
| 3 | 30,1039 | 29,4148 | 600,4 | 577,4 | 243,94 | ||
| 1 | 500 | 30,0680 | 29,9639 | 597,5 | 589,3 | 36,66 | |
| 2 | 30,1078 | 30,0043 | 600,7 | 592,5 | 36,58 | ||
| 3 | 30,1292 | 30,0261 | 602,4 | 594,2 | 36,59 | ||
| 1 | 2000 | 30,1712 | 30,1547 | 605,8 | 604,4 | 5,87 | |
| 2 | 30,1133 | 30,0968 | 601,1 | 599,8 | 5,85 | ||
| 3 | 30,1607 | 30,1443 | 604,9 | 603,6 | 5,85 |
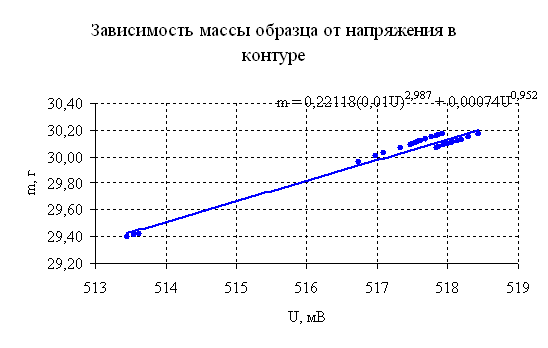
Рисунок 6.5 – Результаты эксперимента.
Из приведенного графика, очевидно, что вид зависимости между массой образца и напряжением контура, не зависит от параметров среды и хода протекания процесса. Вид данной кривой будет зависеть, только от параметров установки, температуры протекания процесса и материала из которого выполнен образец.
Рассчитанные значения масс образцов по предложенному уравнению, различаются от результатов взвешивания не более чем на пол процента.
Сопоставим результаты расчета скоростей коррозии данные представим в виде таблицы.
Таблица 6.5 – Сопоставление результатов расчета
| Среда | Концентрация ингибитора мг/дм3 | Скорость коррозии – гравиметрический метод г/м2·час | Скорость коррозии – индуктивный датчик | Ошибка % |
| Нейтральная | 0 | 0,8370 | 0,8375 | 0,179 |
| 200 | 0,022 | 0,0198 | 7,183 | |
| 250 | 0 | --- | --- | |
| Кислая | 0 | 243,3639 | 244,1024 | 0,303 |
| 500 | 36,5423 | 36,6478 | 0,288 | |
| 2000 | 5,8157 | 5,8268 | 0,192 |
Из приведенных данных видно, что предложенный датчик обеспечивает высокую сходимость результатов, при скорости коррозии не ниже 0,5 г/м2·час.
Похожие работы
... составов, застойные воды и некоторые органические продукты. Электрохимическая коррозия подчиняется законам электрохимической кинетики. Скорость ее можно определить на основе законов Фарадея. Электрохимическая коррозия встречается чаще всего и наиболее опасна для металлов. Она может протекать в газовой атмосфере, когда на поверхности металла возможна конденсация влаги (атмосферная коррозия), в ...
... и их содержимым. Способ изящен, и его применение, по-видимому, будет расширяться, как только будут преодолены сложности измерения и контроля. Покрытия, как метод защиты металлов от коррозии. Защита металлов, основанная на изменение их свойств, осуществляется или специальной обработкой их поверхности, или легированием. Обработка поверхности металла с целью уменьшения коррозии проводится одним ...
... Основным критерием, характеризующим состояние поверхности металла, является электродный потенциал. Обычно возможность применения анодной защиты для конкретного металла или сплава определяют методом снятия анодных поляризационных кривых. При этом получают следующие данные: а) потенциал коррозии металла в исследуемом растворе; б) протяженность области устойчивой пассивности; в) плотность тока в ...
... обратимых потенциалов кислородного электрода при различных рН среды и Р P (атм) V ,B, при рН среды рН=0 рН=7 рН=14 0,21 +1,218 +0,805 +0,381 1 +1,229 +0,815 +0,400 Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой ...


0 комментариев