Навигация
Положение алюминия в периодической системе и строение его атома
2.1.1 Положение алюминия в периодической системе и строение его атома
Алюминий находится в главной подгруппе III группы. Схема расположения по энергетическим уровням следующая:
+3Al 2e-, 8e-,3e-
Так как у атомов алюминия на внешнем уровне 3 электрона, то алюминий в соединениях проявляет степень окисления 4-3.
К такому же выводу приходим, руководствуясь представлениями о характере движения электронов в атомах и расположении их не только по энергетическим уровням, но и по подуровням. В атоме алюминия легко происходит распаривание 3s2-электронов и один электрон переходит 3p-орбиталь:

В результате получаются три неспаренных электрона. Ответьте на вопрос 1 (с. 138 [4]).
2.1.2 Нахождение алюминия в природе, его получение и свойства
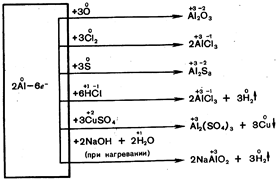
Алюминий — третий по распространенности элемент в земной коре. Он встречается только в соединениях. Важнейшие из них указаны на схеме 19.
Схема 19

Окрашенные кристаллы Al2O3 красного цвета — рубины, синего цвета – сапфиры.
Получение
Немецкий химик Ф. Вёлер в 1827 г. получил алюминий при нагревании хлорида-алюминия со щелочными металлами калием или натрием без доступа воздуха.
AlCl3 +3K ![]() 3KCl + Al
3KCl + Al
Для промышленного получения алюминия эти методы экономически невыгодны, поэтому был разработан электрохимический метод получения алюминия из бокситов.
Физические свойства
Алюминий — серебристо-белый металл, легкий (r = 2,7 г/cм3), плавится при 660 °С. Он очень пластичен, легко вытягивается в проволоку и прокаливается в листы и фольгу. По электрической проводимости алюминий уступает лишь серебру и меди (она составляет 2/3 от электрической проводимости меди).
Химические свойства
В электрохимическом ряду напряжения алюминий помещается за самыми активными металлами. Однако из повседневного опыта известно, что на алюминиевые изделия (посуду и т. д.) не действует ни кислород, ни вода даже при температуре ее кипения. На алюминий не действует также концентрированная холодная азотная кислота. Это объясняется наличием на поверхности алюминия тонкой оксидной пленки, которая предохраняет его от дальнейшего окисления. Если поверхность алюминия потереть солью ртути, то происходит реакция:
2А1 + 3HgCl2 ® 2А1С13 + 3Hg
Выделившаяся ртуть растворяет алюминий, и образуется его сплав с ртутью — амальгама алюминия. На амальгамированной поверхности пленка не удерживается, поэтому алюминий реагирует с водой при обычных условиях (рис. 46):
2А1 + 6НОН ® 2А1(ОН)3¯ + 3Н2
При повышенной температуре алюминий реагирует со многими неметаллами и сложными веществами без амальгамирования:
Применение
Алюминий применяют для производства различных сплавов. Наибольшее распространение имеют дюралюмины, содержащие медь и магний, и силумины — сплавы алюминия с кремнием. Основные преимущества этих сплавов—легкость и высокая прочность. Упомянутые сплавы широко используют в авиа-, авто-, судо- и приборостроении, в ракетной технике и в строительстве. В виде чистого металла алюминий идет на изготовление электрических проводов и различной химической аппаратуры.
Алюминий используют также для алитирования, т. е. насыщения поверхностей стальных и чугунных изделий алюминием с целью защиты их от коррозии.
На практике часто используют термит (смесь оксида Fе3O4 с порошком алюминия). Если эту смесь поджечь (с помощью магниевой ленты), то происходит бурная реакция с выделением большого количества теплоты:
8Al + 3Fe3O4 ® 4Al2O3 + 9Fe
Этот процесс используют при так называемой термитной сварке, а также для получения некоторых металлов в свободном виде.
Ответьте на вопросы 2—6 (с. 138). Решите задачи 1 – 2 (с. 138). [4]
2.1.3 Важнейшие соединения алюминия
Оксид алюминия
Аl2О3 можно получить следующими способами:
1. Непосредственным сжиганием порошка металлического алюминия (вдуванием порошка алюминия в пламя горелки):
4Al + 3O2 ® 2А12O3
2. Путем превращения по приведенной ниже схеме:
![]()
Оксид алюминия — твердое, тугоплавкое (темп. пл. 2050 °С) вещество белого цвета.
По химическим свойствам это амфотерный оксид (I, § 37). Реагирует с кислотами, проявляет свойства основных оксидов:
А12O3 + 6НС1 ![]() 2А1С13 + 3Н2O
2А1С13 + 3Н2O
Al2O3 + 6H+ +6С1-![]() 2Al3+ + 6С1- + 3Н2O
2Al3+ + 6С1- + 3Н2O
А12O3 + 6Н+![]() 2A13+ + 3Н2O
2A13+ + 3Н2O
Оксид алюминия реагирует со щелочами и проявляет свойства кислотных оксидов. Причем при сплавлении образуются соли метаалюминиевой кислоты НА1O2, т. е. мета-алюминаты:
Al2O3 + 2NaOH ![]() 2NaA102 + H20
2NaA102 + H20
В присутствии воды реакция протекает иначе:
А12О3 + 2NаОН + Н2O ® 2[NaA1O2 . H2O]
Это объясняется тем, что в водном растворе алюминат натрия NaA1O2 присоединяет одну или две молекулы воды, что можно изобразить так:
а) NaA1O2-Н2О, или NaH2A1O3; б) NaA1O2-2H2O, или NaAl(OH)4.
Гидроксид алюминия
Гидроксид алюминия А1(ОН)3 получают при взаимодействии раствора щелочи с растворами солей алюминия (раствор щелочи нельзя брать в избытке):
АlCl3 + NaOН ® Al(OH)3¯ + 3NaCl
A13+ + 3Cl- + 3Na+ + 3OH- ® Al(OH)3¯ + 3Na+ + 3С1-
Аl3+ + 3ОН- ® А1(ОН)3¯
Если белую желеобразную массу гидроксида алюминия выделить из раствора и высушить, то получается белое кристаллическое вещество, практически не растворяющееся в воде.
Гидроксид алюминия (как и его оксид) обладает амфотерными свойствами. Подобно всем основаниям гидроксид алюминия реагирует с кислотами. При сплавлении гидроксида алюминия со щелочами образуются метаалюминаты, а в водных растворах — гидраты метаалюминатов:
А1(OH)3 + NaOH ![]() NaА1O2 + 2Н2O
NaА1O2 + 2Н2O
А1(OH)3 + NaOH ® NaH2А1O3 + Н2O
Соли алюминия получают в основном при взаимодействии металлического алюминия с кислотами. По физическим свойствам это твердые кристаллические вещества, хорошо растворимые в воде. Химические свойства солей алюминия аналогичны свойствам других солей ([3], с. 98—99). Так как соли алюминия образованы слабым основанием и сильной кислотой, то они в водных растворах подвергаются гидролизу (с. 18).
Ответьте на вопросы 7—10 (с. 138). Решите задачу 3 (с. 138 [4]).
Генетическая связь между алюминием и его важнейшими соединениями (схема 20).
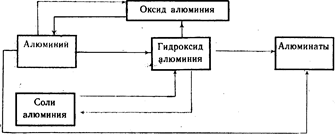
Выполните упражнение 11.
Далее в учебнике по этой теме приводятся задачи на закрепление материала. Также в учебнике приводится лабораторный эксперимент (с. 139) [4].
Таким образом, из вышеизложенного материала можно сделать вывод, что в школьной программе на изучение данной темы отводится очень мало часов, и, кроме этого, практически нет сведений об экологических аспектах этой темы.
Азот образует ряд оксидов, формально отвечающих всем возможным степеням окисления от +1 до +5: N2O, NО, N2O3, NO2, N2O5, однако всего два из них – оксид азота(II) и оксид азота(IV) – не только устойчивы при обычных условиях, но и активно задействованы в природном и промышленном круговоротах азота.
2.2.1 Некоторые соединения азота и их свойства 1.2.1.1. Оксиды азота
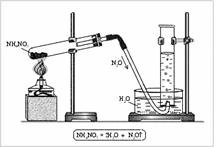
N2+1O – оксид азота(I), закись азота, «веселящий» газ, несолеобразующий оксид. Получают N2O разложением аммиачной селитры:
![]()
N2O имеет слабый приятный запах и сладковатый вкус. С кислородом, водой, растворами кислот и щелочей не реагирует. Разлагается на элементы при температуре выше 500 °С, иными словами, достаточно устойчив.
Строение: у кислорода 2 неспаренных электрона, у азота 3 – образуется двойная связь и один неспаренный электрон в остатке. Можно предположить, что молекулы NO будут спариваться и образовывать димерную молекулу ONNO. Строение молекулы: линейная молекула О=N=N, в которой центральный атом N четырехвалентен. Он образует две двойные связи: одну – с кислородом по типичной схеме создания ковалентной связи (два электрона азота, два электрона кислорода), другую – с атомом азота (который два из своих трех неспаренных электронов спаривает и образует за счет этого пустую орбиталь), одна из связей ковалентная, вторая донорно-акцепторная (рис. 1).
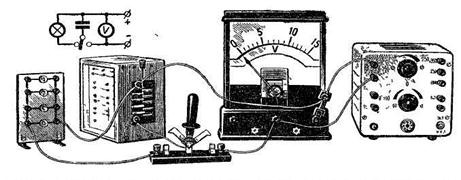
Установка для получения оксида азота(I) состоит из штативов, пробирки, пробки с газоотводной трубкой, кристаллизатора, цилиндра и спиртовки (рис. 2). В пробирку помещают NH4NO3, закрывают пробкой с газоотводной трубкой и нагревают. Газ собирают в цилиндр, наполненный водой.
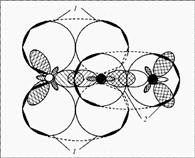
Рис. 1. Молекула оксида азота(I) – N2O
|
|
| Рис. 2. Получение оксида азота(I) в лаборатории |
Оксид N2O разлагается при нагревании:
![]()
Оксид N2O реагирует с водородом:
![]()
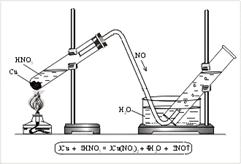
N+2O – оксид азота(II), несолеобразующий оксид. Получают NO реакцией меди с кислотой HNO3 (разб.) (рис. 3).
Кристаллическая решетка молекулярная; молекула легкая, слабополярная (электроотрицательность кислорода немного выше, чем у азота). Можно предположить, что температуры плавления и кипения будут низкими, но выше, чем у азота, т. к. полярность молекулы дает возможность подключать электростатические силы притяжения к просто межмолекулярным силам. Образование димера тоже способствует повышению температуры кипения. Строение молекулы позволяет предположить и невысокую растворимость в воде. Оксид азота(II) не имеет ни цвета, ни запаха.
|
|
| Рис. 3. Получение оксида азота(II) в лаборатории |
Для получения оксида азота(II) в пробирку помещают немного медных стружек и заливают разбавленную азотную кислоту. Пробирку закрывают пробкой с газоотводной трубкой и укрепляют в штативе. Конец газоотводной трубки опускают в кристаллизатор с водой и далее в цилиндр (рис. 3). При нагревании выделяется NO. NO легко окисляется кислородом воздуха, т. е. действует как восстановитель:
![]()
В реакции с сернистым газом оксид NO – окислитель:
![]()
N+22O3 – оксид азота(III), азотистый ангидрид (ему соответствуют азотистая кислота HNО2 и соли нитриты); это кислотный оксид, для него характерны все свойства кислотных оксидов. Получают оксид N2O3 по реакции:
NO2 + NO ![]() N2O3.
N2O3.
N+4O2– оксид азота(IV), диоксид азота, бурый газ (токсичен).
Рассмотрим электроны азота в молекуле NО. Это неспаренный электрон, свободная пара электронов и еще два электрона на связи с кислородом – всего пять. А у атома кислорода, «выходящего на связь», шесть электронов на четырех орбиталях. Если расположить их по два, то одна орбиталь останется свободной. Именно ее и занимает пара электронов атома азота (рис. 4, 5).

Рис. 4. Схема электронного строения молекулы NO2 (первый вариант). (Точками обозначены электроны атомов О, крестиками – электроны атома N)
Рис. 5. Схема электронного строения молекулы NO2 (второй вариант). (Звездочкой обозначен возбужденный атом O, стрелкой – донорно-акцепторная связь.
Раз пара электронов, находящаяся на s-орбитали, «пошла на связь», она просто обязана подвергнуться гибридизации. Возникает вопрос: какой тип гибридизации использует атом? Ответ: три электронные орбитали азота находятся в состоянии sp2-гибридизации. Молекула NO2 угловая, угол 134° (угол больше 120° потому, что 1 электрон отталкивает от себя электроны связи слабее, чем пара электронов) (рис. 6, 7).
Кристаллическая решетка молекулярная, однако, поскольку сама молекула тяжелее NO и склонность к димеризации у нее заметно выше, то плавиться и кипеть это вещество должно при заметно более высоких температурах. Температура кипения составляет 21 °С, поэтому при обычных условиях – 20 °С и 760 мм рт. ст. – оксид азота(IV) жидкий.
Оксид азота (IV) в воде растворяется, одновременно с ней реагируя, и получается при этом сразу две кислоты.
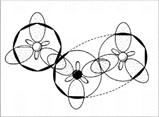
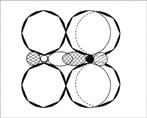
Рис. 6. Молекула NO2 — вид «сверху»
Рис. 7. Молекула NO2 – вид «сбоку», со стороны донорно-акцепторной связи. (Второй атом кислорода не виден за орбиталями атома азота. Заштрихованные кружки – это гибридизованные орбитали атомов, направленные к читателю.)
Оксид азота(IV) имеет и характерный резкий запах, и рыжевато-бурый цвет, оттенки которого отличаются друг от друга в зависимости от концентрации. Именно за этот цвет выбросы оксидов азота в атмосферу называют «лисьими хвостами» [4].
Реакции оксида NO2
1) С водой:
2NO2 + Н2O = НNO3 + НNO2.
2) С щелочами:
2NO2 + 2NaOH = NаNО3 + NаNО2 + Н2O.
3) Димеризация при охлаждении:
![]()
При температуре –11 °С равновесие полностью смещено вправо, а при +140 °С – целиком влево.
N+52O5 – оксид азота(V), азотный ангидрид, кислотный оксид, сильный окислитель. Оксид N2O5 легко разлагается:
2N2O5 = 4NO2 + O2.
2.2.1.2 Азотная кислотаИз гидроксидов азота мы рассмотрим наиболее многотоннажный – азотную кислоту.
Молекула азотной кислоты полярна (из-за разной электроотрицательности кислорода и водорода, потому что азот как бы скрыт внутри молекулы) и асимметрична. Все три имеющихся в ней угла между связями азота с кислородом разные. Формальная степень окисления азота высшая (+5). Но при этом только 4 связи у атома азота с другими атомами – валентность азота равна 4.
Строение молекулы легче понять, если рассмотреть процесс ее получения. Азотная кислота получается при реакции оксида азота(IV) с водой (в присутствии кислорода): две молекулы NO2 одновременно «атакуют» молекулу воды своими неспаренными электронами, в результате связь водорода с кислородом разрывается не как обычно (пара электронов у кислорода и «голый протон»), а одной молекуле NO2 достается водород со своим электроном, другой – радикал ОН (рис. 8). Образуются две кислоты: обе кислоты сильные, обе быстро отдают свой протон ближайшим молекулам воды и остаются в итоге в виде ионов NO2- и NO3-. Ион NO2- нестоек, две молекулы НNО2 разлагаются на воду, NО2 и NО. Оксид NO реагирует с кислородом, превращаясь в NО2, и так до тех пор, пока не получится одна только азотная кислота.
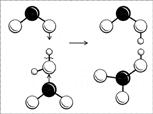
Рис. 8. Схема образования молекул азотной и азотистой кислот. (Черный шар – атом N, большие белые шары – атомы O, маленькие белые шарики – атомы H.)
Формально выходит, что с одним атомом кислорода атом азота связан двойной связью, а с другим – обычной одинарной связью (этот атом кислорода связан еще и с атомом водорода). С третьим атомом кислорода азот в HNO3 связан донорно-акцепторной связью, причем в качестве донора выступает атом азота. Гибридизация атома азота при этом должна быть sр2 из-за наличия двойной связи, что определяет структуру – плоский треугольник. Реально получается, что действительно фрагмент из атома азота и трех атомов кислорода – плоский треугольник, только в молекуле азотной кислоты этот треугольник неправильный – все три угла ОNО разные, следовательно, и разные стороны треугольника. Когда же молекула диссоциирует, треугольник становится правильным, равносторонним. Значит, и атомы кислорода в нем становятся равноценными. Одинаковыми становятся и все связи.
Физические свойства азотной кислоты
Соединение ионизированное, пусть даже и частично, сложно перевести в газ. Таким образом, температура кипения должна бы быть достаточно высокой, однако при такой небольшой молекулярной массе температура плавления высокой быть не должна. Следовательно, агрегатное состояние при 20°С жидкое. Что касается растворимости, то, как и многие другие полярные жидкости, азотная кислота легко смешивается с водой в любых соотношениях. Чистая азотная кислота бесцветна и не имеет запаха. Однако из-за разложения на кислород и оксид азота(IV), который в ней же и растворяется, можно сказать, что обычная концентрированная азотная кислота имеет желто-бурый цвет и характерный для NO2 резкий запах. Посмотрим, как влияет строение молекулы азотной кислоты на ее химические свойства.
НNО3 – cильный окислитель
При взаимодействии НNО3 с металлами (М) водород не выделяется:
М + НNО3 ® соль + вода + газ.
Смесь HNO3 (конц.) с HCl (конц.) в объемном соотношении 1:3 (1V HNO3 + 3V HCl) называют «царской водкой».
Au + HNO3 + 3HCl = AuCl3 + NO![]() + 2H2O.
+ 2H2O.
Азотная кислота не реагирует с другими кислотами по типу реакций обмена или соединения. Однако вполне способна реагировать как сильный окислитель. В смеси концентрированных азотной и соляной кислот протекают обратимые реакции, суть которых можно обобщить уравнением:
![]()

Образующийся атомарный хлор очень активен и легко отбирает электроны у атомов металлов, а хлорид-ион образует устойчивые комплексные ионы с получающимися ионами металлов. Все это позволяет перевести в раствор даже золото. Концентрированная H2SO4 как сильное водоотнимающее средство способствует реакции разложения азотной кислоты на оксид азота(IV) и кислород. Азотная кислота – одна из сильных неорганических кислот и, естественно, со щелочами реагирует. Реагирует она также и с нерастворимыми гидроксидами, и с основными оксидами [4].
При изучении темы «Азот. Соединения азота» пользуются учебником химии под редакцией Г.Е. Рудзитис, Ф.Г. Фельдман, также учебником за 9 класс под редакцией Н.С. Ахметова. Дидактическим материалом служит книга по химии для 8-9 классов под редакцией А. М. Радецкого, В. П. Горшкова; используются задания для самостоятельной роботы по химии за 9 класс под редакцией Р.П. Суровцева, С.В. Софронова; используется сборник задач по химии для средней школы и для поступающих в вузы под редакцией Г.П. Хомченко, И.Г. Хомченко. На изучение этой темы отводится 7 ч [4, 5].
ГЛАВА 3. МЕЖПРЕДМЕТНЫЕ СВЯЗИ ПРИ ИЗУЧЕНИИ III И V ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д.И.МЕНДЕЛЕЕВА 3.1 III-А группа
3.1.1 Бор 3.1.1.1 Распространение в природе
Бор никогда не встречается в природе в свободном состоянии, он всегда оказывается связанным с кислородом. В этой форме он присутствует в борной кислоте Н3BO3, которая содержится в воде горячих источников вулканических местностей. Кроме того, в природе распространены многочисленные соли борной кислоты. Из этих солей наиболее известна бура или тинкал Na2B4О7. 10Н2О. Техническое значение имеют борацит 2Mg3B8O15. MgCl2, пандермит Са2B6О11. 3Н2О, колеманит Са2B6О11. 5Н2О, кернит Na2B4О7. 4Н2О.
Необходимо указать и следующие минералы, которые являются производными борной кислоты: борокальцит СаB4О7. 4Н2О, борнонатрокальцит NaСаB5О9. 6Н2О, гидроборацит MgCaB6О11. 6Н2О, боромагнезит 2Mg5B4О11. 5Н2О, сингалит MgAlBО4 и др. [9-11].
3.1.1.2 Биохимическая рольБор и его соединения имеют большое значение в народном хозяйстве. Изотоп 510B, поглощающий нейтроны, применяют в ядерной технике для замедления ядерных цепных реакций. Бура и борная кислота издавна применяется в медицине как антисептики.
Физиологическая и биологическая активность бора очень высока. Бор способен влиять на важнейшие процессы биохимии животных и растений. Вместе с Mn, Cu, Zn и Мо бор входит в число пяти жизненно важных микроэлементов. Бор концентрируется в костях и зубах, в мышцах, в костном мозгу, печени и щитовидной железе. Вероятно, что он ускоряет рост и развитие организмов. Это видно из влияния бора на растения. При борном голодании значительно уменьшается урожай и особенно количество семян. Для жизнедеятельности животных важно его нахождение в молоке (коровьем) и в желтке куриных яиц. Некоторые растения (кормовые травы и сахарная свекла) собирают по несколько граммов бора с гектара угодий. Бор содержится в значительных количествах в жировых тканях некоторых животных, пасущихся на пастбищах, обогащенных бором. Состав соединений бора в организме неизвестен. Установлено, что бор тормозит кишечную амилазу и кишечные протеиназы, усиливает действие инсулина и тормозит окисление адреналина, ослабляет витамины В2 и В12. При избытке бора появляются борные энтериты. Избыточное содержание бора ведет к заболеванию растений. Пшеница и овес страдают при наличии 0,7 - 0,8 мгВ/кг почвы. Борьба с засолением почв бором ведется с помощью промывки борных почв [9-11].
Похожие работы
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... виды связей, тогда как синхронные резко ограничены, а во внутрипредметных связях синхронный вид вообще отсутствует. 2. Планирование и осуществление межпредметных связей в процессе обучения. Разработка теоретических основ межпредметных связей в учебной теме сточки зрения раскрытия ее ведущих положений дает возможность применить механизм выявления и планирования межпредметных связей к ...
... и дидактические основы организации обучения позволяют более доступно объяснять изучаемый материал на уроках физики при изучении темы «Основы электродинамики». Анализ различных технологий позволил составить авторскую технологию развития у учащихся направленности на диалогическое общение при групповой форме обучения. От того, на сколько правильно будет построен процесс обучения при использовании ...
... с этим возникает необходимость рассмотрения вопроса взаимосвязи молекулярной физики и химии в курсе средней школы. При изучении молекулярной физики взаимосвязь ее с химией проявляется в двух главных направлениях. Первое из них заключаются в использовании знаний учащихся, полученных ими в процессе изучения химии в качестве материала для доказательства основных положений молекулярной физики. Второе ...
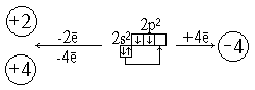

0 комментариев