Навигация
148 г104 г
2-х 1,23-у
CaC![]() → CaO + C
→ CaO + C![]() (II)
(II)
100 г 56 г
Искомую величину- массу карбоната стронция в смеси обозначим через х: m (SrC![]() = x. Тогда масса карбоната кальция будет равна m (CaC
= x. Тогда масса карбоната кальция будет равна m (CaC![]() ) = 2-x, а масса выделившегося оксида углерода (IV) составит m (C
) = 2-x, а масса выделившегося оксида углерода (IV) составит m (C![]() ) = (2-1,23) г = 0,77 г.
) = (2-1,23) г = 0,77 г.
Составим уравнение, учитывая, что масса углерода в исходной смеси карбонатов металлов равна массе углерода в выделившемся оксиде углерода (IV):
m ( CaC![]() )
)![]()
Подставляя числовые значения, получим:
(2-х)![]() откуда х=0,75 .
откуда х=0,75 .
Ответ: масса карбоната стронция равна 0,75 г .
Задача № 6 . Рассчитать массовые доли компонентов смеси , состоящей из гидрата карбоната аммония , карбоната калия и гидрофосфата аммония, если известно , что из 38,4 г этой смеси получили 8,8 г углекислого газа и 6,8 г аммиака.
Решение:
М ( ![]() ) = 114 г/моль
) = 114 г/моль
М (![]() ) = 138 г/моль
) = 138 г/моль
М (![]() ) = 132 г/моль
) = 132 г/моль
Пусть в смеси х моль ![]() , у моль
, у моль ![]() и z моль
и z моль ![]() , тогда
, тогда
114х + 138у + 132z = 38,4
Из х моль гидрата карбоната аммония можно получить 2х моль аммиака и
х моль углекислого газа:
х2х х
![]() → 2
→ 2![]()
![]()
Аналогично,
у у z 2z
![]() →
→ ![]()
![]() → 2
→ 2![]()
n (![]() ) = 8,8/44 = 0,2 моль х + у = 0,2
) = 8,8/44 = 0,2 моль х + у = 0,2
n (![]() ) = 6,8/ 17= 0,4 моль 2х+2z =0,4
) = 6,8/ 17= 0,4 моль 2х+2z =0,4
Решая систему уравнений
114х + 138у + 132z = 38,4
х + у = 0,2
2х+2z =0,4
находим х = у = z = 0,1 моль
w (![]() ) =
) =![]()
w (![]() ) =
) = ![]()
w ((NH4)HPO4 = ![]()
Ответ: w (![]() ) = 29,7 % , w(
) = 29,7 % , w(![]() ) = 35,9 % ,
) = 35,9 % ,
w (![]() ) = 34,4 %.
) = 34,4 %.
2) Задачи на газовые законы. Определение количественных отношений в газах.
Расчёты масс, количеств веществ и объёмов газов обычно проводят с помощью алгебраических уравнений, как правило, на основе закона Авогадро. Рассмотрим некоторые особенности составления таких уравнений.
Иногда в задачах требуется произвести вычисления с газами, при смешении которых не происходит химического взаимодействия, а образуется смесь исходных газов. В таких случаях при составлении алгебраических уравнений учитывают, что масса газовой смеси равна сумме масс газов смеси. В уравнении массу каждого газа, а также смеси представляют как произведение количества вещества газа на его молярную массу: m = n* M. В отдельных задачах при составлении уравнений принимают во внимание , что количество вещества в газовой смеси равно сумме количеств веществ газов, которые были смешаны.
Если в условии задачи задана относительная плотность D некоторого газа, имеющего молярную массу М ( х ), по другому газу, имеющего молярную массу М ( а ), то можно использовать существующую зависимость между этими величинами: D = М ( х ) / М ( а ) – выражать молярную массу газа М ( х ) в виде произведения ![]() .
.
Во многих задачах рассматриваются газы, которые при смешении реагируют между собой, образуя газообразные продукты реакции. В таких случаях при составлении алгебраических уравнений учитывают, что объёмы участвующих в реакции газов относятся как коэффициенты перед формулами соединений в уравнении химической реакции. Причём объёмы газов должны быть взяты при одинаковой температуре и давлении. В алгебраических уравнениях отношение объёмов реагирующих газов иногда удобно заменять отношением количеств веществ газов.
В процессе решения задач, касающихся газов, иногда полезно использовать информацию, которую можно представить в виде неравенств. Последние иногда непосредственно следуют из условия задачи. Однако в ряде случаев их можно составлять на основе известных свойств газов. Например, для любого газа относительная плотность по водороду больше единицы: DH > 1; средняя молярная масса газа, состоящего из молекул различных соединений, находится в пределах значений молярных масс этих соединений: ![]() и т. п.
и т. п.
Иногда в условиях задач объём газа даётся не при нормальных, а при каких-то других условиях. В этом случае, как обычно говорят, нужно привести объём к нормальным условиям. Для этого проще всего воспользоваться объединённым газовым законом, который математически выражается так:
![]() .
.
Где V0 – объём газа при н.у., т.е. при нормальной температуре T0 = 273 K и при нормальном давлении P0 =101325 Па; V- объём газа при данной температуре T и данном давлении P.
Значение молярной массы газа, а также число молей газа можно найти при использовании уравнения Клапейрона - Менделеева:
PV= ![]()
Где P - давление газа , V- объём системы , m – масса газа, Т- абсолютная температура, R- универсальная газовая постоянная: R= 8,31 Дж / (![]() ).
).
При расчётах газовых реакций нет необходимости определять число молей веществ, а достаточно пользоваться их объёмами. Из закона Авогадро и основного закона стехиометрии вытекает следующее следствие отношение объёмов газов, вступающих в реакцию, равно отношению коэффициентов в уравнении реакции. Это утверждение называется законом объёмных отношении Гей-Люссака.
Задача № 1 . Какой объём (н.у.) озонированного кислорода с молярной долей озона 24 % требуется для сжигания 11,2 л водорода.
Решение: Реакциям горения водорода отвечают уравнения:
2![]() +
+ ![]() = 2
= 2![]()
3 ![]() +
+ ![]() = 3
= 3 ![]()
Искомая величина V (смеси) – объём озонированного кислорода, необходимый для сжигания 11,2 л водорода. Составим уравнения, учитывая, что количество вещества водорода равно сумме удвоенного количества кислорода и утроенного количества вещества озона.
n (![]() ) = 2n (
) = 2n (![]() )+ 3n (
)+ 3n (![]() ),
),
![]() ,
,
![]()
Откуда V (смеси) =5 л.
Ответ: 5 л озонированного кислорода.
Задача № 2 . К 30 л смеси, состоящей из этана и аммиака добавили 10 л хлороводорода, после чего плотность паров газовой смеси по воздуху стало равной 0,945. Вычислить объёмные доли газов в исходной смеси.
Решение:
При добавлении хлороводорода происходит реакция
![]() + HCl →
+ HCl → ![]()
с образованием твёрдого ![]() .
.
Конечная газовая смесь имеет среднюю молярную массу
Мср = ![]() = 27,4 г/ моль
= 27,4 г/ моль
и состоит из этана (М= 30 г/ моль) и аммиака (М= 17 г/ моль). Это означает, что аммиак в реакции - в избытке. Если бы в избытке был хлороводород, то в конечной смеси вместо аммиака был хлороводород , и средняя молярная масса была бы больше 30 г/ моль.
Пусть в исходной смеси было х л аммиака и у л этана, тогда в конечной смеси содержатся
( х- 10) л аммиака и у л этана. Значения объёма исходной смеси и молярной массы конечной смеси дают систему двух уравнений для х и у :
х + у = 30
![]()
откуда следует х=14 л , у=16 л .
φ (![]() ) = 14/30 = 0,47, φ (
) = 14/30 = 0,47, φ (![]() ) = 16/30 = 0,53.
) = 16/30 = 0,53.
Ответ: 47 % ![]() , 53 %
, 53 % ![]() .
.
Задача № 3 . Смесь паров пропина и изомерных монохлоралкенов при ![]() и давлении 96,5 кПа занимает объём 18 л и при сжигании в избытке кислорода образует 18 г воды. Вывести формулы монохлоралкенов. Вычислить объём 1,7 % раствора нитрата серебра (плотность 1,01 г/мл), который может прореагировать с продуктами сжигания исходной смеси, если известно, что её плотность по воздуху 1,757.
и давлении 96,5 кПа занимает объём 18 л и при сжигании в избытке кислорода образует 18 г воды. Вывести формулы монохлоралкенов. Вычислить объём 1,7 % раствора нитрата серебра (плотность 1,01 г/мл), который может прореагировать с продуктами сжигания исходной смеси, если известно, что её плотность по воздуху 1,757.
Решение: Общая формула монохлоралкенов - ![]() .
.
Сгорание компонентов смеси происходит по уравнениям:
х 2х
![]()
у (n -1)y
![]() + (1.5 n-0.5)
+ (1.5 n-0.5)![]() .
.
Пусть в смеси было х моль ![]() (М = 40) моль, y моль
(М = 40) моль, y моль ![]() (М = 14n+34).
(М = 14n+34).
Общее количество веществa в газовой смеси: n = PV/RT = 96.5![]() моль. Средняя молярная масса смеси равна М=29
моль. Средняя молярная масса смеси равна М=29 ![]() = 50.95 г/моль.
= 50.95 г/моль.
Отсюда масса 0.5 моль смеси составляет m = 50.95![]() [11, 12].
[11, 12].
ЛИТЕРАТУРА
1. Абкии Г. П. Методика решения задач по химии. — М.: Просвещение, 1971.
2. Аркавепко Л. Н., Гапонцев В. Л., Велоусова О. А. Для чего классифицировать расчетные задачи // Химия в школе, 1995, № 3. С. 60.
3. Архангельская О. В. Решение задач. Чем проще, тем изящнее // Химия в школе, 1998. С. 46.
4. Беляев Н. Н. О системном подходе к решению задач // Химия в школе, 1998, № 5. С. 46.
5. Буцкая Н. Н. К решению задач по химическим уравнениям // Химия в школе, № 5. С. 49.
6. Емельянова Е. О. Подготовка учащихся к решению расчетных задач // Химия в школе, № 3. С. 53.
7. Крыгин Д. П., Грабовый А. К. Задачи и примеры по химии с межпредметным содержанием. — М.: Высшая школа, 1989.
8. Ерыгин Д. П., Шишкин Е. А. Методика решения задач по химии. — М.: Просвещение, 1989.
9. Медведев Ю. Н. и др. Учимся решать сложные задачи // Химия в школе, 1977, № 4. С. 53.
10. Протасов П. Н., Цитович И. К. Методика решения расчетных задач по химии. — М.: Просвещение, 1978.
11. Савицкий С. Н., Твердовский Н. П. Сборник задач и упражнений по неорганической химии. — М.: Высшая школа, 1981.
12. Шамова М. О. К решению задач на определение формул веществ // Химия в школе, 1997, № 4. С. 50;
13. Учимся решать расчетные задачи по химии: технология и алгоритмы решений. — М.: Школа-Пресс, 1999.
Похожие работы
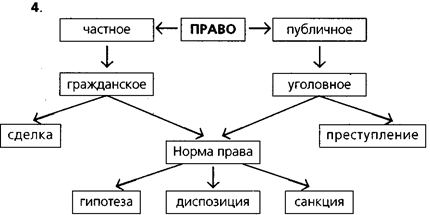
... текста, его изложение в соответствии с выработанным планом, нумерация страниц. Оформление цитат и ссылок, библиографии, титульного листа и т.п.); — сопроводительные материалы (иллюстрации, схемы, таблицы и т. п.). В методике обучения праву выделяют разные формы контроля самостоятельной работы учеников. К ним относят и защиту рефератов. Модели защиты реферата 1. «Классическая защита». Устное ...
... пособие по прикладной химии «Задачи по теоретическим основам химической технологии», составленное по материалам представленной работы. 3. Методика решения задач по теоретическим основам химической технологии Одна из главных задач химической науки и промышленности - получение необходимых человеку веществ (продуктов, материалов). Поэтому большинство учебных химических задач снизано с ...
... Просвещение, 1976. 35. Третьяков Ю.Д., Зайцев О.С. Программное пособие по общей и неорганической химии. М.: Юнити, 2005. 36. Фаязов Д.Ф. Формирование умений учащихся пользоваться химическим языком // Химия в школе. 1983. № 2. 37. Фигуровский Н.А. Открытие элементов и происхождение их названий. М.: Наука, 1970. 38. Цветков Л.А. Преподавание органической химии в средней ...
... знает данное производство, то лучше ему самому поводить экскурсию, используя помощь инженерно - технических работников, сопровождающих экскурсию. Экскурсия как особая форма организации учебного процесса требует специальной и довольно основательной предварительной подготовке учащихся. От этого зависит весь ее результат. Опытный учитель на протяжении целого ряда уроков фиксирует внимание учащихся ...



0 комментариев