Навигация
РАСЧЕТНЫЕ ЗАДАЧИ ПО ХИМИИ
3. РАСЧЕТНЫЕ ЗАДАЧИ ПО ХИМИИ
При обучении учащихся решению расчетных химических задач следует помнить, что решение задач — это не самоцель, это средство, способствующее более глубокому пониманию и усвоению химических понятий и в первую очередь количественных.
Обычно у учащихся при решении расчетных химических задач возникают затруднения особого порядка, связанные именно со спецификой химической науки.
Прежде всего они вызваны тем, что химические расчеты требуют использования особой физической величины, называемой «количество вещества» и ее единицы — моля. При этом важно учесть, что для понимания этой величины очень мало опорных понятий, что не способствует реализации принципа доступности. Эти абстрактные понятия труднодоступны для учащихся, так как они не имеют аналогии в других, предшествующих химии предметах.
Кроме того, для непосредственного измерения определенного количества вещества нет соответствующих приборов. Можно измерить массу, объем, но не количество вещества в молях. Оно определяется опосредованно, расчетом. Поэтому учащимся VIII класса, у которых абстрактное мышление еще недостаточно хорошо развито, следует облегчить усвоение этого материала, по возможности привлекая наглядность, хотя и это очень трудно, потому что требует развитого воображения. Понятие «количества вещества» полезно объяснять, исходя из числа структурных частиц N, а «моль» — из числа Авогадро. Это переводит объяснение в конкретную плоскость.
Вторая причина трудностей в том, что в химии при расчетах приходится оперировать двумя рядами формул — химическими и математическими. Все эти трудности необходимо преодолеть, показывая учащимся, что все без исключения химические расчеты основаны на использовании моля как единицы количества вещества. Ученики должны это твердо осознать. Конечно, легче объяснить расчет через составление пропорции в граммах или объемах. Эти величины давно знакомы учащимся так же, как и пропорции. Но если учитель пойдет по этому пути, он рискует в дальнейшем никогда не научить учащихся мыслить количественными химическими понятиями. Они не смогут объяснить причины, по которым можно составлять такие пропорции и будут считать использование понятия «моль» совершенно лишним и ненужным.
Подбирать задачи нужно так, чтобы возникала необходимость использовать эту единицу. И лишь тогда, когда в сознании учащихся утвердится, что количественные отношения веществ всегда выражаются в молях, можно учить переходным формулам, показать взаимосвязь массы и количества вещества, объема и количества вещества (см. схему 1.).
Схема 1
Схема взаимосвязи физических величин
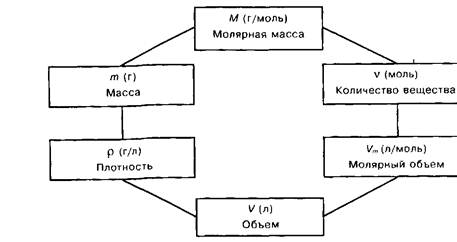
Еще одна трудность заключается в том, что иногда название величин вступает в противоречие с прежними, прочно утвердившимися понятиями учащихся. Например, величину «молярная масса» учащиеся воспринимают как массу, но размерность ее не грамм (как должно быть у массы), а «г/моль» (отношение массы к количеству вещества). Та же ситуация и с молярным объемом.
Очень важно правильно объяснить, что такое молярная масса М и что такое молярный объем Vm, показать их размерность и объяснить, как с их помощью осуществляется переход от массы и объема к количеству вещества и обратно. Нужно рассказать о постоянной Авогадро Л/а- Учащиеся должны всеми формулами пользоваться сознательно. Общие формулы всегда абстрактны, выражают обобщенные подходы к решению, а в каждой задаче они конкретизируются. Полезно довести до сведения учащихся схему, отражающую систему количественных понятий, связи между ними и переходные формулы, выражающие связи между этими понятиями.
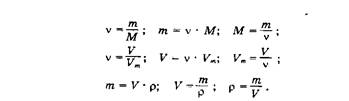
Для самоконтроля и для лучшего запоминания учителя иногда на первом этапе вывешивают настенную таблицу со схемой и формулами. Другие считают, что лучше, чтобы учащиеся всякий раз сами выводили эти формулы, но очевидно одно — учащиеся должны усваивать величины, «работающие» в формуле, сознательно.
Решение расчетных задач по химии очень тесно связано с физикой и математикой. Эти межпредметные связи надо постоянно иметь в виду.
В курсе физики величина «количество вещества» изучается значительно позднее, чем в химии. Поэтому важно правильно сформировать понятие о ней, чтобы в дальнейшем у учащихся не возникало противоречий.
Методику решения задач также полезно связать с физикой, сохраняя форму записи условия и решения. Этого требует и соблюдаемый в школе единый орфографический режим. Кроме того, гораздо более рационален физико-математический путь решения, когда все расчеты производят сначала в буквенных выражениях и лишь после этого подставляют числовые значения. Проиллюстрируем форму записи, например, на задаче:1
 |
«В лаборатории чистое железо можно получить по реакции его оксида FeO с водородом при повышенной температуре. Составьте уравнение реакции (один из ее продуктов — вода) и рассчитайте необходимые количества оксида и водорода для получения 1 г железа».
Ответ: Для получения 1 г железа требуется 0,18 моль водорода и 0,18 моль оксида железа.
Набор расчетных задач в школьном курсе химии невелик. Различают обычно расчеты по формулам и расчеты по уравнениям реакций. Особо выделяют задачи, связанные с растворами.
В некоторых программах оговорено, в каких темах какие типы задач следует вводить, в других право выбора предоставляется учителю. Поэтому приведем только перечень типов задач, решение которых учащиеся осваивают в школе.
А. Расчеты по формулам:
—Вычисление относительной молекулярной массы вещества.
—Вычисление отношения масс атомов элементов в сложном веществе.
—Вычисление массовой доли элемента в веществе (в %).
—Вычисление массы определенного количества вещества.
—Вычисление масс и объемов газов (при н. у.).
— Вычисление относительной плотности газов. Б. Расчеты по уравнениям
—Вычисление масс веществ или объемов газов по известному количеству вещества одного из вступающих в реакцию или образующихся в результате ее веществ.
—Вычисление объемных отношений газов по химическим уравнениям.
—Расчет по термохимическим уравнениям количества теплоты по известному количеству и массе одного из участвующих в реакции веществ.
—Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке.
—Определение массовой доли выхода продукта от теоретически возможного.
—Вычисление массы продукта реакции по известной массе исходного вещества, содержащего определенную массовую долю примесей.
В. Расчеты на выведение формул веществ
Нахождение молекулярной формулы газообразного вещества на основании его плотности и массовых долей входящих в него элементов (в %).
Г. Расчеты массовой доли вещества в растворе (в %)
Расчеты по определению массовой доли растворенного вещества (в %) в растворе и массы растворенного вещества по известной массовой доле его в растворе.
Обучение учащихся решению расчетных химических задач следует начинать постепенно. Сначала научить подсчитывать относительную молекулярную массу Мг, постепенно переходить к молярной массе М (г/моль), затем к решению задач по химической формуле веществ и затем к расчетам по химическим уравнениям. При этом вначале расчеты не следует усложнять. Начинают их производить обязательно в молях, подбирая условия так, чтобы не требовалось перевода в граммы или литры. Впоследствии такой перевод будет казаться вполне естественным. Конечно, содержание задач обязательно должно быть согласовано с изучаемой темой. Нельзя, например, требовать расчета объема газа, если еще неизвестен закон Авогадро и молярный объем.
И только после всего этого допустимы всевозможные усложнения задач и их комбинирование, широко используемые для составления олимпиадных и конкурсных задач.
Нередко при решении задач приходится видеть скучающие глаза учеников, которые считают, что химические расчеты вовсе не нужны. Тогда учитель привлекает для обоснования их необходимости по возможности жизненные примеры. Можно задать на дом выполнение какого-нибудь домашнего опыта, связав его с расчетом.
О едином методическом подходе к решению задач по химии
В решении задач должен соблюдаться единый методический подход. Ведущая роль в обучении учащихся решению задач принадлежит учителю. Но нельзя недооценивать и самостоятельности учащихся при решении задач. При переходе от одного этапа к другому следует руководствоваться рекомендациями по формированию умений. Рассмотрим сущность этих этапов.
Выбирая задачу для учащихся, учитель обязан оценить ее с точки зрения следующих целей.
1.Какие понятия, законы, теории, факты должны быть закреплены в процессе решения, какие стороны свойств изучаемого вещества и химические реакции отмечены в процессе решения.
2.Какие приемы решения задачи должны быть сформированы.
3.Какие мыслительные приемы развиваются в процессе решения задачи.
Какие дидактические функции выполняют данные задачи. Если учитель ставит перед собой цель — закрепление теоретического материала, то метод решения задачи должен быть уже известен учащимся.
Если учитель хочет объяснить новый тип задачи по методу решения, то учащиеся должны свободно оперировать учебным материалом. Одновременно обе цели ставить не рекомендуется.
Задачу учитель решает заранее и проверяет ответ, чтобы убедиться, что он правильный.
На уроке в классе учитель актуализирует знания учащихся, которые используются при решении задачи. Затем проводится анализ условия задачи. Учитель кратко его записывает с помощью символов и условных обозначений, как уже было показано выше. Далее разрабатывают план решения и по возможности выражают его в общем виде с помощью указанных выше формул, соблюдая все правила, которым учащиеся обучены на уроках математики и физики. Только после этого приступают к числовому решению и проверяют ответ.
Если цель решения — изучение нового типа задач, то четко формулируют алгоритм, который учащиеся записывают в тетрадь, и отмечают, какому типу решения он соответствует. В младших классах алгоритм может быть выражен в виде вопросов задачи. После этого к доске можно вызвать хорошего ученика, чтобы он решил аналогичную задачу. Далее учащимся предлагают самостоятельно решить аналогичную задачу.
Задачи различают сложные и трудные. Сложными называют задачи, которые требуют от ученика применения теоретических знаний по разным темам курса химии, умения решать задачи разных типов, объединяя и выбирая для решения конкретной задачи все необходимое. Нередко это задачи обобщающие. Сложность задачи — понятие объективное, подразумевающее большое число элементов знаний и умений, используемых при их решении и определенного перечня мыслительных операций.
Трудные задачи — понятие субъективное. Имеются в виду задачи, требующие творческого подхода, неожиданных умственных действий. Их следует давать для самостоятельного решения только сильным учащимся. В классе такую задачу объяснять не следует. Ее можно использовать в виде индивидуального задания или на внеклассных занятиях. Впрочем, для учеников со слабой обучаемостью трудной задачей может оказаться и объективно сравнительно простая. Учитель обязан это учитывать, осуществляя индивидуальный подход, который при решении задач особенно уместен. При решении задач развивающая функция обучения проявляется особенно четко. С их помощью можно добиться повышения уровня мыслительной активности учеников. В настоящее время издается очень большое число сборников задач, что предоставляет учителю широкий выбор [6-8,9,10].
Похожие работы
... текста, его изложение в соответствии с выработанным планом, нумерация страниц. Оформление цитат и ссылок, библиографии, титульного листа и т.п.); — сопроводительные материалы (иллюстрации, схемы, таблицы и т. п.). В методике обучения праву выделяют разные формы контроля самостоятельной работы учеников. К ним относят и защиту рефератов. Модели защиты реферата 1. «Классическая защита». Устное ...
... пособие по прикладной химии «Задачи по теоретическим основам химической технологии», составленное по материалам представленной работы. 3. Методика решения задач по теоретическим основам химической технологии Одна из главных задач химической науки и промышленности - получение необходимых человеку веществ (продуктов, материалов). Поэтому большинство учебных химических задач снизано с ...
... Просвещение, 1976. 35. Третьяков Ю.Д., Зайцев О.С. Программное пособие по общей и неорганической химии. М.: Юнити, 2005. 36. Фаязов Д.Ф. Формирование умений учащихся пользоваться химическим языком // Химия в школе. 1983. № 2. 37. Фигуровский Н.А. Открытие элементов и происхождение их названий. М.: Наука, 1970. 38. Цветков Л.А. Преподавание органической химии в средней ...
... знает данное производство, то лучше ему самому поводить экскурсию, используя помощь инженерно - технических работников, сопровождающих экскурсию. Экскурсия как особая форма организации учебного процесса требует специальной и довольно основательной предварительной подготовке учащихся. От этого зависит весь ее результат. Опытный учитель на протяжении целого ряда уроков фиксирует внимание учащихся ...



0 комментариев