Навигация
АЛГЕБРАИЧЕСКИЕ СПОСОБЫ РЕШЕНИЯ ХИМИЧЕСКИХ ЗАДАЧ
4. АЛГЕБРАИЧЕСКИЕ СПОСОБЫ РЕШЕНИЯ ХИМИЧЕСКИХ ЗАДАЧ
Алгебраические способы решения задач незаменимы, если задача сложна и ее нельзя решить одной - двумя пропорциями. Именно в этом случае удобно воспользоваться другими методами алгебры, чаще всего линейными уравнениями и неравенствами. Решение задач можно свести к двум этапам: составлению уравнения (системы уравнений) по условию задачи и решению полученного уравнения.
1) Вычисление состава соединений, смесей, выведение формул соединений.
При решении химических задач часто возникает потребность проводить вычисления для нахождения соотношений составных частей в различных объектах. В качестве последних можно рассматривать химические соединения, смеси веществ, сплавы. Задачи этого типа приходиться решать не только химикам, но и представителям самых разнообразных профессий – агрономам, врачам, металлургам, геологам и т. д.
В задачах обычно рассматриваются объекты, которые состоят из компонентов. Количественный состав объектов удобно выражать в долях, которые составляют компоненты по отношению к целому объекту. Употребляют массовую, объемную и молярную доли. Массовая доля w (X![]() ) i-го компонента, входящего в состав объекта, равна отношению массы этого компонента m (X
) i-го компонента, входящего в состав объекта, равна отношению массы этого компонента m (X![]() ) к массе объекта m (об) и выражается в долях единицы или в процентах:
) к массе объекта m (об) и выражается в долях единицы или в процентах:
W (![]() , или w(
, или w(![]() 100 %
100 %
Массу компонента в объекте вычисляют, умножив массу объекта на массовую долю компонента в нем: m(x ) = m ( об ) ∙ w ( x )
Так, зная химический состав соединений, т. е. их формулы и молярные массы, можно вычислять массовые доли элементов в этих соединениях. И наоборот, зная массовые доли элементов в соединениях, можно находить молекулярную формулу соединения.
Ниже приведены примеры решения отдельных задач. Все они принадлежат к одному типу, поэтому алгоритмы их решения идентичны. В преобладающем большинстве случаев ход решения строится так: обозначаем буквами неизвестные величины и формулируем их физический смысл; словесно формулируем смысл уравнений и неравенств, которые затем записываем с помощью символов; подставляем числовые значения; решаем систему уравнений и неравенств и даем ответ.
Задача № 1 . Вывести формулу вещества с молярной массой 123 г/моль, если состав его , выраженный в массовых долях , следующий : углерод 58,5 %, водород 4,1 %, азот 11,4 %, кислород 26,0 %
Решение: Формулу соединения условно можно записать CxH y Nz Ot .
Искомые величины – числа атомов в молекуле ( индексы в данной формуле- x, y, z, t).
Массовые доли химических элементов в данном веществе можно выразить:
![]() W (N) =
W (N) = ![]()
W (H) =![]() W (O) =
W (O) = ![]()
Составим уравнения, учитывая, что произведение молярной массы соединения на массовую долю данного элемента, входящего в его состав, равно молярной массе элемента, умноженной на его индекс в формуле соединения.
Решим каждое уравнение :
М ( CxHy NzOt) ∙ w ( C ) = x∙ M ( C ) 123∙0,585 = 12 х , х = 6
М ( Cx HyNzOt) ∙w ( H ) = y ∙ M ( H ) 123 ∙ 0. 041 = уу = 5
М ( CxHyNz Ot) ∙ w (N ) = z ∙ M ( N ) 123 ∙ 0, 114 = 14 z z = 1
M ( Cx Hy Nz Ot ) ∙ w ( O ) = t∙ M (O) 123∙ 0,26 = 16t, t=2
Ответ: формула соединения ![]() (нитробензол).
(нитробензол).
Задача № 2 . В кристаллогидрате сульфата марганца (II) массовая доля марганца равна
0, 268. Определить количество вещества воды, приходящееся на 1 моль кристаллогидрата. Написать формулу соли.
Решение: Рассматриваемым объектом является 1 моль кристаллогидрата сульфата марганца (II). Его формулу условно запишем ![]() , где n- искомая величина.
, где n- искомая величина.
Составим уравнение, учитывая, что массовая доля марганца в кристаллогидрате равна отношению молярных масс марганца и данного кристаллогидрата:
W (Mn) = ![]()
Подставляя в уравнение вместо символов их числовые значения, получим: 0,268 = ![]() . Решая уравнение, найдём n = 3 .
. Решая уравнение, найдём n = 3 .
Ответ: 1 моль кристаллогидрата сульфата марганца ( II ) содержит 3 моль воды. Формула соли - ![]() .
.
Задача № 3 . При полном сгорании 3,1 г органического вещества (М= 93 ![]() ) образовалось 8, 8 г оксида углерода ( IV) , 2,1 г воды и выделилось 0,47 г азота. Написать формулу вещества.
) образовалось 8, 8 г оксида углерода ( IV) , 2,1 г воды и выделилось 0,47 г азота. Написать формулу вещества.
Решение: В общем виде соединение можно представить формулой ![]() , где х , у, z и t- искомые величины.
, где х , у, z и t- искомые величины.
Составим уравнения, учитывая следующее:
1) масса углерода в сгоревшем веществе и в образовавшемся оксиде углерода
( IV) равны:
m ( CxHy NzOt )![]()
или 3,1![]() 88
88 ![]() , откуда х=6;
, откуда х=6;
1) массы водорода в сгоревшем веществе и в образовавшейся воде равны:
m (CxHyNzOt)![]()
или 3,1![]() , откуда у=7;
, откуда у=7;
2) масса азота в 3,1 г соединения равна 0,47 г:
m (![]() )
) ![]() , 3,1
, 3,1![]() ,
,
откуда z=1;
3) молярная масса соединения равна сумме молярных масс каждого элемента, умноженных на соответствующие индексы в формуле:
М (![]() ) = х
) = х![]() , или
, или
93=6![]() , откуда t =0.
, откуда t =0.
Ответ: формула соединения ![]() (анилин).
(анилин).
Задача № 4 . Массовая доля серебра в соли предельной одноосновной органической кислоты составляет 70,59 %. Написать молекулярную формулу этой кислоты, если известно , что она состоит из углерода , водорода и кислорода .
Решение: Запишем химические формулы кислот и её соли в условном виде:![]() и Аg
и Аg![]() ..Индексы х, у и z-искомые величины.
..Индексы х, у и z-искомые величины.
Выражая молярную массу соли серебра через молярные массы составляющих её атомов, получим:
М (Аg![]() ) =
) =
х![]()
Составим уравнение, учитывая, что произведение молярной массы соли на массовую долю в ней серебра равно молярной массе серебра:
М (Аg![]() )
)![]()
(107+12х+у+16z)![]() откуда 12х + у + 16z = 46.
откуда 12х + у + 16z = 46.
По условию задачи одноосновная предельная органическая кислота имеет общую формулу ![]() , или,
, или, ![]() . Отсюда у =2х , z = 2.
. Отсюда у =2х , z = 2.
Искомые числа х и у одновременно удовлетворяют двум уравнениям:
12х +у +16![]()
2х = у
Решая систему уравнений, получим х = 1, у = 2. Следовательно, формула кислоты - ![]() , или НСООН.
, или НСООН.
Ответ: Формула кислоты - НСООН.
Задача № 5 . После полного термического разложения 2,0 г смеси карбонатов кальция и стронция получили 1,23 г смеси оксидов этих металлов. Оксид углерода (IV) улетучился. Вычислить массу карбоната стронция в исходной смеси.
Решение: Запишем уравнение реакции:
x y
SrC![]() → SrO + C
→ SrO + C![]() (I)
(I)
Похожие работы
... текста, его изложение в соответствии с выработанным планом, нумерация страниц. Оформление цитат и ссылок, библиографии, титульного листа и т.п.); — сопроводительные материалы (иллюстрации, схемы, таблицы и т. п.). В методике обучения праву выделяют разные формы контроля самостоятельной работы учеников. К ним относят и защиту рефератов. Модели защиты реферата 1. «Классическая защита». Устное ...
... пособие по прикладной химии «Задачи по теоретическим основам химической технологии», составленное по материалам представленной работы. 3. Методика решения задач по теоретическим основам химической технологии Одна из главных задач химической науки и промышленности - получение необходимых человеку веществ (продуктов, материалов). Поэтому большинство учебных химических задач снизано с ...
... Просвещение, 1976. 35. Третьяков Ю.Д., Зайцев О.С. Программное пособие по общей и неорганической химии. М.: Юнити, 2005. 36. Фаязов Д.Ф. Формирование умений учащихся пользоваться химическим языком // Химия в школе. 1983. № 2. 37. Фигуровский Н.А. Открытие элементов и происхождение их названий. М.: Наука, 1970. 38. Цветков Л.А. Преподавание органической химии в средней ...
... знает данное производство, то лучше ему самому поводить экскурсию, используя помощь инженерно - технических работников, сопровождающих экскурсию. Экскурсия как особая форма организации учебного процесса требует специальной и довольно основательной предварительной подготовке учащихся. От этого зависит весь ее результат. Опытный учитель на протяжении целого ряда уроков фиксирует внимание учащихся ...

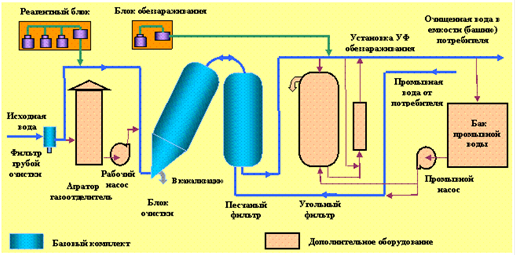


0 комментариев