Навигация
3.4. Применение.
Легкоплавкий, удобный в переработке, свинец широко применяется в наши дни. Из свинца изготавливают оболочки кабелей, электроды аккумуляторов, аноды, используемые при хромировании; им покрывают изнутри сосуды предназначенные для хранения серной кислоты, также изготовляют змеевики холодильников и другие ответственные части аппаратуры. Свинец идет на изготовление боеприпасов и на выделку дроби. Он входит в состав многих сплавов, например сплавов для подшипников, типографского металла. Свинец хорошо поглощает рентгеновское и радиоактивное излучение, и его используют для защиты от излучения при работе с радиоактивными веществами. Применяют для получения тетраэтилсвинца (ТЭС) и других соединений свинца.
4.Источники загрязнения окружающей среды свинцом.
4.1.1. Получение свинца.
1)Восстановительный обжиг. Обогащенный флотацией галенит обжигают на воздухе для удаления серы и образующийся оксид свинца (II) восстанавливают коксом или чаще – монооксидом углерода в шахтных печах:
2PbS+3O2=2PbO+2SO2
PbO+CO=Pb+CO2
В результате получают черновой свинец, из которого выделяют медь, серебро, железо, олово, мышьяк и сурьму, висмут остается вместе со свинцом. Особо чистый свинец получают электролитическим рафинированием с использованием фторосиликатного электролита.
2)Окислительный обжиг. Особенно чистую руду PbS подвергают частичному окислению до PbO, а затем смесь прокаливают:
PbS+2PbO=3Pb+SO2
3)Из солей свинца с помощью электролиза.
4)Взаимодействие солей свинца с цинком:
Pb(NO3)2+Zn=Zn(NO3)2+Pb
или восстановление оксида свинца (II) током водорода:
PbO+H2=Pb+H2O.
4.1.2. Загрязнение окружающей среды в процессе получения свинца.
При процессах производства свинца и его сплавов в атмосферу выбрасывается значительное количество свинцовой пыли. Свинец, содержащийся в этой пыли, вовлекается в биологический круговорот, негативно воздействуя при этом на все живое.
4.2.1. Несомненно, огромный вклад в загрязнение окружающей среды свинцом превносят Химические источники тока.
Аккумулятор – устройство для накопления энергии с целью её последующего использования.
Рассмотрим принцип действия свинцового (кислотного) аккумулятора.
Готовый к употреблению свинцовый аккумулятор состоит из решётчатых свинцовых пластин, одни из которых заполнены диоксидом свинца, а другие – металлическим губчатым свинцом. Пластины погружены в 35-40 % раствор H2SO4; при этой концентрации удельная электрическая проводимость раствора серной кислоты максимальна.
При работе аккумулятора – при его разряде – в нем протекает окислительно-восстановительная реакция, в ходе которой металлический свинец окисляется:
Pb+SO42-=PbSO4+2e-,
а диоксид свинца восстанавливается:
PbO2+SO42-+4H++2e-=PbSO4+2H2O.
Электроны, отдаваемые атомами металлического свинца при окислении, принимаются PbO2 при восстановлении; электроны передаются от одного электрода к другому по внешней цепи.
Таким образом, металлический свинец служит в свинцовом аккумуляторе анодом и заряжен отрицательно, а PbO2 служит катодом и заряжен положительно.
Во внутренней цепи(в растворе H2SO4) при работе аккумулятора происходит перенос ионов. Ионы SО42- движутся к аноду, а ионы Н+ - к катоду. Направление этого движения обусловлено электрическим полем, возникающим в результате протекания электродных процессов: у анода расходуются анионы, а у катода – катионы. В итоге раствор остается электронейтральным. Если сложить уравнения, отвечающие окислению свинца и восстановлению PbO2, то получится суммарное уравнение реакции, протекающей в свинцовом аккумуляторе при его работе (разряде):
Pb+PbO2+4H++2SO42-=2PbSO4+2H2O.
ЭДС заряженного свинцового аккумулятора равна 2 В. По мере разряда аккумулятора материалы его катода (PbO2) и анода (Pb) расходуются. Расходуется и серная кислота. При этом напряжение на зажимах аккумулятора падает. Когда оно становится меньше значения, допускаемого условиями эксплуатации, аккумулятор вновь заряжают. Для зарядки аккумулятор подключают к внешнему источнику тока. При этом ток протекает через аккумулятор в направлении, обратном тому, в котором он проходил при разряде аккумулятора. В результате этого электрохимические процессы на электродах “обращаются”. На свинцовом электроде теперь происходит процесс восстановления:
PbSO4+2e-=Pb+SO42-
т.е. этот электрод становится катодом.
На электроде из PbO2 при зарядке идет процесс окисления:
PbSO4+2H2O=PbO2+4H++SO42-+2e-
следовательно, этот электрод является теперь анодом. Ионы в растворе движутся в направлениях, обратных тем, в которых они перемещались при работе аккумулятора. Складывая два последние уравнения, получим уравнение реакции, протекающей при зарядке аккумулятора:
2PbSO4+2H2O=Pb+PbO2+4H++2SO42-.
Нетрудно заметить, что этот процесс противоположен тому, который протекает при работе аккумулятора; при зарядке аккумулятора в нем вновь получаются вещества, необходимые для его работы.
Свинцовый аккумулятор используется как автономный источник электрической энергии, главным образом применяется в транспорте.
Похожие работы
... поведении в природе, в сознании фиксируется отрицательное отношение к флоре и фауне. Это ни в какой мере не учитывает особенности детей дошкольного и младшего школьного возраста: эмоциональной восприимчивости, подражательности, непосредственности поведения. Многие выпускники начальной школы были беспомощны, когда требовалось оказание помощи, проявление заботы, внимания к объекту. Даже если дети ...
... продолжают обустройство нефтяных месторождений по временным схемам - без пунктов сбора, подготовки и транспорта нефтяного газа. На базе Пермского межотраслевого научно-исследовательского института экологии топливно-энергетического комплекса сформирован специализированный Центр по борьбе с разливами нефти, создаются подобные службы и на нефтегазовых предприятиях. Но говорить о развитой система ...
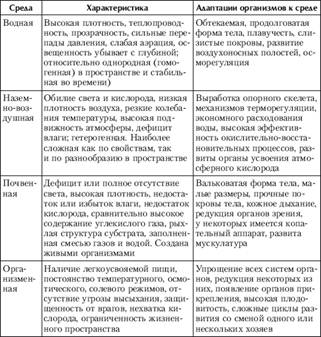
... и ее ресурсами. Таким образом, экология является мировоззренческой, синтетической областью знаний, интегрирующей естественнонаучные и гуманитарные знания. Стратегической задачей экологии является развитие теории взаимодействия природы и общества на основе нового взгляда, рассматривающего человеческое общество как неотъемлемую часть биосферы. 2. Среды жизни, экологические факторы Все ...
... Почва, город, экология /под ред. академика РАН Добровольского/. М.: Фонд «За экономическую грамотность», 1997. 29. Салеева Л.П. Содержание экологического образования // Биология в школе, 1987. №3. 30. Ситаров В.А., Пустовойтов В.В. Социальная экология: Учебное пособие для студентов высш. пед. учебн. заведений/. М.: Издательский центр «Академия», 2000. 280 с. 31. Социально- ...


0 комментариев