Навигация
Метанол как источник энергии. Проблемы безопасности использования
2.3 Метанол как источник энергии. Проблемы безопасности использования.
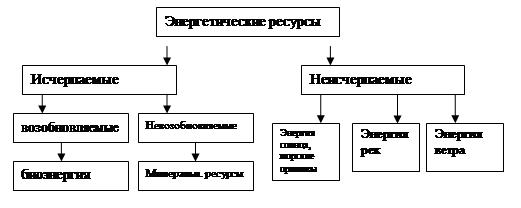
Последние события в мире показывают полную зависимость человечества от нефти и природного газа. Что будет, если нефть и газ закончатся? Ведь человек полностью зависит от их добычи. Но есть другой простой в обращении, удобный и безопасный в хранении носитель – метанол – жидкий кислородсодержащий углерод. Его получают из газа на основе ископаемых видов топлива.
В атмосферу метанол выбрасывается множеством источников природного происхождения. Его антропогенный выброс происходит главным образом во время испарения при использовании в качестве растворителя. В окружающей среде метанол быстро разлагается микроорганизмами с образованием СО2 и воды. Он обладает бесконечной растворимостью в воде [17].
Метанол – бесцветная жидкость со слабым запахом спирта, что в основном и вызывает негативное отношение к нему и сдерживает применение.
Метанол, как и другие моторные виды топлива, токсичен для человека. Он быстро попадает в организм при вдыхании и через пищеварительный тракт, медленнее при воздействии на кожу [18].
Случайный выброс метанола в окружающую среду в процессе его производства, транспортировки и хранения хотя и возможен, но не принесет большого вреда по сравнению с разливом нефти или бензина. Если большое количество метанола попадет на поверхность воды, то воздействие на экосистему будет отмечаться только в непосредственной близости от места утечки. Однако он быстро разбавится водой и рассеется в воздухе под действием ветра.
При разложении метанола не остается осадков, от которых необходимо очищать пляжи и прибрежные зоны, как после утечки сырой нефти. Утечки метанола не так опасны, как утечки бензина, потому что бензин содержит токсичные и канцерогенные компоненты (например, бензол), которые очень медленно разлагаются и длительное время остаются в окружающей среде.
2.4 Проблема загрязнения окружающей среды сернистыми соединениями, содержащимися в углеводородном сырье
Функционирование нефтедобывающей и нефтеперерабатывающей отраслей промышленности создает множество экологических проблем. Наиболее актуальной является проблема загрязнения окружающей среды сернистыми соединениями, содержащимися в нефтях и газах.
Сернистые соединения нефти представляют собой сложные смеси, состоящие из меркаптанов, сульфидов и дисульфидов с открытой цепью, элементной серы и сероводорода, циклических и гетероциклических соединений. Присутствие в нефти свободной серы объясняется разложением более сложных сернистых соединений, окислением сероводорода или меркаптана. Свободная сера – активный коррозирующий агент, и ее присутствие в нефти и дистиллятах нежелательно вследствие сложности очистки. Она вступает в реакции с высшими парафинами углеводородами с образованием в основном сероводорода и сероуглерода. С непредельными углеводородами сера реагирует, образуя соединения сложного строения.
Сероводород может присутствовать в попутном газе, в самой нефти, в продуктах перегонки нефти, а также в продуктах термического и каталитического крекинга, каталитического рифоринга, гидроочистки и др.
Нефть и нефтепродукты также могут содержать сернистые соединения, появляющиеся в результате очистки нефтяных дистеллятов. К ним относятся кислые и средние эфиры серной кислоты, а также сульфокислоты. Кислые эфиры представляют собой жидкости с сильными кислотными свойствами.
Наличие в углеводородном сырье меркаптанов, сероводорода и других агрессивных серосодержащих соединений, создающих специфические трудности при добыче, транспортировке, хранении и переработке, делает проблему обессеривания нефти и нефтепродуктов особо актуальной. В настоящей время в мировой нефтеперерабатывающей промышленности довольно четко обозначились два аспекта проблемы: первый связан с получением высококачественных нефтепродуктов из сернистых и высокосернистых нефтей, второй – с получением серосодержащих химикатов [19].
Глава 3 О МЕТОДИКЕ ИЗУЧЕНИЯ ЭКОЛОГИЧЕСКИХ АСПЕКТОВ РАЗДЕЛОВ ТЕМЫ НА УРОКАХ ХИМИИ
Содержание экологизированного курса помимо теоретического материала и химического эксперимента включает расчетные и экспериментальные задачи, сюжетно- ролевые уроки, экологические игры, контролирующие задания с экологическим содержанием.
Преподавание курса может осуществляться в разных вариантах. Один предусматривает систематическое включение экологической информации в конкретные темы, другой - предполагает ознакомление учащихся с общими экологическими закономерностями и изучения химии в контексте этих представлений.
3.1 Урок. Ароматические углеводороды
Цели: Познакомить ребят с ароматическими соединениями и ароматической связью. Рассмотреть строение молекулы бензола, физические свойства и основные способы его получения. Дать понятие о видах изомерии и номенклатуре гомологов бензола. Изучить химические свойства, рассмотреть применение бензола и его гомологов.
Оборудование и реактивы: бензол, раствор перманганата калия и бромная вода, пробирки, необходимая стеклянная посуда.
Ход урока.
I. Организационный момент. Проверка домашнего задания.
Учитель начинает урок с объяснения нового материала.
II. Строение. Номенклатура и изомерия карбоновых кислот.
Формулируете определение класса ароматических УВ (или аренов) как соединений, молекулы которых содержат одно или несколько бензольных колец. Далее подробно разъяснить понятие «бензольное кольцо» на примере молекулы важнейшего ароматического соединения – бензола.
Изучение строения молекулы и свойств бензола проводится в контексте учебника. Далее необходимо вспомнить основные химические свойства предельных и непредельных УВ.С учетом специфики класса проводим экспресс-опрос учащихся или кратко напоминаем изученный материал: Основное химическое свойство алканов – это способность к реакции замещения в определенных условиях, и инертность по отношению к растворам KMnO4 и бромной воде. Основное химическое свойство алкенов – это способность к реакциям присоединения в определенных условиях, непредельные УВ распознают по обесцвечиванию малинового раствора KMnO4 и исчезновению оранжевой окраски бромной воды.
Далее учитель выписывает молекулярную формулу бензола на доске и предлагает ребятам определить характер этого углеводорода. Учащиеся с легкостью делают вывод о непредельном характере бензола. Педагог выполняет демонстрационный эксперимент с раствором KMnO4 и бромной водой. Ребята отмечают в тетрадях, что бензол не взаимодействует с данными реагентами. Учитель дополняет характеристику химических свойств бензола: оказывается, наиболее характерными для него являются реакции замещения, а в реакции соединения он вступает только в жестких условиях.
- Исходя из химических свойств бензола, какой можно сделать вывод о характере этого соединения? (По химическим свойствам бензол ближе к предельным УВ, чем непредельным.)
В результате такого подхода, учитель создал проблемную ситуацию: несоответствие молекулярной формулы бензола с его химическими свойствами.
Сообщаем, что подобный вопрос возник после открытия бензола Фарадеем еще в 19 веке и на протяжении нескольких десятков лет привлекал внимание исследователей. Пытаясь разрешить это противоречие, многие исследователи предлагали различные варианты структуры бензола. Далее знакомим ребят со структурной формулой предложенной немецким ученым Кекуле. Учитель напоминает, что подобным образом расположенные двойные связи называются сопряженными.
Вопрос о структуре бензола решился только в 20 веке, когда на помощь химикам пришли физические и квантово - механические методы исследования строения молекул. Знакомим ребят с современными представлениями о строении молекулы бензола:
1) все атомы С находятся в состоянии sp2 – гибридизации, значит каждый атом С образует 3 σ-связи и 1 π-связь.
2) молекула бензола представляет собой плоский правильный шестиугольник, валентные углы между связями равны 120о
3) все углерод-углеродные связи равноценны, длина – С - С – связи равна 0,139 нм.
4) все σ-связи находятся в одной плоскости.
5) 6 негибридизованных р-орбиталей атомов С расположенные перпендикулярно плоскости кольца и параллельные друг другу, перекрываются между собой и образуют единую сопряженную π-систему.
Учитель объясняет, что сочетание 6 σ-связей с единой π-системой называется ароматической связью.
Запись в тетради: бензольное кольцо – это циклическая группировка из 6 атомов углерода с особым характером связи, называемой ароматической.
Для изучения физических свойств бензола, следует провести соответствующие демонстрационные опыты: представляем прозрачную склянку с бензолом, смешиваем его с водой. Для демонстрации легкоплавкости бензола, в начале урока помещаем пробирку с бензолом в стакан со льдом, затвердевший бензол показываем классу. В результате эксперимента, учащиеся выясняют, что бензол представляет собой бесцветную жидкость, нерастворимую в воде (как все УВ).
- Почему бензол при смешивании с водой переходит в верхний слой? (Очевидно, плотность бензола меньше плотности воды, поэтому бензол при смешивании с водой переходит в верхний слой.)
III. Изомерия и номенклатура гомологов бензола.
Отмечаем, что для гомологов бензола характерна только изомерия положения нескольких заместителей. Остальные виды изомерии для бензола и его гомологов не наблюдаются в виду особенностей строения бензольного кольца. Приведем тривиальные названия ближайших гомологов бензола – толуол, ксилол. Акцентируем внимание ребят на правилах нумерации заместителей: сумма цифр заместителей должна быть наименьшей.
IV. Способы получения
Сообщаем, что основными промышленными способами получения ароматических УВ является:
1) сухая перегонка каменного угля (коксование);
2) нефтепереработка.
Отметим, что некоторые сорта нефти богаты ароматическими УВ, которые отделяют простой перегонкой. Арены получают также пиролизом и каталитическим крекингом нефтяных продуктов.
Синтетические способы получения бензола и его гомологов
| Способ получения | Уравнение химической реакции |
| Дегидрирование циклогексана | С6Н12 Рt, 300˚C→ С6Н6 +3Н2О() |
| Ароматизация алканов | С7Н16 Рt, 300˚C→ С6Н5 –СН3 +4Н2 |
| Тримеризация ацетилена | 3С2Н2 Сакт.,400˚С→ С6Н6 |
| Синтез Вюрца | С6Н5Вr+ 2Na+Br – С2Н5AlCl3→2NaBr+С6Н5 – С2Н5 |
| Алкирование | С6Н6 + С2Н5 –Cl AlCl3→ С6Н5 - С2Н5 +HCl С6Н6 + CH2=CH2 H+→ С6Н6 - С2Н5 |
V. Химические свойства бензола
| Тип химической реакции | Уравнения химических реакций |
| Реакции замещения | |
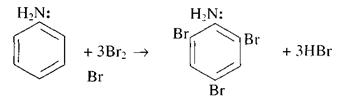
| 1)Галогенирование | С6Н6+Br2 FeBr3→ С6Н5Br+HBr |
| 2)Нитрирование | С6Н6+HO – NO2H2SO4конц→ С6Н5NO2+Н2O |
| 3)Алкилирование | С6Н6+ С2Н5 - ClAlCl3→ С6Н5 - С2Н5 +HCl |
| 4)Ацетилирование | С6Н6+ Cl – C – CH3 AlCl3→ С6Н5 – C -СН3 ║ ║ O O |
| Реакции окисления | |
| Горение | 2С6Н6+15O2→12CO2 + 6H2O |
| Неполное окисление | С6Н5- СН3 + 3[O] → С6Н5- СOOH + H2O |
| Реакции присоединения | |
| Гидрирование | С6Н6+3H2Pt 180˚C→ С6Н12 |
| Хлорирование | С6Н6+3Cl2 УФ→ С6Н6Cl6 |
VI. Применение бензола и его гомологов.
Бензол используется в качестве сырья для химической промышленности. Из бензола получают растворители, лекарства, красители, ядохимикаты и др.[20]
Тесты для закрепления материала.
1. Молекула бензола состоит:
а) из четырех атомов углерода;
б) из пяти атомов углерода;
в) из шести атомов углерода;
г) из семи атомов углерода.
2. Бензол относится:
а) к углеводородам;
б) к кислородсодержащим;
в) к производным углеводородам;
г) к галогенпроизводным.
3. Бензол добывают из:
а) природного газа;
б) попутного нефтяного газа;
в) нефти;
г) кокса.
4. Бензол является источником для получения:
а) кумола;
б) пропанола;
в) этилена;
г) ацетилена.
5. В промышленности бензол получают синтетическим путем из:
а) ацетилена;
б) этана;
в) уксусной кислоты;
г) жиров.
6. Бензол вступает в реакции:
а) присоединения;
б) разложения;
в) окисления;
г) изомеризации.
7. С каким из предложенных веществ бензол не будет взаимодействовать:
а) с водородам;
б) с кислородом;
в) с металлическим железом;
г) с газообразным хлором.
8. Напишите реакцию полного горения бензола при недостатке кислорода. Коэффициент перед молекулой бензола равен:
а) 2;
б) 3;
в) 12;
г) 6.
9. Как непредельный углеводород бензол нельзя определить с помощью:
а) реакции с раствором перманганата калия;
б) реакции с бромной водой;
в) реакции гидрирования;
г) реакции с хлорной водой.
10. Сколько литров кислорода потребуется для полного сгорания 7,8 г бензола:
а) 16,5 л;
б) 16,6 л;
в) 16,8 л;
г) 16,9 л.
3.2 Урок – упражнение. Генетическая связь между различными классами углеводородов
Цель урока: Повторение и обобщение изученного материала по теме «Углеводороды». Рассмотреть генетическую взаимосвязь различных классов углеводородов.
Оборудование и реактивы: таблицы, схемы, плакаты, используемые в теме «Углеводороды».
I. Организационный момент. Проверка домашнего задания.
1) Какие соединения называются ароматическими?
2) Назовите простейший ароматический УВ, приведите его молекулярную формулу. Обесцвечивает ли бензол бромную воду и раствор перманганата калия? Почему?
3) Опишите физические свойства бензола.
4) Опишите электронное строение молекулы бензола. Сколько σ- и π- связей содержится в молекуле бензола?
5) Что такое «бензольное кольцо»?
6) Какая связь называется ароматической?
7) Перечислите основные способы получения аренов.
8) Перечислите химические свойства ароматических углеводородов.
II. Генетическая связь между классами углеводородов
Обобщаем изученный материал по теме «Углеводороды». С этой целью предлагаем ребятам перечислить изученные классы УВ: алканы, алкены, алкины, алкадиены, циклоалканы, арены. Вспоминаем все известные названия данных классов соединений, например, алканы – это предельные или насыщенные УВ, парафины и т.д. Итого 6 классов органических соединений. Перечисляем основные признаки каждого класса УВ: алканы содержат максимально возможное число атомов водорода и все связи между атомами являются одинарными; алкены содержат двойную связь, алкины – тройную, алкодиены – 2 двойные связи, циклические УВ содержат замкнутую цепочку из атомов С, в случае циклоалканов все связи между ними являются одинарными; арены содержат бензольное кольцо, в котором реализуется ароматическая связь.
Выписываем общие формулы гомологических рядов изученных углеводородов на доске и предлагаем ребятам определить класс УВ, имеющих приведенные формулы:
Общие формулы гомологических рядов углеводородов:
1. СnH2n+2 ; 2. СnH2n; 3. СnH2n-2 ; 4. СnH2n-6 .
1) алканы;
2) алкены, циклоалканы;
3) алкины, алкадиены;
4) арены.
- Как отличаются по составу УВ различных классов? При ответе следует использовать общие формулы гомологических рядов. (УВ различных гомологических рядов отличаются друг от друга содержанием водорода. Больше всего водорода содержат алканы, меньше всего арены.)
Подведем ребят к мысли о том, что превращать УВ разных классов друг в друга, можно отнимая или присоединяя атомы водорода, т.е. с помощью реакций гидрирования и дегидрирования. Схематически это можно изобразить следующим образом:
СnH2n+2 ↔ СnH2n↔ СnH2n-2 ↔ СnH2n-6
Сообщаем ребятам, что данный способ (гидрирования и дегидрирования) широко используется для получения УВ, однако он не является единственным и имеет множество исключений, т.е. не является универсальным.
Таким образом, все классы УВ связаны между собой взаимными переходами или находятся в генетическом родстве. Предложим ребятам вспомнить, где еще они встречались с подобными переходами. Учащиеся должны сообщить, что основные классы неорганических соединений также связаны между собой взаимными переходами и находятся в генетическом родстве между собой. Составляем расширенную схему взаимных переходов между различными гомологическими рядами УВ:
циклоалканы←
↑ ↓
алканы ↔алкены↔ алкины↔ арены
│_________________________↑
Для закрепления изученного материала предлагаем выполнить следующие тесты:
1. Какова структурная формула органического соединения состава СnH2n+2 , где n=2:
а) С2Н6;
б) С2Н4;
в) Н:С:С:Н;
г) Н-СН2-СН2-Н.
2. Назовите соединение СН3-СН2-СН3 по рациональной номенклатуре:
а) диметиметан;
б) пропан;
в) пропен-1;
г) пропиленметилметан.
3. Выберите правильное название остатка алкена:
СН2=СН – СН2 -
а) пропил;
б) изобутил;
в) пропенил-1;
г) пропенил-2.
4. Этилен не используют:
а) для получения этилового спирта;
б) для получения пластмасс;
в) в качестве горючего;
г) для получения 1,2-дихлорэтана.
5. Вставьте пропущенное соединение Х в уравнение реакции
SrC2+ Н2О → НС ≡ СН + Х
а) водород;
б) кислород;
в) вода;
г) гидроксид стронция.
6. Выберите правильное название остатка алкина
НС ≡ С – СН2 -
а) пропинил-2;
б) пропинил-1;
в) изопропил;
г) пропенил-2.
7. Какой углеводород является межклассовым изомером для диенового углеводорода, молекулярная формула которого
Н2С = СН – СН = СН2
а) бутан;
б) изобутан;
в) бутен-1;
г) бутин-2.
8. Продуктом гидратации этилена является:
а) этин;
б) этиловый спирт;
в) этан;
г) политэтилен.
9. Как непредельный углеводород бензол нельзя определить с помощью:
а) реакции с раствором перманганата калия;
б) реакции с бромной водой;
в) реакции гидрирования;
г) реакции с хлорной водой.
10.Сколько литров кислорода потребуется для полного сгорания 7,8 г бензола:
а) 16,5 л;
б) 16,6 л;
в) 16,8 л;
г) 16,9 л.
Д/З: На основании молекулярных формул, определить, к каким гомологическим рядам относятся приведенные ниже УВ. В некоторых случаях возможно несколько вариантов ответа.
а) С4Н10; б) С8Н10 ; в) С4Н16 ; г) С4Н6 ; д) С7Н14
Ответы: а) алканы; б) арены; в) алкены или циклоалканы; г) алкины или алкадиены; д) алкены или циклоалканы.
Похожие работы
... весь цилиндр. Это опыт демонстрирует одну из биологических функций железа. По химической природе, каталаза – геминовый фермент, содержащий железо. [3] 2. Разработка темы «Основания» в курсе неорганической и органической химии 2.1 Урок по теме «Основания» Цели урока: познакомить учащихся с новым классом химических соединений – основаниями, их свойствами (отношение к воде, действие на ...
... период многие страны приняли решение о полном или постепенном отказе от развития атомной энергетики. 1.3 Особенности альтернативной водородной энергетики Водородная энергетика включает следующие основные направления: Разработка эффективных методов и процессов крупномасштабного получения дешевого водорода из метана и сероводородсодержащего природного газа, а также на базе разложения воды; ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... и закрепление знаний учащихся; - умение наблюдать химические явления; - развитие интеллектуальных способностей и формирование абстрактного мышления. [4] 3. Дидактические подходы при изучении темы «Молекулярные перегруппировки» Дидактика – область педагогики, разрабатывающая общую теорию образования и обучения и занимающаяся содержанием образования, закономерностями процесса обучения, ...


0 комментариев