Навигация
Фотометрический фенол-гипохлоритный
7.1.3. Фотометрический фенол-гипохлоритный
метод
При взаимодействии аммиака с гипохлорит-ионами образуется монохлорамин, который далее с фенолятом даст n-аминофенол:
![]()
![]()
Последний, реагируя со второй молекулой фенола, образует сначала 4,4’-дигидрксидифениламин, а затем краситель индофенол:
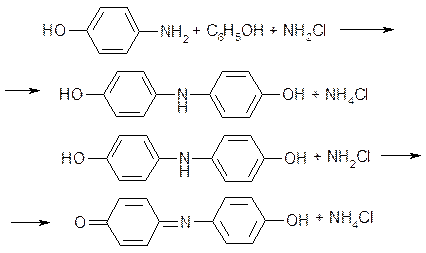
Предполагалось, что добавляемый в раствор нитропруссид натрия служит в этих процессах катализатором, однако наши исследования показали, что он вступает в реакцию с парааминофенолом с образованием продукта, имеющего также синюю окраску. Реакция идет в обоих направлениях, и в результате интенсивность получаемой окраски возрастает и повышается чувствительность метода:

В качестве катализатора и стабилизирующего агента вводят соль марганца.
Мешающие вещества. Определению NH+4 фенолгипохлоритным методом мешают немногие вещества; их значительно меньше, чем при определении с реактивом Несслера. Это дает возможность во многих случаях проводить определение NH+4 без предварительной отгонки аммиака. В частности, было показано, что определение без предварительной отгонки вполне применимо при анализе сточных вод, содержащих наряду с аммиаком ряд органических соединений, в состав которых входит азот (меламин, дицианамид, карбамид, циануровая кислота).
Мешают сильно сероводород и сульфиды. Их можно удалить, подкислив пробу до pH=3 и пропустив воздух до исчезновения запаха сероводорода. Мешают восстановители, реагирующие с гипохлоритом (например, цианиды, роданиды), большая щелочность пробы (выше 500 мг/л), слишком большая кислотность (больше 100 мг-экв/л) и вещества, вызывающие окраску воды или мутность. В таких случаях проводят предварительную отгонку аммиака.
Реактивы
Бидистиллят, не содержащий аммиака. Дважды перегнанную воду пропускают через колонку с катионитом КУ-2. Эту воду используют для приготовления реактивов и разбавления проб.
Фенольный реактив. В 100 мл безаммиачной дистиллированной воды растворяют 5 г бесцветного свежеперегнанного фенола, 25 мл нитропруссида натрия и 0,1 г салициловой кислоты.
Гипохлоритный реактив, 3%-ный раствор. К 50 г хлорной извести (не менее чем 25%-ной по содержанию активного хлора) приливают 85 мл безаммиачной воды и перемешивают. Затем постепенно, при непрерывном перемешивании стеклянной палочкой, в течение 15 мин прибавляют раствор карбоната натрия (35 г безводной соли в 85 мл безаммиачной воды). Полученная масса сначала загустевает, а потом, по мере добавления раствора карбоната натрия, постепенно разжижается. Образующуюся суспензию фильтруют через воронку о стеклянной фильтрующей пластинкой (№ 2), применяя разрежение с помощью водоструйного насоса. Полученный раствор гипохлорита натрия хранят в холодильнике в склянке из темного стекла с притертой пробкой. Перед использованием этот концентрированный раствор разбавляют безаммиачной водой в отношении 1: 1. Можно также применять продажный раствор гипохлорита натрия.
Сульфат марганца. Растворяют 70 мг MgSO4 5Н2 O в 100 мл безам-миачной дистиллированной воды.
Стандартный раствор хлорида аммония. Основной раствор. Растворяют в безаммиачной воде 296,5 мг безводного хлорида аммония NH4Cl , высушенного при 100°, и разбавляют такой же водой до 1000 мл, 1,00 мл полученного раствора содержит 100 мкг NH+4.
Рабочий раствор. Разбавляют безаммиачной дистиллированной водой 5 мл основного стандартного раствора до 100 мл; 1 мл полученного раствора содержит 5 мкг NH+4.
Ход определения. Отбирают 5 мл раствора, полученного после отгонки аммиака, или первоначальной пробы сточной воды, если
она не содержит мешающих определению веществ. В этом объеме должно быть не более 6 мкг ионов аммония. Если раствор более концентрированный, отбирают меньший объем и разбавляют до 5 мл безаммиачной водой. Отобранную порцию переносят в пробирку, снабженную притертой пробкой, прибавляют 1 каплю раствора сульфата марганца, 1 мл фенольного реактива и перемешивают. Затем приливают 0,5 мл гипохлоритного реактива, закрывают пробкой и энергично взбалтывают 2 мин. Дают постоять 4 ч для развития окраски н измеряют оптическую плотность по отношению к холостому раствору в кювете с толщиной слоя 1 см при ![]() = 625 нм.
= 625 нм.
Содержание NH+4 находят по калибровочному графику, учитывая сделанные разбавления. Для построения калибровочного графика в мерные колбы вместимостью 50 мл наливают 0, 1, 2, 3, 4, 5, 6, 8, 10 и 12 мл рабочего стандартного раствора хлорида аммония и доводят каждый раствор до метки безаммиачной водой, концентрации NH+4 в полученных растворах равны соответственно 0; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,8; 1,0 и 1,2 мг/л. Эти растворы обрабатывают, как описано выше, и по результатам измерения оптической плотности строят калибровочный график.
Похожие работы
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... в процессе его производства. Первая стадия производства титана заключается в рудно-восстановительной плавке, которая проводится с целью обогащения исходного материала окисными соединениями титана. Во всех последующих стадиях производства взаимодействие титана и его соединений с кислородом нежелательно. Титан растворяет такие элементы, как азот, водород и углерод. С последним он образует стойкие ...
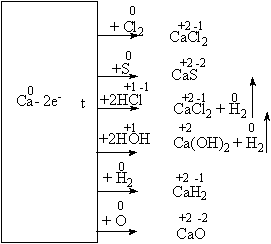
... среды. 3.1 Урок по теме «Кальций и его соединения» в 9-ом классе с. Карасу, позволяющий развить экологическое сознание школьников Цель урока: познакомить учащихся с основными способами получения кальция и его соединений, возможностями применения соединений кальция, показать необходимость контроля содержания ионов кальция и магния в питьевых и сточных водах и обозначить значимость кальция ...
... разделам школьной программе по химии, тем более, что в учебнике этот материал, по-моему, незаслуженно отсутствует. Данная работа посвящена изучению основных физических и химических свойств хрома и его соединений, позволяет оценить важность этого химического элемента. 1.Исторические сведения В 1766 году петербургский профессор химии И.Г.Леман описал новый минерал, найденный на Урале на ...

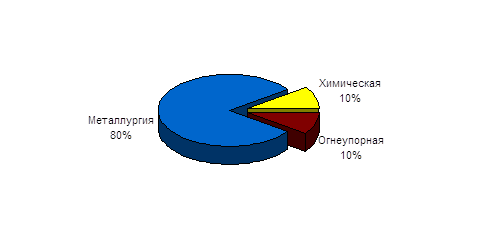
0 комментариев