Навигация
Анализ азота и его соединений
АЗОТ И ЕГО СОЕДИНЕНИЯ
В обычных условиях N2- физиологически индифферентный газ. Почти все летучие соединения N2 ядовиты. Аммиак NH3 сильно раздражает верхние дыхательные пути и глаза, а в больших концентрациях также возбуждает центральною нервную систему. Сходно действуют на нервную систему гидразин N2H4 и его производные, обладающие одновременно сильным гепатотоксическим действием. Гидроксиламин NH2OH вызывает преимущественно превращения гемоглобина в метгемоглобин и - вторично - распад красных кровяных телец. Распад эритроцитов вызывает, по-видимому, также и азотистоводородная кислота HN3, в то же время она действует на окислительные процессы в организме, сильно раздражает верхние дыхательные пути и глаза и снижает кровяное давление. Раздражающее действие оказывает и хлористый азот NCI3.
Закись азота N2O действует практически как индифферентный газ, а в очень больших концентрациях в смеси с кислородом - как наркотик. Окись азота NO вызывает быстрое превращение гемоглобина крови в метгемоглобин и действует на центральную нервную систему. Двуокись азота NO2 (N2O4) раздражает главным образом легкие, вызывает отек их. Сходно действуют азотная кислота HNO3 и нитрозилхлорид NOСL. Нитриты, а также эфиры азотистой кислоты сильно расширяют сосуды и снижают кровяное давление и переводят гемоглобин крови в метгемоглобин. Нитраты раздражают кожу. Эфиры азотной кислоты действуют наркотически, поражают сердечно-сосудистую систему, а также образуют метгемоглобин.
АЗОТ
N2 M=28,01
Применяется для синтеза аммиака; как хладагент; как инертная среда для ряда химических реакций.
Получается сжижением и фракционированной перегонкой воздуха. Физические и химические свойства. Бесцветный газ. Раств. в воде 2,3 мл/ИХ) г (0°); 0,8 мл/ЮО г (60°). В обычных условиях химически инертен и только с литием образует Li3N; при высоких температурах его активность возрастает.
Токсическое действие. Действие N2 проявляется только *при резком снижении давления O2. При давлении О2 100 мм рт. ст. сказываются последствия аноксии. Насыщение организма происходит быстро; выделяется N2 быстро при снижении давления воздуха.
Животные. При давлении N2 5-7 кгс/см2 у белой мыши изменяется способность к суммации подпороговых импульсов (Карев), легкая атаксия наблюдается при 12-18, полный наркоз при 25-34 кгс/см2 (Лазарев). Наркотическое действие при экспозиции 30 мин наблюдается при давлении N2 для кроликов 50 кгс/см2, собак 49, кошек 40, морских свинок 40, голубей 37, мышей 35, крыс 33 кгс/см2. Симптомы наркотического действия: расстройство координации, общее возбуждение, автоматизм движений, снижение реактивности и, наконец, развитие наркоза (Чжан Чунь). В случаях успешной декомпрессии последействие N2 сказывается у животных в течение 1-2 дней в виде резких двигательных расстройств.
Человек. При давлении воздуха 4 км/см2 (т. е. при давлении N2 3,2 км/см2) отмечались смешливость и болтливость, замедление реакции на зрительные, слуховые, обонятельные раздражения, на прикосновение, ослабление умственной деятельности. При 10 кгс/см2 (давление N2 8 кгс/см2) резкое расстройство мышечных движений. Водолаз после 5 мин пребывания на глубине 100 м (давление N2 8 кгс/см2) жаловался на головокружение, цветные круги перед глазами, возбуждение, как бы опьянение, помутнение сознания, расстройство координации движений. На глубине свыше 100 м наркотическое действие N2 уже не дает водолазу возможности работать. При повышенном давлении (кессонные, водолазные работы) N2 воздуха растворяется в крови и тканях тела и, выделяясь из них в виде пузырьков при быстрой декомпрессии, вызывает «декомпрессионные» заболевания, или «кессонную болезнь» (Якобсон).
Индивидуальная защита. Меры предупреждения. При работе с жидким N2 защитные перчатки, очки; вентиляция помещений, обеспечение безопасного транспорта. При водолазных работах применение гелия вместо N2, смеси Не и О3 вместо воздуха.
Аммиак
NH3 M=17,03
Встречается при очистке воды, керосина и некоторых минеральных масел; на сахарных заводах; при дублении кожи; в воздухе помещений, где стоит скот; входит в состав клоачных газов (вместе с сероводородом); содержится в неочищенном ацетилене.
Применяется для производства азотной кислоты, нитрата и сульфата аммония, жидких удобрений (аммиакатов), мочевины, соды, в органическом синтезе, при крашении тканей, светокопировании (на диазониевой бумаге), в качестве хладагента в холодильниках, при серебрении зеркал.
Получается прямым синтезом из газообразных водорода и азота при давлении обычно 280-350 ат и 450-500° (в присутствии катализаторов). В меньших количествах получается при коксовании каменного угля перегонкой с известью «аммиачной воды» (первая фракция при сухой перегонке угля).
Физические и химические свойства. Бесцветный газ с удушливым резким запахом (порог восприятия 0,037 мг/л) и едким вкусом. Т. плавл. -77,75°; т. кип. -33,35°; плоти. 0,771 г/л (0°), 0,59 г/л (25°). Раств. в воде около 750г/л, или 526 г/л; коэфф. раств. в воде 762,6. Растворим в эфире и других органических растворителях. Пределы взрывоопасных концентраций в воздухе 15- 28%, в кислороде 13,5--79%, в закиси азота 2,2-72%. На воздухе NH3 быстро переходит в (NH4)2CO3 или поглощается влагой. При обычной температуре устойчив. Весьма реакционноспособен, вступает в реакции присоединения, замещения и окисления. Водный раствор, имеет щелочную реакцию вследствие образования гидрата окиси аммония NH*H. В продажу поступает в виде водных растворов, содержащих 28-29% (объемн.) NH3, 10% раствора NH3 (нашатырный спирт) или сжиженного NH3 в стальных цилиндрах.
Острое отравление. Животные. Сильное раздражение верхних дыхательных путей, конъюнктивы и роговицы глаз; изо рта и носа выделения пенистой жидкости, иногда с примесью крови. Нарушение свертываемости крови в результате прямого действия на протромбин, повышение содержания остаточного N2 в крови за счет быстрого- накопления в ней NH3; лейкоцитоз, увеличение содержания общего белка и сахара. При еще больших концентрациях обнаруживается прижигающее действие на слизистые оболочки верхних дыхательных путей и рта, возможен отек легких. Рефлекторно вызываемые остановки дыхания и кровообращения могут привести к смерти. На вскрытии - признаки отека легких, кровоизлияния под плеврой. Окись углерода потенцирует действие NH3.
Пороговая концентрация, вызывающая при 2-часовой экспозиции у белых мышей изменения активности холинэстеразы и каталазы в крови, 0,01 мг/л; изменение нервно-мышечной возбудимости - 0,03 мг/л. Пороговая концентрация по . изменению нервно-мышечной возбудимости для белых крыс 0,085 мг/л. У белых крыс, морских свинок, кроликов и кошек легкое раздражение замечается при 4-часовом воздействии около 0,35 мг/л; 3,5-5 мг/л при воздействии 1,5-4 ч опасны для жизни или ведут к воспалению легких. Концентрация 7,0 мг/л при воздействии до 3,5 ч приводит к смерти. При концентрациях свыше 14 мг/л - быстрая смерть. Абсолютно смертельная концентрация для мышей при 2-часовой экспозиции 6 мг/л, ЛК50= 4,6 мг/л. Для крыс ЛК50=18,6 мг/л (при экспозиции 5 мин), 12,1 мг/л (15 мин), 7,04 мг/л (30 мин) и 7,87 мг/л (60 мин). При накожных аппликациях для крыс ЛК5о= 112 мг/л (экспозиция 15 мин), 71.9мг/л (30 мин) и 48,4 мг/л (60 мин).
Человек. Высокие концентрации вызывают обильное слезотечение и боль в глазах, удушье, сильные приступы кашля, головокружение, боли в желудке, рвоту, задержку мочи. Тяжелое отравление протекает на фоне резкого уменьшения легочной вентиляции, острой эмфиземы, увеличения печени, ацидоза, повышения глутаминоксалатной и глутамнипируватной активности. По данным Bittersohl, уже через несколько минут после массивного воздействия NH3 наступает мышечная слабость с повышенной рефлекторной возбудимостью, тетанические судороги; резко снижается порог слуха, вследствие чего сильный звук вызывает новый приступ судорог. Нарушается обмен глутаминовой и кетоглутаровой кислот в коре головного мозга, значительно уменьшается способность тканей утилизировать кислород; NH3 обладает также курареподобным действием. После действия очень высоких концентраций пострадавшие иногда сильно возбуждены, находятся в состоянии буйного бреда, не способны стоять. Наблюдаются резкие расстройства дыхания и кровообращения; в ближайшие часы (иногда и в первые минуты) после отравления может наступить смерть от сердечной слабости или остановки дыхания в фазе вдоха при спазме голосовой щели (рефлекс тройничного нерва). Чаще смерть наступает через несколько часов или дней после несчастного случая от отека гортани или легких. В ряде случаев причиной гибели является воспаление бронхов и легких. Возможен химический ожог глаз и верхних дыхательных путей . На вскрытий людей, погибших на 2 день после острого отравления, обнаружен, помимо отека легких, некроз слизистой оболочки мелких бронхов; у погибших на 4 и 14 день - множественные абсцессы легких и межуточный нефрит.
Последствиями перенесенного острого отравления могут быть помутнение хрусталика, роговицы, даже ее прободение и потеря глаза; охриплость или полная потеря голоса, хронический бронхит, эмфизема легких, бронхоэктазы, субатрофический фаринголарингит; кровохарканье; возможна активизация туберкулезного процесса. Dupuy et al. обнаружили у рабочего, перенесшего острое отравление, тяжелый геморрагический гастрит. После отравления с потерей сознания в дальнейшем отмечались изменения личности, снижение интеллектуального уровня с выпадением памяти, неврологические микросимптомы (тремор рук, нарушение равновесия, тики, понижение тактильной и болевой чувствительности); головокружения, нистагм, гиперрефлексия. При небольших концентрациях - более легкое раздражение глаз и слизистой носа, чихание, слюнотечение, легкая тошнота и головная боль, покраснение лица, потливость, боль в груди, позывы на мочеиспускание.
Порог обонятельного ощущения (в мг/л) 0,00050-0,00055: минимально действующая концентрация 0,00045; минимальная концентрация, вызывающая изменение биопотенциалов головного мозга, 0,00035. По данным Алпатова, 0,01 мг/л не вызывает изменений электрической активности мозга, дыхания и кожно-гальванического рефлекса. При концентрациях 0,04-0,08мг/л резкое раздражение глаз, верхних дыхательных путей, вплоть до рефлекторной задержки дыхания, головная боль. Вдыхание 0,003 мг/л в течение 8 ч вызывает тенденцию к уменьшению утилизации кислорода и замедление пульса. При кратковременном вдыхании (в мг/л) 0,07-0,1 раздражение в носу и в полости рта, при 0,49 - раздражение глаз, при 1,2 - кашель, диспноэ, возможен отек легких 0,25 мг/л можно выдержать, хотя и с трудом, в течение часа. По другим данным, работа возможна при 0,07-0,14 мг/л NH3, затруднительна при 0,14-0,21 мг/л, невозможна при 0,35-0,7 мг/л, причем последние концентрации могут оказаться опасными для жизни.
Хроническое отравление. Животные. Кролики, кошки и собаки привыкают к NH3 и потому могут месяцами выдерживать ежедневное вдыхание (по 8 ч) 0,7-1,0 мг/л . Но при концентрациях 1 мг/л морские свинки и кролики погибали через 4-10 дней. На вскрытии - гнойное воспаление дыхательного горла и бронхов, воспаление легких, иногда геморрагическое, фибринозный или гнойный плеврит. Непрерывное в течение 30 дней вдыхание 0,47 мг/л сопровождалось раздражением слизистых оболочек глаз и -верхних дыхательных путей, а также кровоизлияниями в легких и жировой дистрофии печени у собак. Отравление морских свинок в течение 18 недель концентрациями 0,12 мг/л вызывало патологические изменения со стороны внутренних органов, особенно печени и селезенки. Круглосуточное отравление крыс в течение 84 дней или ежедневное (по 5-6 ч) в течение 7 месяцев 0,02 мг/л вызывает изменение функционального состояния нервной системы, угнетение активности холинэстеразы и окислительно-восстановительной функции крови, уменьшение содержания в крови и печени общего и свободного витамина В), повышение экскреции копропорфирина и аммиака с мочой. Концентрация 0,002 мг/л изменяла только окислительно-восстановительные функции крови, а 0,0002 мг/л оказалась недействующей.
Человек. Концентрации 0,0008-0,0036 и 0,0002-0,016 мг/л при транспортировке жидкого NH3 на морских судах вызывали у моряков жалобы на снижение трудоспособности, головные боли, плохой сон и аппетит, повышенную раздражительность. Объективно зарегистрированы значительные сдвиги высшей нервной деятельности, тенденция к гипотонии, тахикардия, эозинопения, снижение фагоцитарной активности лейкоцитов, активности пропердиновой системы крови и титра комплемента; сначала стимуляция (при стаже до года), позже угнетение (при стаже более года) гемопоэза. У рабочих химических заводов выявлены (при 0,0005-0,024 мг/л) аносмия или гипосмия, неврастения, понижение биоэлектрической активности головного мозга, повышение активности глутаминопировиноградной трансаминазы и снижение уровня витамина С в крови, уменьшение выведения мочевины, увеличение потребности в витамине В1. Повышена заболеваемость катарами верхних дыхательных путей, ангинами, тонзилитами. Отмечены сдвиги в жировом и белковом обмене и учащение заболеваний катаром верхних дыхательных путей у подростков, проходящих практику на заводе, даже при 3-часовом рабочем дне и концентрациях, не превышающих предельно допустимые. Совместное действие NH3 и H2S вызывало у рабочих канализационной сети потерю обоняния, хронические катары носа, носоглотки и бронхов.
Действие на кожу. При концентрации 1% (объемн.)-7 мг/л - наблюдается легкое раздражение влажной кожи, при 2% заметное раздражение, а 3% через несколько минут могут вызвать ожог с образованием пузырей. При попадании в струю газа, например при авариях с аммиачными холодильными машинами, могут, наряду с проявлениями общего отравления, наблюдаться краснота кожи, отек, отдельные фиолетово-красные пятна с фестончатыми, хорошо очерченными краями, напряженные серозные пузыри на воспаленном фоне размером с гусиное яйцо, нарушение целостности поверхностных слоев кожи, резко очерченные, мокнущие, с желтоватой окраской дефекты кожи. У лаборантов, имеющих контакт с NH3, Цыркунов наблюдал дерматит с гиперемией, пузырьками, папулами и шелушением на боковых по-
верхностях пальцев рук. Morris сообщает о крапивнице у двух рабочих, развившейся через час после того, как они покидали помещение, где в воздухе был NH3. Нашатырный спирт действует на кожу слабее других щелочей, но все .же может вызвать сильную боль, покраснение и - при более длительном воздействии - образование пузырей. Попадание его в глаза может привести к полной слепоте.
Неотложная терапия. При попадании брызг NH4OH в глаза немедленно обильное промывание широко раскрытого глаза водой или 0,5-1% раствором квасцов; вазелиновое или оливковое масло. При резких болях - 1-2 капли 1% раствора новокаина или 1 капля 0,5% раствора диканна с адреналином (1:1000). Надеть очки-консервы. В последующем применяют закапывание 0,1% раствора ZnSO4, 1% раствора Навоз или 30% раствора альбуцида. При поражении кожи - обмывание чистой водой, наполнение примочки из 5% раствора уксусной, лимонной, виннокаменной или, соляной кислот. При отравлении NH3 через дыхательные пути - свежий воздух, вдыхание теплых водяных паров (лучше с добавлением уксуса или нескольких кристаллов лимонной кислоты), 10% раствора ментола в хлороформе. Пить теплое молоко с боржомом или содой. Кодеин (по 0,015 г) или дионин (по 0,01 г). При удушье-кислород (вдыхать до уменьшения одышки или цианоза); при спазме голосовой щели- тепло на область шеи, теплые водные ингаляции, атропин (подкожно. 1 млО,1% раствора), при необходимости - трахеотомия. При нарушениях или остановке дыхания - искусственное дыхание. По показаниям - камфара, кофеин, кордиамин, коразол, успокаивающие средства (настойка валерьяны, бромиды). Лечение развивающегося отека легких.
Распределение в организме. В дыхательных путях у собаки определялось. 75-80%. В крови здоровых людей содержится 0,05-0,90 мкг/мл плазмы крови.
Предельно допустимая концентрация 20 мг/м3.
Индивидуальная защита. Меры предупреждения. Промышленный противогаз КД. Время защитного действия при концентрации NH3 2,3 мг/л 240 мин, для противогаза КД с фильтром 120 мин. При отсутствии в воздухе органических веществ возможно использование противогаза марки М с защитным временем 90 мин. Противогазы должны сменяться немедленно при ощущении самого слабого запаха. Защитные очки марки ПО-3 и др. Перчатки из щелочестойкой резины. Спецодежда из плотной ткани. Герметизация всей аппаратуры, коммуникаций, транспорта самого NH3, аммиачной воды и т. д. Местная н общая вентиляция рабочих помещений, где возможно образование н выделение в воздух NH3. Меры предосторожности при получении NH3 путем синтеза из азота и водорода или с использованием природного газа см. у Косоурова, при использовании в качестве удобрения см. «Правила и нормы техники безопасности и пром. санитарии для проектирования, строительства, эксплуатации и производства углеаммонийных солей (водного аммиака и др.)
Рекомендуется периодическое обследование верхних дыхательных путей работающих с NH3, организация ингаляториев, включение в ежедневный рацион работающих с NH3 160 мг витамина С, 2,5 мг витамина B1 и 1 г глутаминовой кислоты.
Определение в воздухе основано на образовании окрашенного в желто- бурый цвет иодида димеркураммония при взаимодействии NH3 с реактивом Несслера. Чувствительность 1 мкг в анализируемом объеме. Определению мешают аммонийные соли, сероводород, альдегиды и некоторые амины жирного ряда. Другой метод основан на образовании окрашенного в синий цвет индофенола при взаимодействии NH3 с гюпохлоритом и фенолом в присутствии нитропруссида натрия. Чувствительность 0,1 мкг в анализируемом объеме.
Нитрит натрия
NaNO2 М = 69,00
Применяется в производстве органических красителей; в пищевой промышленности; для пассивирования стальных изделий; в резиновой и текстильной промышленности, в гальванотехнике.
Получается абсорбцией раствором соды нитрозных газов производства азотной кислоты и очисткой, упариванием и кристаллизацией полученной емки нитрита и нитрата натрия.
Физические и химические свойства. Бесцветные или желтоватые кристаллы. Т. плавл. 271°; плоти. 2,17: выше 320° разл., не доходя до кипения; раств. в воде 81,8 г/ЮО г (20°). 163 г/ЮО г *О').
Токсическое действие. Вызывает расширение сосудов вследствие пареза сосуда - двигательного центра (при больших дозах - и вследствие непосредственного действия на кровеносные сосуды), а также образование в крови метгемоглобина.
Животные. При вдыхании белыми крысами аэрозоля в течение 4 ч ЛК100=0,0079 мг/л, ЛК50=0,0055 мг/л, пороговая (по действию на активность каталазы крови и фосфатазы нейтрофилов)-0,0012 мг/л. Молодые животные более чувствительны. Повторное воздействие аэрозоля (0.000Змг/л, 4 ч ежедневно, 30 дней) снижает активность каталазы и повышает активность щелочной фосфатазы в нейтрофилах крыс, начиная со 2 недели опытов; отмечена также адинамия и цианоз кожных покровов; молодые животные отставали в росте. Хроническое отравление (0,000125 мг/л, 4 ч ежедневно, 5 месяцев) изменяет порог нервно-мышечной возбудимости крыс, повышает активность щелочной фосфатазы; 0,000025 мг/л не изменяет этих показателей. Воздействие небольших доз может привести к образованию канцерогенных нитрозаминов.
Человек. Прием 3 г вызывал головокружение, рвоты, бессознательное состояние. В крови при этом - тельца Гейнца. Описаны случаи тяжелой метгемоглобинсмии у детей при использовании колодезной воды с высоким содержанием нитритов, но возможно и бессимптомное течение нитритной метгемоглобинемни. Рабочие, имеющие контакт со смазочно-охлаждающими жидкостями, содержащими 3% NaNO2, жалуются на слабость, быструю утомляемость, головные боли, плохой аппетит и сон, тянущие боли в конечностях и суставах. По данным Мадорского и Воронина, сходная картина наблюдается при работе с жидкостью, состоящей из смеси 0,3% NaNО2 и 1% раствора триэтанол- амина (в зоне дыхания рабочих 0,0009-0,0015 мг/л NaNO2). Головная боль, появляющаяся обычно через 3-5 месяцев после начала работы, локализуется преимущественно в височной области; рабочие жалуются также на боли в области сердца и онемение пальцев рук. При обследовании-сосудистая дистония, главным образом периферических и церебральных сосудов, заметное отижотие височно-плечевого коэффициента, ангиоспазмы (симптом «белого пальца»), снижение умственной работоспособности, ослабление нервных процессов, признаки атрофии слизистой оболочки носоглотки, небольшое снижение содержания гемоглобина, эритроцитов и тромбоцитов, смещение кислотно-щелочного равновесия в сторону щелочности. У подростков, работающих при 0,000023-0,000049 мг/л, - преходящее повышение кровяного давления, незначительное возбуждение центральной нервной системы, замедление восстановления пульса и кровяного давления после дозированной физической нагрузки.
Действие на кожу. Многократные аппликации 0,5-10% водных растворов на кожу морских свинок и белых мышей (60 дней) раздражения и сенсибилизации не вызывают. Однако после повторного смачивания кожи на лапках морских свинок (3% раствор, 8 ч ежедневно) часть животных погибаем. На вскрытии - кровоизлияния в миокарде, селезенке, печени, легких и мозге, что характерно для отравления метгемоглобино - образователями.
У рабочих отмечают пожелтение кожи на ладонях, гиперемию, цианоз и отечность кистей рук, а иногда и тыла стоп; шелушение, трещины, пузырьковые высыпания, ломкость ногтей; значительные изменения капилляров.
Превращения в организме и выделение. Нитриты находятся в виде следов в организме здорового человека; они обнаружены в слюне, слизи из носа, бронхов, в слюнных железах, легочной ткани, почках, белом веществе мозга, лимфатических железах. Малые количества нитритов в организме человека окисляются в нитраты; только при введении больших доз нитритов последние появляются в моче. Предполагается, что в организме образуются также нитрозамины.
Предельно допустимая концентрация. Рекомендуется 0,05 мг/м3 в виде аэрозоля.
Индивидуальная защита. Меры предупреждения. Защита кожи рук. Замена NaNO2 при использовании в качестве антикоррозионного покрытия и в охлаждающих ваннах при обработке металлов. В случаях невозможности замен» - снижение концентрации NaNO2 в растворах до 1,5% и ниже. Исключение прямого контакта работающих с NaNО2 и его растворами. Местные укрытия и вытяжные устройства над ваннами с растворами. Контроль за концентрацией аэрозоля NaNO2 в воздухе рабочей зоны.
Определение в крови можно выполнять с помощью автоматического анализатора. Кровь подвергают диализу. В диализате проводят диазотирование нитритов сульфаниловой кислотой, а затем реакцию с N-(1-нафтилэтилендиамином).
Нитрит калия
KNO2 M=85,ll
Применяется в производстве азокрасителей н некоторых органических соединений.
Получается восстановлением расплавленного KNО2 свинцом; пропусканием SO2 через нагретую смесь KNO3 и СаО.
Физические и химические свойства. Бесцветные или желтоватые кристаллы, расплывающиеся на воздухе. Т. плавл. 387°; плоти. 1,915; раств. в воде 280 г/100г (0°); 413 г/100 г (100°).
Токсическое действие, по-видимому, сходно с действием NaNO2.
Животные. Хроническое воздействие (с питьевой водой в дозе 4 г/л в течение 100-240 дней) вызывает у морских свинок снижение рождаемости; при 5-10 г/л потомство не появлялось, часть самок погибала, на вскрытии - дистрофические изменения плаценты, воспалительные изменения шейки матки.
Человек. 0,1 г при приеме внутрь вызывает у человека покраснение лица, учащение пульса, понижение кровяного давления, шум в голове. Дозы 0,3-0,5 г вызывают, кроме того, желудочно-кишечные расстройства, обильное отделение пота, синюху, одышку, головокружение, сонливость, преходящие расстройства зрения.
Нитрат натрия
(Натриевая селитра, чилийская селитра)
NaNO3 М = 84.99
Применяется как удобрение; в пищевой, стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей.
Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
Физические и химические свойства. Бесцветные кристаллы. Т. плавл. 309,5°; плоти. 2,257; разл. при 380°на нитрит и кислород; раств. в воде 88 г/100 г (20°), 176 г/100 г (100°).
Токсическое действие.
Животные. При добавлении в корм кроликам 0,5-1,0 г/кг NaNO3 через несколько дней увеличенное отделение мочи, усиленное выделение продуктов азотистого обмена с мочой. При более длительных опытах - также пониженный аппетит, исхудание, понос. Добавление к обычному корму кроликов и крыс NaNO3 вызывало повышенное содержание в крови метгемоглобина; у крыс введение в желудок в течение 30 дней по 40,8 мг/кг снижало активность пищеварительных ферментов - кишечной щелочной фосфатазы, энтерокиназы и панкреатической липазы.
Человек. У рабочих, занятых добычей селитры на севере Чили, примерно через год появлялись (главным образом, на ладонях и подошвах ног) утолщения кожи, достигавшие 1,3 см в диаметре и болезненные при надавливании. В ряде случаев, даже если рабочий давно оставил работу, через 12-15 лет эти утолщения превращались в раковые опухоли.
Способность нитратов восстанавливаться в организме в нитриты часто приводит к образованию метгемоглобнна. При употреблении в пищу воды, содержащей 50-100 мг/л нитратов, резко увеличивается число лиц с повышенным содержанием метгемоглобина в крови. Особенно страдают дети. Описано много смертельных отравлений грудных детей; при 20-40 мг/л содержание метремоглобина у детей может возрастать до 5% и выше.
Нитрат калия
(Калийная селитра)
KNO3 М=101,ll
Применяется как удобрение, а также в производстве порохов, в пиротехнике, в пищевой и стекольной промышленности. Получается конверсией NaNO3 и KCl при 80-122°С.
Физические и химические свойства. Бесцветные кристаллы. Т. плавл. 334°; плоти. 2,11; разл. выше 338° на нитрит н кислород; раств. в воде 31,5 г/100 г (20°), 245 г/100 г (100°).
Токсическое действие.
Животные. При введении в желудок белым крысам смеси калийной и . аммиачной селитры (10 и 100 мг/л) через 10 дней отмечена метгемоглобинемия, отставание в росте, нарушение эмбриогенеза; у морских свинок способность к воспроизведению потомства нарушалась при больших дозах Н. К.
Человек. В производстве черного пороха (смесь селитры, серый угля) у рабочих наблюдались изъязвления слизистой носа и даже прободение носовой перегородки уже после нескольких месяцев работы. см. также Нитрат натрия.
Нитрат кальция
(Кальциевая селитра, норвежская селитра)
Ca(NO3)2 М=164.09
Применяется как удобрение.
Получается на основе нитрозных газов производства азотной кислоты.
Физические и химические свойства. Т. плаил. 561°; разл. при 500°; плота. 2,36; растя, в воде 126 г/ЮО г (20°), 363 г/ЮО г (100°). Безводная соль и кристаллогидраты очень гигроскопичны.
Токсическое действие. Имеет значение лишь раздражающее и прижигающее действие технического продукта, выражающееся в покраснении кожи, зуде, изъязвлениях, иногда глубоких и занимающих обширную поверхность, медленно заживающих и оставляющих большие рубцы. Поражаются участки кожи, на которых имеются хотя бы незначительные ранки, царапины и другие нарушения ее целостности.
Индивидуальная защита.
Меры предупреждения. Мытье после работы, применение защитных мазей типа мази ХИОТ и других ожиряющих смазок. Защитные перчатки.
Похожие работы
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... в процессе его производства. Первая стадия производства титана заключается в рудно-восстановительной плавке, которая проводится с целью обогащения исходного материала окисными соединениями титана. Во всех последующих стадиях производства взаимодействие титана и его соединений с кислородом нежелательно. Титан растворяет такие элементы, как азот, водород и углерод. С последним он образует стойкие ...
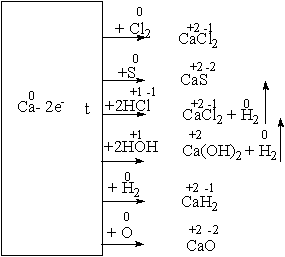
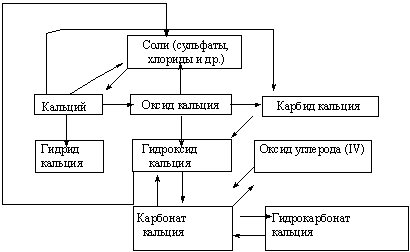
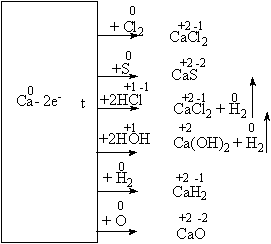
... среды. 3.1 Урок по теме «Кальций и его соединения» в 9-ом классе с. Карасу, позволяющий развить экологическое сознание школьников Цель урока: познакомить учащихся с основными способами получения кальция и его соединений, возможностями применения соединений кальция, показать необходимость контроля содержания ионов кальция и магния в питьевых и сточных водах и обозначить значимость кальция ...
... разделам школьной программе по химии, тем более, что в учебнике этот материал, по-моему, незаслуженно отсутствует. Данная работа посвящена изучению основных физических и химических свойств хрома и его соединений, позволяет оценить важность этого химического элемента. 1.Исторические сведения В 1766 году петербургский профессор химии И.Г.Леман описал новый минерал, найденный на Урале на ...

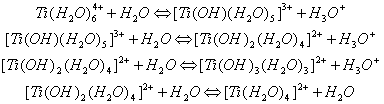
0 комментариев