Навигация
ОПРЕДЕЛЕНИЕ НЕМЕТАЛЛИЧЕСКИХ ЭЛЕМЕНТО6
7. ОПРЕДЕЛЕНИЕ НЕМЕТАЛЛИЧЕСКИХ ЭЛЕМЕНТО6
И ИХ ИОНОВ
7.1. АММОНИЙНЫЕ ИОНЫ И АММИАК
При относительно высоком содержании аммонийных ионов или аммиака, превышающем 10 мг/л, рекомендуется титриметрический метод определения с предварительной отгонкой аммиака в раствор борной кислоты. Следует учитывать, что если отгонку проводить из сильнощелочного раствора, то при этом возможен гидролиз некоторых азотсодержащих органических веществ с образованием аммиака. Поэтому отгонку надо вести при соответствующем рН исходного раствора.
При низком содержании NH+4 и NH3, когда отсутствуют мешающие вещества, можно отгонку не проводить, но она все же обязательна при наличии мути, сильно окрашенных в растворе веществ, кислотности, превышающей 100 мг/л, и щелочности, превышающей 500 мг/л. Из приведенных фотометрических методов на первое место следует поставить фенольно-гипохлоритный метод, поскольку применимость его значительно меньше зависит от присутствия мешающих веществ. Все нейтральные летучие соединения, которые могли бы помешать определению, например альдегиды, кетоны, спирты, рекомендуется предварительно удалить подкислением пробы и отгонкой. Одновременно удалится и сероводород, сильно мешающий определению. Последний можно также удалить введением небольшого количества карбоната свинца перед отгонкой аммиака из слабощелочной среды.
7.1.1. Предварительная отгонка
Предварительную отгонку аммиака рекомендуется проводить при pH=9.5 (если предполагается присутствие цианатов, а также большинства азотсодержащих органических соединений, при рН = 7,4 (когда предполагается присутствие карбамида) и из сильнощелочной среды (если анализируют сточные воды, содержащие большие количества фенолов-сточные воды коксохимических заводов, газогенераторных предприятий и др.). Если наряду с фенолами присутствуют вещества, гидролизующиеся в щелочной среде, то отгонку надо провести дважды: сначала при рН = 7,4, собирая отгон в разбавленный раствор сильной кислоты, потом подщелочив этот отгон до сильнощелочной реакции.
Поглотителем аммиака служит раствор борной кислоты, когда определение заканчивают титрованием или фотометрическим методом с реактивом Несслера. При применении фенол-гипохлоритного метода отогнанный аммиак поглощают раствором серной кислоты. Отгонку проводят из круглодонной колбы вместим мастью от 800 до 2000 мл с вертикальным холодильником, конец которого (или форштосс) надо погрузить в раствор кислоты, нахолящейся в приемнике.
Реактивы
Боратный буферный раствор), рН = 9,5. К 500 мл 0,025 М раствора тетрабората натрия содержащего 9,5 г/л Na2B4O7 10H2O) приливают 88 мл 0,1 н. раствора NaOH и разбавляют безаммиачной водой до 1 л.
Фосфатный буферный раствор, рН = 7,4. В дистиллированной воде, не содержащей аммиака и аммонийных солей, растворяют 14,3 г безводного KH2PO4 и 68,8 г безводного К2НРО4 и разбавляют такой же водой до 1 л.
Дехлорирующий раствор, 1 мл одного из нижеследующих растворов может восстановить до 1 мг/л остаточного хлора в 500 мл пробы.
Арсенат натрия, 1 г NaAsO2 растворяют в безаммиачной воде и разбавляют до 1 л.
Сульфит натрия, 0,9 г Na2SO3 растворяют в безаммиачной воде н разбавляют до 1 л.
Тиосульфат натрия, 3,5 г Na2S2O3 5H2O растворяют в безаммиачной воде и разбавляют до 1 л.
Поглощающий раствор. Растворяют 40 г Н3ВО3 в безаммиачной воде и разбавляют такой же водой до 1 л. При определении фенолгипохлоритным методом поглощающим раствором служат 40 мл 0,2 н. 1-12504 или НС1.
Ход отгонки. Отгонку следует проводить в комнате, воздух которой не содержит аммиака. В колбу для отгонки вместимостью 800-1000 мл помещают 400 мл анализируемой сточной воды (или меньший объем, разбавленный до 400 мл безаммиачной водой), Если проба содержит «активный хлор», ее предварительно дехлорируют добавлением эквивалентного количества одного из перечисленных выше дехлорирующих реагентов. Нейтрализуют, если надо, пробу до рН = 7 разбавленной кислотой или щелочью, определив необходимое количество титрованием отдельной порции. Затем приливают 25 мл буферного раствора (pH=9.5 или 7,4 в зависимости от предполагаемых загрязнений) или 20 мл раствора едкого натра при анализе фенольных вод. В приемник наливают 50 мл поглощающего раствора. Отгоняют 300 мл жидкости, количественно переносят отгон в мерную колбу вместимостью 500 мл, разбавляют до метки безаммиачной дистиллированной водой и перемешивают.
7.1.2. Титриметрический метод
Реактивы
Бромфеноловый синий. В 3,00 мл 0,05 н. раствора едкого натра растворяют 0,1 г бромфенолового синего и разбавляют до 100 мл дистиллрованной водой.
Метиловый красный. В 7,4 мл 0,05 н. раствора едкого натра растворяют 0,1 г метилового красного и разбавляют до 100 мл дистиллированной водой.
Стандартный раствор серной кислоты, 0,02 н.; 1 мл этой кислоты соответствует 0,28 мг аммонийного азота, 0,36 мг NH+4, 0,34 мг NH3.
Ход анализа. К аликвотной части полученного после перегонки раствора (или ко всему раствору, не разбавляя его в мерной f колбе) прибавляют несколько капель того или другого индикатора и титруют 0,02 н. раствором серной кислоты до изменения окраски индикатора. В качестве раствора-свидетеля используют дистиллированную воду, освобожденную от СО2 кипячением, прибавляют те же количества раствора борной кислоты и индикатора. Проводят холостой опыт со всеми примененными в анализа реактивами.
Расчет. Содержание аммонийных ионов (х) в мг/л находят по формуле
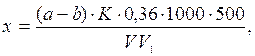 если отбирали аликвотную часть
если отбирали аликвотную часть
 если титровали весь отгон
если титровали весь отгон
где а - объем 0,02 н. серной кислоты, израсходованной на титрование пробы, мл; b - объем той же кислоты, израсходованной в холостом опыте, мл; К - поправочный коэффициент для приведения концентрации серной кислоты к точно 0,02 н.; V - объем сточной воды, взятой для анализа, мл, V1 - объем отобранной аликвотной части; 500 - вместимость мерной колбы, мл; 0,36 - количество NH+4, эквивалентное 1 мл точно 0,02 н. серной кислоты, мг.
Похожие работы
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... в процессе его производства. Первая стадия производства титана заключается в рудно-восстановительной плавке, которая проводится с целью обогащения исходного материала окисными соединениями титана. Во всех последующих стадиях производства взаимодействие титана и его соединений с кислородом нежелательно. Титан растворяет такие элементы, как азот, водород и углерод. С последним он образует стойкие ...
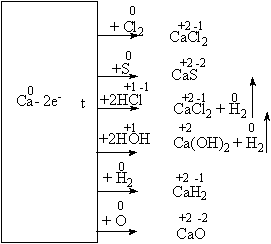
... среды. 3.1 Урок по теме «Кальций и его соединения» в 9-ом классе с. Карасу, позволяющий развить экологическое сознание школьников Цель урока: познакомить учащихся с основными способами получения кальция и его соединений, возможностями применения соединений кальция, показать необходимость контроля содержания ионов кальция и магния в питьевых и сточных водах и обозначить значимость кальция ...
... разделам школьной программе по химии, тем более, что в учебнике этот материал, по-моему, незаслуженно отсутствует. Данная работа посвящена изучению основных физических и химических свойств хрома и его соединений, позволяет оценить важность этого химического элемента. 1.Исторические сведения В 1766 году петербургский профессор химии И.Г.Леман описал новый минерал, найденный на Урале на ...

0 комментариев