Навигация
Основные принципы распределения электронов в атоме
2.1.6. Основные принципы распределения электронов в атоме.
Рассмотренная электронная оболочка атома заполняется электронами в соответствии трем принципам: принципу наименьшей энергии, принципу Паули /правилу/ Гунда.
Принципу наименьшей гласит, что электрон в атоме занимает тот свободный подуровень, на котором он будут иметь минимальное значение энергии. По другому, электрон остается на том подуровне, на котором обеспечивается наиболее прочная связь с ядром.
Последовательность заполнения подуровней соответствует приведенному выше фактическому расположению подуровней в структуре электронной оболочки атома:
1s2s2p3s3p4s3d –… и т.д. /см. выше/.
Принцип Паули /запрет Паули/ говорит о том, что в атоме не может быть даже двух электронов с одинаковыми значениями четырех квантовых чисел.
Следствие. На орбитале может находится два электрона с различными спинами (т.е. с различными значениями спинового квантового числа: ms = +1/2 и ms = –1/2).
Третий принцип – это принцип или правило Гунда /Хунда/. Он объясняет порядок заполнения электронами квантового подуровня. В пределах подуровня электроны распределяются так, что их суммарное квантовое число имело максимальное значение /сначала по одному электрону на орбиталь, а затем спаривание/. Правильным будет распределение, например, трех р-электронов таким образом:
|
|
В зависимости от того, какой подуровень заполняется последними электронами, различают s-, p-, d-, f-элементы.
s-элементами называют такие элементы, в атомах которых последние электроны занимают s-подуровень внешнего квантового уровня. /Например, натрий, магний, калий, кальций и др./.
р-элементами называют такие элементы, в атомах которых последние электроны занимают р-подуровень внешнего квантового уровня. /Например, углерод, кислород, хлор и др./.
d-подуровень, заполняемый последними электронами, относит элементы к d-элементам. /Например, d-элементами являются титан, хром, железо, медь, т.к. у этих элементов последние электроны занимают d-подуровень предпоследнего уровня/.
f-элементами называют такие элементы, в атомах которых последние электроны занимают f-подуровень второго от вне квантового уровня. /Например, празеодим, европий, эрбий и др./.
2.1.7. Изображение электронной структуры атомов при помощи электронных формул и квантовых ячеек.
Электронную структуру любого атома изображают электронными формулами. В электронных формулах квантовый электронный уровень обозначают численным значением главного квантового числа n, подуровень записывают буквенным обозначением соответствующего подуровня, а число электронов на подуровне указывают степенью, стоящей у обозначения подуровня. Например, 3d5 обозначает, что на d-подуровне 3-го квантового уровня находится пять электронов. Электронная формула любого элемента состоит из полного набора таких фрагментов, как указано в примере. Так, электронная формула атома титана /№22/ имеет вид: 1s22s22p63s23p64s23d2. Cумма всех степеней равна 22, это значит, что атом титана, имея заряд ядра +22, содержит на электронной оболочке 22 электрона, которые своим суммарным отрицательным зарядом (–22) компенсируют положительный заряд ядра атома, делая атом сложной электронейтральной системой.
Электронные формулы удобнее составлять после рассмотрения структуры периодической системы элементов Д.И.Менделеева. Забегая вперед и основываясь на знаниях, полученных в средней школе, представим периодическую систему элементов в виде электронных формул. (рис.2.10.) О написании электронных формул конкретного элемента, находящегося в периодической системе, вернемся позже и рассмотрим алгоритм по которому легко научиться писать электронную формулу любого элемента. Во-вторых, структуру электронной оболочки атома изображают при помощи квантовых ячеек.
I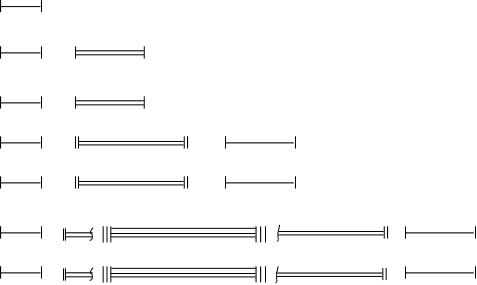
 1s2
1s2II 2s2 2p6
III 3s2 3p6
IV 4s2 3d10 4p6
V 5s2 4d10 5p6
VI 6s2 5d1 4f14 5d9 6p6
VII 7s2 6d1 5f14 6d9 7p6
рис.2.10.
![]()
![]() Квантовыми
ячейками мы
уже пользовались
хотя и не вводили
понятие “квантовая
ячейка”. Квантовая
ячейка – это
не что иное как
графическое
изображение
орбитали. Ее
показывают
клеточкой ,
а электроны на орбитали
изображают
стрелкой, стоящей
в клеточке . Для s-подуровня
отведена одна
клеточка, так
как s-подуровень
имеет только
одну орбиталь.
Для р-подуровня
выделено три
ячейки ибо
р-подуровень
содержит три
р-орбитали.
d-подуровень
изображают
пятью ячейками,
а f-подуровень
– семью ячейками.
Квантовыми
ячейками мы
уже пользовались
хотя и не вводили
понятие “квантовая
ячейка”. Квантовая
ячейка – это
не что иное как
графическое
изображение
орбитали. Ее
показывают
клеточкой ,
а электроны на орбитали
изображают
стрелкой, стоящей
в клеточке . Для s-подуровня
отведена одна
клеточка, так
как s-подуровень
имеет только
одну орбиталь.
Для р-подуровня
выделено три
ячейки ибо
р-подуровень
содержит три
р-орбитали.
d-подуровень
изображают
пятью ячейками,
а f-подуровень
– семью ячейками.
Электронная структура атома титана, для которого мы уже писали электронную формулу, изображенная при помощи квантовых ячеек, выглядит так:
|
| ||||||||
| 4p | ||||||||
|
| 3d | |||||||
| 4 | ||||||||
|
| 3p | |||||||
| 3 | ||||||||
| 2p | ||||||||
| 2s | ||||||||
|
| ||||||||
| 1s | ||||||||
Похожие работы
... , как в общенаучном плане, так и прикладном плане. Это дает нам возможность проанализировать содержание данной темы в курсе химии средней школы. Глава 2. МЕТОДИКА ИЗУЧЕНИЯ КРИСТАЛЛОГИДРАТОВ В КУРСЕ ХИМИИ СРЕДНЕЙ ШКОЛЫ 2.1 Тема «Кристаллогидраты» в стандарте школьного образования Стандарт среднего (полного) общего образования по химии определяет собой обязательных минимум, который должен ...
... г. для химической лаборатории построено отдельное здание. При чтении лекций в это время профессора придерживаются большей частью руководств Теннара, Пайена, Розе, Пфаффа и Берцелиуса. Следовательно, новое направление химии в России было усвоено весьма скоро. К этому же времени относится и появление, кроме переводных, также и первых оригинальных руководств по химии на русском языке. В 1810 - 1813 ...
... поскольку ускорение химических реакций заметно влияет на снижение издержек производства. 9. Атомно-молекулярное учение Ведущей идеей атомно-молекулярного учения, составляющего фундамент современной физики, химии и естествознания, является идея дискретности (прерывности строения) вещества. Вещество не заполняет целиком занимаемое им пространство, оно состоит из отдельных, находящихся на очень ...
... и т.д. Человек начал применять лекарственные вещества очень давно, несколько тысяч лет назад. Древняя медицина практически полностью основывалась на лекарственных растениях, и этот подход сохранил свою привлекательность до наших дней. Множество современных лекарственных препаратов содержат вещества растительного происхождения или химически синтезированные соединения, идентичные тем, которые можно ...
0 комментариев