Навигация
И достигает 3,5–4Д. Дипольный момент ионных молекул достигает 10Д
00 и достигает 3,5–4Д. Дипольный момент ионных молекул достигает 10Д.
и –связи. Насыщаемость связи.
В зависимости от способа перекрывания валентных орбиталей взаимодействую-щих атомов различают –и – ковалентные связи.
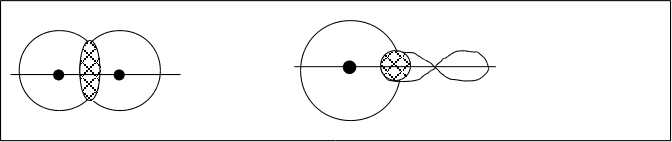 –связью
называют такую
ковалентную
связь, для которой
область перекрывания
находится на
линии связывающей
центры взаимодействующих
атомов, например,
в молекулах
H2, HCl
(рис.4.8.)
–связью
называют такую
ковалентную
связь, для которой
область перекрывания
находится на
линии связывающей
центры взаимодействующих
атомов, например,
в молекулах
H2, HCl
(рис.4.8.)
Н Н H Cl
а) б)
х х
s-s–cвязьs–р–cвязь
Рис.4.8. а) молекула H2 б) молекула HCl.
В обоих случаях область перекрывания лежит на линии “х”, проходящей через центры атомов.
связь – это такая ковалентная связь, для которой область перекрывания располагается в плоскости перпендикулярной линии, связывающей центры взаимо-действующих атомов.
Рассмотрим молекулу кислорода О2. Каждый атом кислорода имеет на внешнем квантовом уровне два неспаренных электрона, занимающих р-орбитали, например, рх– и рy–орбитали (рис.4.9.).
При взаимодействии друг с другом двух атомов кислорода происходит перекрывание попарно двух рх–орбиталей и двух рy–орбиталей. Причем, область перекрывания рх–орбиталей находится на линии, связывающей центры двух атомов. При этом образуется px-px –связь. Область перекрывания двух рy–орбиталей лежит в плоскости (x–y), т.е. в плоскости перпендикулярной линии связывающей центры кислородов. Образуется py-py –связь. Это показано на рис.4.10.
| 2 | ||||
| n=1 | p | |||
| s | ||||
Pz
Py
Px px-px
py-py –связь
Рис.4.9. Рис.4.10. Образование и –связей в молекуле О2.
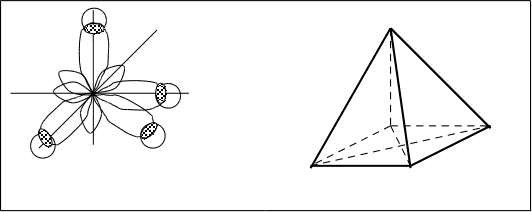
В молекуле N2 образуется две –связи. Наряду с px-px–связью и py-py–связью образуется вторая pz-pz–связь. Эта связь образуется в результате перекрывания pz–орбиталей обеих атомов азота имеющих тоже по одному неспаренному электрону с противоположными спинами.
![]()
![]() pz-pz
pz-pz
N px-px N
![]() py-py
py-py
–связь вторичная после –связи. Она образуется в том случае, когда уже имеется –связь. Отдельно –связь между двумя атомами не существует. –связь как дополнительная менее прочная, чем –связь. Возможность образования –связи обеспечивает насыщаемость ковалентной связи и приводит к тому, что между двумя атомами могут быть не только одинарные, но и двойные и тройные связи.
Гибридизация связи. Направленность связи. Геометрическая конфигурация молекул.
Валентными являются электроны не только одного подуровня, орбитали которых имеют одинаковую форму, а и разных подуровней с различной конфигурацией электронных облаков. Например, атомы бария и углерода имеют валентные электроны, находящиеся на 2s и 2p-подуровнях (бор 2s22p1; углерод 2s22p2). В образовании связи принимают участие одновременно s- и p-электронные облака имеющие различные конфигурации. Следовательно, должны образовываться разные по прочности химические связи, т.к. при взаимодействии с другими одинаковыми атомами полнота перекрывания будет разной.
Рассмотрим образование молекулы СН4. В возбужденном атоме углерода валентные электроны располагаются на 2s12p3, т.е. по одному на каждой орбитале. (рис.4.4.).
При взаимодействии атома углерода с водородом образуется четыре ковалентных связи. Перекрывание электронных облаков водорода с р-облаками углерода происходит по полосам р-облаков, а s-облако углерода с s-облаком водорода может перекрываться в любом месте, т.к. все направления равноценны. При этом, площадь перекрывания s-облака у углерода с водородом будет отличаться от площади перекры–
в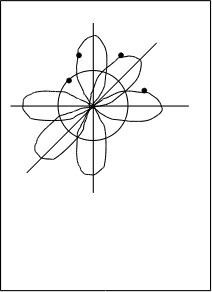 ания
р-облаков.
Следовательно,
в молекуле СН4
один атом
водорода будет
иметь иную
прочность
связи, чем остальные
три, чего практически
не бывает. Все
четыре атома
водорода в
молекуле метана
неразличимы,
имеют одинаковую
энергию связи.
Напрашивается
вывод: все четыре
облака в возбужденном
атоме углерода
имеют одинаковую
форму и плотность.
Эта идея привела
к возникновению
теории гибридизации.
ания
р-облаков.
Следовательно,
в молекуле СН4
один атом
водорода будет
иметь иную
прочность
связи, чем остальные
три, чего практически
не бывает. Все
четыре атома
водорода в
молекуле метана
неразличимы,
имеют одинаковую
энергию связи.
Напрашивается
вывод: все четыре
облака в возбужденном
атоме углерода
имеют одинаковую
форму и плотность.
Эта идея привела
к возникновению
теории гибридизации.
В основе теории гибридизации лежит идея преобразо-
Рис.4.11. Расположение вания электронных облаков центрального атома перед его
валентных электронов взаимодействием с другими атомами. В результате такой
в возбужденном атоме перестройки электронные облака центрального атома раз-
углерода. ные по форме и плотности преобразуются в новые
(гибридные) облака одинаковой формы и плотности.
Так, у атома углерода в результате перестройки s-облако за счет своей плотности и частично плотности р-облаков приобретает форму односторонней гонтели. Аналогично все р-облака за счет своей плотности и остаточной плотности s-облака становятся такими же по форме и плотности.(рис.4.12.).

Pz sp-гибридизация
Py
S
Px
гибридизация ps- гибридизация
ps- гибридизация
ps- гибридизация
Рис.4.12. Перестройка (гибридизация)-электронных облаков атома углерода.
В данном преобразовании учавствуют одно s-облако и три р-облака, поэтому такая перестройка называется sp3-гибридизацией. Как видно из рис.4.12. в результате гибридизации не только изменяется форма облаков, изменяется также взаимное расположение облаков, увеличиваются углы между новыми (гибридными) орбиталями. Гибридное состояние атома приобретает своеобразную геометрическую конфигурацию, которая и предопределяет геометрическую структуру молекулы.
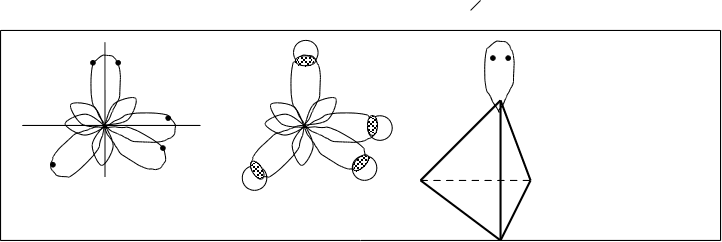
 Н Н
Н Н
С Н
Н Н С Н
Н
Н
Рис.3.13. Конфигурация молекулы СН4.
После гибридизации атом углерода (рис.4.12.) получил четыре гибридных sp-облака. После взаимодействия с водородом образуется четыре одинаковых сигма sp-гибридных связи. (рис.4.13.). Молекула СН4 приобретает конфигурацию тетраэдра.
Так как гибридные облака имеют большую вытянутость в одну сторону от ядра, чем в другую, то химическая связь, образованная гибридными облаками более прочна, чем связь, образованная отдельными облаками, например, s- и p-облаками. Гибридизация связана с энергетическим выигрышем в результате образования более прочных связей и более симметричного распределения электронной плотности в молекуле.
Рассмотрим другие типы гибридизации. sp-гибридизация. В преобразовании участвуют одно s- и одно р-облако и гибридные sp-облака становятся линейно расположенными (рис.4.14.)

S
sp-гибридизация гибридные облака
P
исходные 1800
облака
Рис.4.14. Расположение гибридных атомов при sp-гибридизации.
При sp-гибридизации молекулы имеют линейную конфигурацию. Например, молекула BeCl2 (Cl–Be–Cl).
sp2-гибридизация. Перестрой электронных облаков за счет одного s-облака и двух р-облаков, приводит к образованию трех sp2-гибридных облаков, расположенных друг относительно друга под углом 1200.

P
1200
S
P sp2-гибридизация
исходные гибридные
облака облака
Рис.4.15. Расположение электронных оболочек при sp2-гибридизации.
s![]()
 p2-гибридизация
дает треугольную
конфигурацию
молекул. Такую
конфигурацию
имеет, например,
молекула BCl3. Cl
p2-гибридизация
дает треугольную
конфигурацию
молекул. Такую
конфигурацию
имеет, например,
молекула BCl3. Cl
 B–Cl
B–Cl
Cl
Рис.4.16. sp2-гибриди-
зация азота и пирами-
sp3-гибридное молекула дальная конфигура-
состояние атома азота NH3 ция молекулы NH3.
Рассмотрим молекулы NH3 и Н2О. В молекуле NH3 электронные облака центрального атома азота гибридизированы. Тип гибридизации sp3. Однако во взаимодействие вступили только три гибридных орбитали, содержащих по одному электрону. На четвертой гибридной орбитали находится два электрона и поэтому она во взаимодействии с водородом не участвует. Хотя азот имеет sp3гибридное состояние, но конфигурация молекул не тетраэдрическая, а пирамидальная, образованная как бы за счет p3-гибридных облаков (рис.4.16.).
В молекуле Н2О атом кислорода находится в sp3-гибридном состоянии. Но на двух гибридных орбиталях содержится по два электрона и только две остальных, имеющих по одному электрону, вступают во взаимодействие с водородом. Получается следующая картина: при sp3-гибридном состоянии электронных облаков атома кислорода молекула воды имеет угловую конфигурацию, образованную только за счет гибридных атомов.(рис.4.17.)
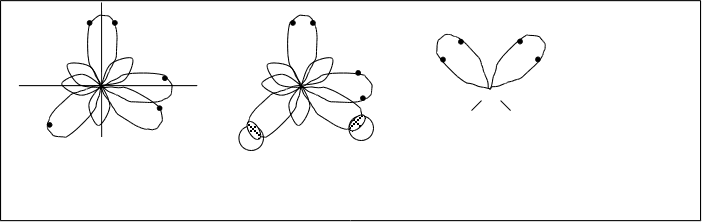
а) б) в) О
Н Н
sp3-гибридное состояние 104,50
кислорода
Рис.4.17. sp3-гибридное состояние кислорода (а); конфигурация молекулы Н2О (б,в)
Зависимость пространственных конфигураций молекул от типа гибридизации дана в таблице 4.1.
Таблица 4.1.
| Тип гибридизации | Конфигурация молекул | Примеры |
| sp | линейная | BeCl2, ZnCl2, Co2. |
| sp2 | треугольная | H2O, H2S. |
| sp3 | тетраэдрическая | BCl3, BF3, Co32–. |
| sp3 (только p2 занята) | угловая | CH4, NH4+, BH4–. |
| sp3 (только p3 занята) | пирамидальная | SbH3, NH3. |
| sp2d | квадратная | PCl42–. |
| sp3d | бипирамидальная | PtCl5. |
| sp3d2 | октаэдрическая | SF6. |
Похожие работы
... , как в общенаучном плане, так и прикладном плане. Это дает нам возможность проанализировать содержание данной темы в курсе химии средней школы. Глава 2. МЕТОДИКА ИЗУЧЕНИЯ КРИСТАЛЛОГИДРАТОВ В КУРСЕ ХИМИИ СРЕДНЕЙ ШКОЛЫ 2.1 Тема «Кристаллогидраты» в стандарте школьного образования Стандарт среднего (полного) общего образования по химии определяет собой обязательных минимум, который должен ...
... г. для химической лаборатории построено отдельное здание. При чтении лекций в это время профессора придерживаются большей частью руководств Теннара, Пайена, Розе, Пфаффа и Берцелиуса. Следовательно, новое направление химии в России было усвоено весьма скоро. К этому же времени относится и появление, кроме переводных, также и первых оригинальных руководств по химии на русском языке. В 1810 - 1813 ...
... поскольку ускорение химических реакций заметно влияет на снижение издержек производства. 9. Атомно-молекулярное учение Ведущей идеей атомно-молекулярного учения, составляющего фундамент современной физики, химии и естествознания, является идея дискретности (прерывности строения) вещества. Вещество не заполняет целиком занимаемое им пространство, оно состоит из отдельных, находящихся на очень ...
... и т.д. Человек начал применять лекарственные вещества очень давно, несколько тысяч лет назад. Древняя медицина практически полностью основывалась на лекарственных растениях, и этот подход сохранил свою привлекательность до наших дней. Множество современных лекарственных препаратов содержат вещества растительного происхождения или химически синтезированные соединения, идентичные тем, которые можно ...

0 комментариев