Навигация
Метод молекулярных орбиталей
4.3.2. Метод молекулярных орбиталей.
К сожалению метод валентных связей, имеющий хорошую наглядность, не смог объяснить ряд особенностей отдельных молекул и устойчивость частиц. Так, метод ВС не мог объяснить, почему в молекуле O2 остаются неиспользованными два электрона и молекула обладает магнитными свойствами, почему существуют и являются достаточно устойчивыми ионы Н2–, Ne2+, O2+ и др.? Ответ на многие “почему?” был получен после введения в теорию химической связи метода молекулярных орбиталей (метода МО).
Метод молекулярных орбиталей базируется на следующих положениях:
Электроны в молекулах находятся на молекулярных орбиталях, как у атома – на атомных.
молекулярные орбитали получаются при складывании атомных орбиталей.
Из двух атомных орбиталей образуется две молекулярные орбитали, одна из которых имеет более низкую энергию.
Орбиталь с более низкой энергией называется связывающей, а с более высокой – разрыхляющей.
Образуются как сигма (-), так и пи (-) молекулярные орбитали.
Распределение электронов по молекулярным орбиталям происходит в соответствии тех же принципов, что и по атомным: принципа наименьшей энергии, принципа Паули и правила Гунда.
П
![]()
![]()
![]()
![]()
![]()
![]()
 ри
взаимодействии
двух s-атомных
образуется
две молекулярные
орбитали:sсв
и sраз
(рис.4.18.).
ри
взаимодействии
двух s-атомных
образуется
две молекулярные
орбитали:sсв
и sраз
(рис.4.18.).
 sраз
sраз
+
![]()
S S sсв
Рис.4.18. Схема образованияs -молекулярных орбиталей.
Р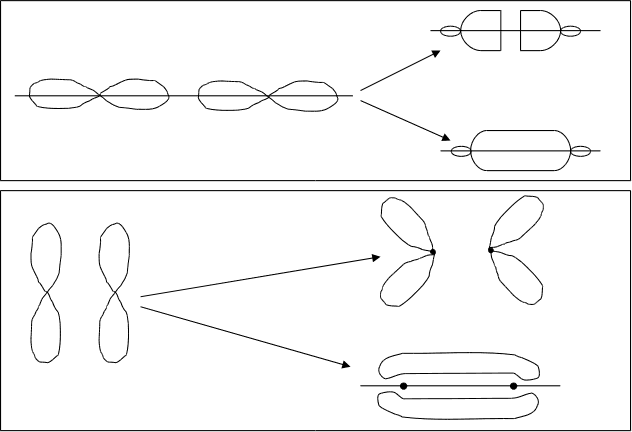 -атомные
орбитали в
зависимости
от способа
взаимодействия
способны образовывать
два типа молекулярных
орбиталей
px-МО
и py(pz)-МО.
(рис.4.19. и 4.20.)
-атомные
орбитали в
зависимости
от способа
взаимодействия
способны образовывать
два типа молекулярных
орбиталей
px-МО
и py(pz)-МО.
(рис.4.19. и 4.20.)
pxраз
+
Px Px pxсв
Рис.4.19. Схема образования px –МО.
pzраз
+
pzсв
Pz Pz
Рис.4.20. Схема образования pz –МО.
Рассмотрим с позиции метода МО несколько молекул.
Молекула Н2. У каждого атома водорода имеется на атомных орбиталях по одному s-электрону. При взаимодействии водородов атомные орбитали объединяются и образуют, как показано на рис.4.18. две молекулярные орбитали:sсв и sраз. Диаграмма взаимного расположения связующих и разрыхляющих молекулярных орбиталей показана на рис.4.21.
По принципу наименьшей энергии и принципу Паули оба электрона располагаются на sсв-орбитале. Орбиталь sраз остается свободной.
М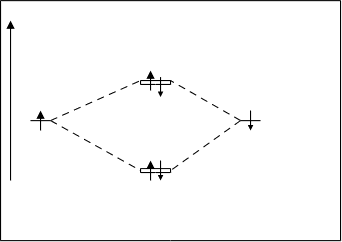 етод
МО позволяет
оценивать проч-
етод
МО позволяет
оценивать проч-
А.О. МО А.О. ность химической связи путем расчета
Н’ Н2 H’’ кратности связи. Кратность связи (К.С.)
sраз определяется как полуразность числа
электронов на связующих орбиталях (nсв) и
числа электронов на разрыхляющих (nраз)
1S 1S КС= nсв – nраз /2
sсв Для молекулы водорода кратность связи
Рис.4.21. Энергетическая диаграмма равна 1. КСн2=2–0/1=1
молекулы Н2. Энергия диссоциации молекулы Н2 состав-
ляет 432 кДж/моль.
Молекула Не2. Энергетическая диаграмма молекулы по методу МО представлена на рисунке 4.22.

А.О. МО А.О. По сравнению с молекулой водорода,
Не’ Не2 Hе’’ энергетическая диаграмма молекулы Не2
sраз содержит также два электрона на sраз -
орбите, число электронов на связующей и
разрыхляющей орбиталях одинаково.
1S 1S Кратность связи молекулы равна нулю
(КСне2=2–2/2=0). Выигрыша энергии нет.
sсв Следовательно, молекула Не2не существует.
Рис.4.21. Энергитическая схема Рассмотрим двухатомные молекулы
молекулы Не2. элементов второго периода.
У элементов второго периода, кроме 1S-орбиталей, в образовании МО принимают участие 2S-, 2Px-, 2Py-, и 2Pz-орбитали. Комбинация 2S-атомных орбиталей дает 2sсв-и 2sраз-орбитали. Взаимодействие 2p-орбиталей приводит к образованию двух типов МО-рсв-, рраз- и pсв-, pраз-орбиталей. 2pxсв-и 2pxраз-молекулярные орбитали образуются от 2Px-атомных орбиталей, вытянутых вдоль оси “x”, соединяющей центры объединяющихся атомов. Так как 2Py- и 2Pz-атомные орбитали расположены перпендикулярно этой оси, следовательно они образуют pyсв-, pyраз-, pzсв- и pzраз-орбитали, лежащие во взаимноперпендикулярных плоскостях. Форма -молекулярных орбиталей показана на рис.4.20.
В соответствии со спекторскопическими данными молекулярные орбитали двухатомных молекул по уровню энергии располагаются в следующий ряд:
1sсв
Похожие работы
... , как в общенаучном плане, так и прикладном плане. Это дает нам возможность проанализировать содержание данной темы в курсе химии средней школы. Глава 2. МЕТОДИКА ИЗУЧЕНИЯ КРИСТАЛЛОГИДРАТОВ В КУРСЕ ХИМИИ СРЕДНЕЙ ШКОЛЫ 2.1 Тема «Кристаллогидраты» в стандарте школьного образования Стандарт среднего (полного) общего образования по химии определяет собой обязательных минимум, который должен ...
... г. для химической лаборатории построено отдельное здание. При чтении лекций в это время профессора придерживаются большей частью руководств Теннара, Пайена, Розе, Пфаффа и Берцелиуса. Следовательно, новое направление химии в России было усвоено весьма скоро. К этому же времени относится и появление, кроме переводных, также и первых оригинальных руководств по химии на русском языке. В 1810 - 1813 ...
... поскольку ускорение химических реакций заметно влияет на снижение издержек производства. 9. Атомно-молекулярное учение Ведущей идеей атомно-молекулярного учения, составляющего фундамент современной физики, химии и естествознания, является идея дискретности (прерывности строения) вещества. Вещество не заполняет целиком занимаемое им пространство, оно состоит из отдельных, находящихся на очень ...
... и т.д. Человек начал применять лекарственные вещества очень давно, несколько тысяч лет назад. Древняя медицина практически полностью основывалась на лекарственных растениях, и этот подход сохранил свою привлекательность до наших дней. Множество современных лекарственных препаратов содержат вещества растительного происхождения или химически синтезированные соединения, идентичные тем, которые можно ...
0 комментариев