Навигация
ПЕРСПЕКТИВЫ ГЕННО-ИНЖЕНЕРНЫХ РАБОТ В ЖИВОТНОВОДСТВЕ
3. ПЕРСПЕКТИВЫ ГЕННО-ИНЖЕНЕРНЫХ РАБОТ В ЖИВОТНОВОДСТВЕ
Развитие биотехнологии сельскохозяйственных животных, в том числе генная инженерия, открывает новые возможности развития животноводства. Уже имеющиеся результаты по получению трансгенных животных говорят о возможности изменения ряда важнейших хозяйственно-ценных признаков. Например, трансгенные животные (свиньи, куры, кролики) с геном гормона роста при равных условиях характеризуются повышенными темпами роста.
Другим важнейшим направлением генной инженерии является получение трансгенных особей с интегрированными в геном генными конструкциями, связанными с усилением иммунитета животных к инфекционным заболеваниям.
Третьим актуальным направлением генной инженерии животныж является получение животных продуцентов биологически активных веществ, необходимых в медицине, ветеринарии и технологии переработки продуктов животноводства. Многие биологически активные вещества не могут производиться традиционными методами в достаточных количествах и с желательным качеством. Существует огромный коммерческий интерес к производству этих белков. В сыроделии существует значительный дефицит молокосвертывающих энзимов, в частности, химозина, необходимого для получения высококачественных твердых сортов сыра. Первым экземпляром трангенного животного стала мышь, размерами вдвое превосходящая обычную особь в нее был введен ген, синтезирующий гормон роста крысы. И ученых сразу заинтересовала возможность трансгенеза у сельскохозяйственных животных. Направление, связанное с получением из трансгенных сельских животных человеческих белков уже приближается к стадии коммерциализации. Ученые небезуспешно пытаются синтезировать человеческие белки в бактериях и дрожжах. Но это дорого и технически сложно: из бактериальных культур не всегда удается выделить чистый белок. К тому же некоторые белки невозможно получить в бактериях в силу громоздкости генов, определяющих их синтез. Биореактор в виде коровы или овцы лишен этих недостатков, и он гораздо производительнее, а конечный продукт (белок) получается в десятки раз дешевле. Но началось все опять-таки с мыши. В 1987 году в США вывели трансгенных мышей, в молоке которых содержался тканевый плазмино-генный активатор, способствующий рассасыванию тромбов в человеческих сосудах. После этого успеха направление заинтересовало крупный капитал (рынок лекарственных белков оценивается приблизительно в 10 млрд. долларов), и в надежде на эффективность новой технологии на будущем рынке начали внедряться биотехнологические гиганты, активно инвестируя в НИОКР. За неполные десять лет, прошедшие с американского достижения, от трансгенных коз, овец, свиней, кроликов и даже коров было получено семнадцать лекарственных белков. Причем десять из этих белков выделялись с молоком в приличной концентрации - около одного грамма на литр молока. Это большое количество, поскольку для курса лечения некоторых болезней требуется всего несколько миллиграммов. А сейчас таким способом научились синтезировать гораздо больше белков. Как минимум три препарата, полученных от трансгенных животных, проходят сегодня последние клинические испытания.
Наиболее интересным является использование молочной железы как продуцирующего органа, т. к. в этом случае жидкость, содержащую рекомбинантные протеины, можно легко извлечь. Кроме того, молочная железа физиологически обладает огромным потенциалом синтеза протеинов. Принципиальная возможность специфической экспрессии трансгенов протеина молока и чужеродных протеинов в молочной железе была продемонстрирована в экспериментах на мышах, кроликах, свиньях, овцах, козах. Среди сельскохозяйственных животных получение и использование трансгенных мелких жвачных значительно дешевле (на единицу биологической продукции), чем коров, т. к. овцы и козы обладают коротким репродуктивным периодом и в случае интенсивной экспрессии соответствующего гена сразу же открывается возможность быстрого размножения трансгенных животных, создание промышленного стада продуцентов и перманентных линий трансгенных животных, экспресси-рующих желаемые протеины. При получении трансгенных животных исследователи стремятся к тому, чтобы все соматические клетки (полная трансгенность) и, в особенности, генеративные клетки, содержали генную конструкцию. В этих случаях интеграция рекомбинантной ДНК приводит к полной трансгенности и при условии достаточной экспрессии обусловливает изменение фенотипа животных и передачу этого признака потомству. Основным способом получения трансгенных животных на сегодняшний день остается микроинъекция рекомбинантной ДНК в мужской пронуклеус ранних зигот. Поэтому микроинъекцию генов осуществляют на максимально ранних этапах развития животного: в большинстве случаев на стадии оплодотворенной яйцеклетки или двуклеточных эмбрионов. Уже имеются трансгенные по гену химозина кролики с промотором казеина крупного рогатого скота, в молоке которых отмечен высокий уровень химозина и доказана его высокая активность. У некоторых кроликов в 1л молока содержится до 1500 мг химозина, а за лактацию от одного кролика можно получить такое количество химозина, которое способно переработать до 10000 кг коровьего молока. Если учесть, что для свертывания 1 тонны молока при производстве сыра требуется 1 г химозина, то для производства сыра в России потребуется лишь 300 кг химозина. Для этого необходимо иметь «биотехнологическую» или «генную» ферму на 5 - 6 коров или 300 овец. Следует подчеркнуть, что главным критерием при выборе подходящего вида животных для «генных» ферм в большинстве случаев должен быть необходимый объем производства. Для производства протеинов в молочной железе в масштабах тонн целесообразно использовать коров, в сотнях килограммов — овец и коз, а в килограммах — кроликов (Brinster е.а.,1985).
В настоящее время разрабатываются и апробируются системы организации и функционирования биологических предприятий на племенных фермах, использующих трансгенных овец или коз. Основная и наиболее трудоемкая работа- создание первичных трансгенов с хорошей продукцией (экспрессией ) белка интереса или т.н. «генных ферм». Для достижения этой цели, особенно в молочном козоводстве, затрачены большие материальные и интеллектуальные ресурсы, однако говорить о развитой и действующей биоиндустрии на основе трансгенных овец и коз, особенно в нашей стране, преждевременно. Связано это в первую очередь с тем, что метод микроинъекций в пронуклеус не стопроцентный. Часто случается, что генная конструкция может вообще не встроиться в геном животного, а если и встроится, то может оказаться не во всех клетках. Из трансплантированных яйцеклеток с генной конструкцией прижиться может лишь пятая часть, а встроиться в нужный участок генома - 1-2%. Большого искусства требует и трансплантация зиготы в половые пути самки. Другая проблема - поиск и выделение наиболее эффективных генных конструкции. Проводятся интенсивные опыты с различными животными, с целью получения такой экспрессии белка, которая была бы наиболее экономически выгодной. Сейчас биотехнологи Института биологии гена и МГУ создают конструкцию, которая будет содержать ген, определяющий синтез лактоферрина (белка, отвечающего в женском молоке за иммунитет новорожденного). Сложность заключается в том, чтобы подобрать к этому гену такой промотор, который не просто заставит его работать в ткани молочной железы, а работать эффективно, то есть вызывать наибольший уровень экспрессии нужного белка. Как правило, первые опыты обычно проводятся с мышами. В отличие от крупных животных их проще и дешевле содержать, они быстро доходят до половозрелого возраста, поэтому меньше времени уходит на получение и размножение трансгенных особей для последующего их изучения. Далее наблюдают, какие яйцеклетки прижились, в каких животных генная конструкция встроилась в активную часть генома. В лучшем случае из ста яйцеклеток может получиться один-два трансгена (Эрнст Л.К., 1993, Clark A.J. е.а., 1989, Pursel V.G. е.а., 1990, Wilmut I.e.a.,1991). Как только в мышином молоке появится желаемый уровень лактоферрина, можно будет переходить на продуктивных сельскохозяйственных животных, в частности, коз. Коза не так плодовита, как мыши, и может родить двух, в лучшем случае трех козлят, поэтому коз в эксперименте должно быть много.
В то же время у козы, как биологического объекта для генно-инженерных работ, имеется немало преимуществ. На килограмм живой массы коза дает в 2-3 раза больше молока, чем корова, ее репродуктивный цикл практически вдвое короче, и, наконец, она менее прихотлива и более устойчива. И все же наиболее важная проблема - доставка генной конструкции не просто в ядро яйцеклетки, а в нужную хромосому. По мнению многих специалистов, требующие тонкой и точной работы микроинъекции генов в зиготу могут быть заменены в недалеком будущем более эффективной и тиражируемой технологией. И, судя по публикациям, ученые приближаются к решению этой задачи. Пока же более эффективным методом, чем микроинъекции гена в зиготу, представляется метод клонирования той клетки, которая была отобрана в результате многочисленных опытов в лабораторных условиях. Потомство, родившееся с применением такой технологии, будет стопроцентно трансгенным. Впрочем, эта технология только разрабатывается, ее механизм еще не отработан. Можно только с достаточной уверенностью предположить, что уже в ближайшее десятилетие технология клонирования может стать превалирующей
В заключение хотелось бы подчеркнуть, что, разработка теории трансгенеза сельскохозяйственных животных и поиски путей практического использования этого метода идут параллельно, в связи с чем получение как положительных так и отрицательных результатов вполне возможно. Последнее десятилетие XX века знаменательно глубоким интегрированием биотехнологии и молекулярной генетики в современную зоотехнию и в практику селекционно-племенной работы. Это взаимодействие начинается с планирования генных конструкций, которое базируется на фундаментальных данных об обменных процессах, происходящих в организме животных и знании основных генетических закономерностей, управляющих формированием их продуктивности и заканчивается объективной оценкой эффекта интеграции в геном животных чужеродного гена. Очевидно также, что возможность получения трансгенных сельскохозяйственных животных реализовалась в результате развития метода трансплантации эмбрионов, что само по себе является серьезным достижением зоотехнической науки. Как и следовало ожидать, интеграция в геном животных чужеродных генов, вне зависимости от того, аналогичны они уже имеющимся, или являются новыми, затрагивающими жизненно важные функции организма, вызывает при активной их экспрессии нарушение физиологического гомеостаза как на клеточном так и на организменном уровнях. При переходе порога внутренних возможностей коррекции усиленного генно-инженерным путем признака метаболическими системами животных наступало развитие различных патологических изменений, в том числе и прогрессирующих, приводящих к сокращению продолжительности жизни трансгенных животных, нарушению их воспроизводительной функции (Эрнст Л.К. и соавт.,1993). Для решения задачи генно-инженерного изменения количественных признаков животных, имеющих полигенную природу, очевидно, потребуется получение политрансгенных сельскохозяйственных животных только вследствие технических причин (поскольку для этого, возможно, потребуется осуществление многоступенчатого трансгенеза), но и из-за невозможности клонировать еще неизвестные гены. В связи с этим основной интерес большинства исследователей связан сейчас с генами, работа которых определяет относительно независимые морфофункциональные признаки животного (информационный генетический иммунитет, продукция белков животных и человека). Не исключено, однако, что на этом пути может быть получено положительное изменение каких-либо других хозяйственно-полезных признаков животных, определяемых единичными генами животных.
Таким образом, успехи в области молекулярной генетики и биологии гена должны обеспечить дальнейший прогресс в проблеме трансгенеза сельскохозяйственных животных, а, следовательно, в повышении эффективности и рентабельности производства многообразной животноводческой продукции.
Похожие работы
... например, "людей-свиней". Но есть и более логичные доводы. Скажем, новые медицинские и биологические препараты разрешаются к использованию на людях только после многолетних проверок на животных. Трансгенные продукты поступают в свободную продажу и уже охватывают несколько сотен наименований, хотя созданы они были всего несколько лет назад. Противники трансгенов подвергают сомнению и методы оценки ...
... , вызванные динамическими му-тациями.-----------------------T-----------T-------T-----T------T------T----------------------¬ Болезнь, номер по ¦ Ген, лока-¦Триплет¦Норма¦Прему-¦Мута- ¦Литература ¦ МакКьюсику (MIM) ¦ лизация ¦ ¦ ¦тация ¦ция ¦ ¦ -----------------------+-----------+-------+-----+------+------+----------------------+ Синдром ломкой X-хро- ¦FMR1, FRAXA¦(CGG)n ...
... при постановке биологических или медицинских экспериментов. Составлять его должны ведущие специалисты в этой области и знающие предмет юристы. 3. Другие применения генной инженерии Несмотря на успехи ученых в генной инженерии в таких отраслях, как создание генно-модифицированных продуктов и клонировании животных и человека, они на этом не останавливаются. В целях сохранения военного ...
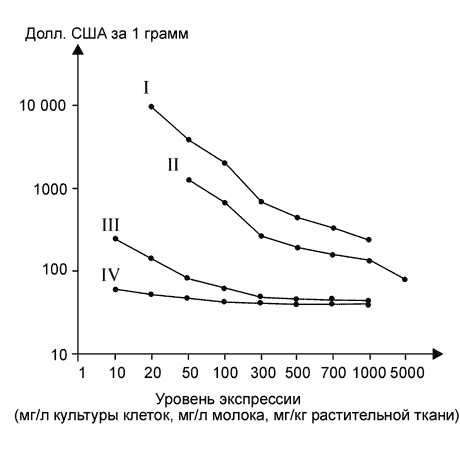
... растений позволит значительно снизить её стоимость (Giddings et al., 2000). В заключение хотелось бы отметить, что несмотря на значительные достижения в области продукции реком-бинантных белков медицинского назначения в растениях, это направление находится лишь на начальном этапе своего развития. Учёные-биотехно-логи уверены, что в будущем рекомбинантные препараты, получаемые из генетически ...

0 комментариев