Навигация
Метод пересадки ядер клеток, культивируемых in vitro
1.3 Метод пересадки ядер клеток, культивируемых in vitro
Еще одним способом получения трансгенных млекопитающих является использование трансформированных генными конструкциями клеточных линий. С этой целью могут быть использованы как стволовые клеточные линии, так и соматические клетки, культивируемые in vitro. Впервые экспрессия генных конструкций в соматических тканях химерных мышей, полученных с использованием трансформированных клеток эмбриональной карциномы, была доказана Stewart с соавторами [1985]. Доля химерных мышей была очень высокой, причем часть из них передавала трансген по наследству. Однако в настоящее время наибольшее распространение для получения химерных животных получили эмбриональные стволовые клетки, ЭСК [Robertson et al., 1986]. Преимуществом получения трансгенных животных с помощью трансформированных стволовых клеток является возможность тестирования интеграции трансгена в культуре клеток. Это означает, что каждый эмбрион, развившийся в культуре после пересадки ядер, будет трансгенным и последующая селекция трансгенных эмбрионов не требуется. Кроме того, пересадка таких эмбрионов реципиентам приведет к рождению только трансгенного потомства. Использование для получения трансгенных животных трансформированных ЭСК делает возможным в ряде случаев проводить оценку экспрессии трансгенов, что имеет немаловажное значение. При микроинъекции трансгены наугад интегрируются в любую часть генома. Это означает, что они могут разрушать весьма существенные гены (инсерционные мутации) или размещаться в тех частях хромосомы, которые недоступны для транскрипции. Тестирование экспрессии в культуре сделает возможным использование для пересадки ядер, а следовательно и для получения трансгенных животных только тех клеточных линий, в которых трансгены являются транскрипционно и трансляционно активными. Кроме того, в отличие от метода пронуклеарной инъекции исследование ЭСК позволяет целенаправленно воздействовать на геном посредством генного хххххххххх
Сенсационное сообщение было опубликовано в 1996 году в Nature. Была продемонстрирована возможность получения жизнеспособных овец посредством пересадки ядер соматических клеток, культивируемых in vitro. Позже сообщили о получениитрансгенных овец посредством пересадки ядер стабильно трансформированных первичных фетальных фибробластов (Schnieke et al., 1997). Из шести полученных трансгенных ягнят пять оказалось жизнеспособными. Степень трансгенности при использовании данной, метода составляла 100%, в то время как применение метода микроинъекции в той же лаборатории позволяло получить лишь 4,35% трансгенных потомков от числа родившихся животных. Для получения одного трансгенного ягненка методом пересадки ядер требовалось 20,8 овец, в то время как при использовании метода пронуклеарной инъекции - 51,4 овцы [Schnieke et at., 1997]. Как и при использовании ЭСК, данный метод позволяет проводить анализ интеграции в культуре клеток, а также осуществлять целенаправленное встраивание генных конструкций в желаемые участки генома. Кроме того, используемые клеточные линии могут быть кариотипизированы в культуре, что позволит заранее предопределять пол трансгенных животных. После получения трансгенных животных из различных клеточных линий и определения уровня экспрессии может быть произведен отбор желательных клонов для их дальнейшего использования в пересадках ядер.
Схема получения трансгенных животных с использованием стабильно трансформированных клеток.
1.4 Липосомы как переносчики ДНК
Векторами для переноса генных конструкций в эмбриональные линии млекопитающих могут служить липосомы [Rottmann et al, 1985], однако опосредованный ими перенос генов не получили широкого распространения
1.5 Использование половых клеток семенников (спермии и сперматогонии)
Сперматозоиды являются природным вектором, доставляющим ДНК в клетку. Использование спермиев в качестве переносчиков одной ДНК рассматривается как один из перспективных методов генетической модификации животных. В опытах Lavitrano (1989) 30% мышей полученных после оплодотворения обработанной ДНК спермой, оказались трансгенными и передавали трансген по наследству.
Многочисленные попытки в других лабораториях неуспешными. Анализ 1300 мышей, родившихся in vitro обработанной ДНК спермой, не выявил трансген ни у одной из исследованных особей [Brinster, 1989), Недавнее исследования показали, что при применении метода переноса ДНК посредством сперматазоидов в одной и той же лаборатории дае пра использовании одинаковой схемы исследований могут быть получены противоречивые результаты [Maiore et al, 1998]. Это позволяет предположить, что встраивание ДНК происходит только на определенной стадии клеточного цикла. Однако до настоящего времени не установлен механизм интеграции экзогенной ДНК в геном сперматозоидов.
Huguet и Esponda [1998] исследовали способность сперматозоидов поглощать линейную ДНК in vitro и in vivo. В опытах in vitro отмытые придатковые сперматозоиды инкубировали 2 часа с линейной ДНК. ДНК инъецировали в проксимальную область семенных канальцев, после чего через 6 часов извлекали сперматозоиды. Присутствие чужеродной ДНК было показано у 60-70% сперматозоидов. Сперматозоиды способны поглощать ДНК, аккумулировать ее в ядре. Секркты придатков и семенных канальцев не блокируют этот процесс.
Для повышения эффективности связывания ДНК со сперматозоидами используют различные методы: ДНК-липосомные комплексы [Bachiller et al.. 1991], инъекцию в семенники [Sato et al.. 1994], непосредственную инъекцию в семенные канальцы [Kim et al.. 1997] и придатки [Huguet и Esponda, 1998], инъекцию в семенные канальцы с последующей электропорацией [Yamazaki et al.. 1998], ко-инъекцию головок спермиев и ДНК в ооциты [Perry et al. 1999]. Также было показано, что экзогенная ДНК может быть эффективно доставлена в ооциты микроинъецированными сперматозоидами.
Большое внимание в последнее время привлекают манипуляции со стволовыми клетками семенников-сперматогониями [Brinster, Nagano. 1998]. Была продемонстрирована возможность переноса сперматогониев от одного самца другому как у животных одного вида (Avarbock, 1994; Brinster и Zimmermann. 1994), так и между двумя видами.
После пересадки половых клеток из семенников самца мыши в семенники другого самца, до 80% потомства происходило из сперматозоидов самца-донора. Была доказана возможность успешного протекания сперматогенеза после пересадки криоконсервированных клеток семенника и после их длительного консервирования.пересадке в семенники мышей клеток из семенников поздних стадий сперматогенеза половых клеток доноров выявлено не было /Dobnnski et al., 1999].
Успешное длительное культивирование половых клеток животных in uru делает возможным проведение трансформации сперматогониев экзогенной ДНК с последующей селекцией. Nagano с соавторами /2000] сообщили об успешном введении экзогенной ДНК в сперматогонии т vitro и in vivo посредством ретровирусной системы доставки. Экспрессия ретровирусной генной конструкции, включающей lacZ, наблюдалась в семенниках более 6 месяцев. Анализ показал, что по крайней мере 1 из 300 стволовых клеток семенников содержали трансген.
В сочетании с пересадкой трансформированных половых клеток в семенники реципиентов и успешным протеканием сперматогенеза подход может быть использован для получения трансгенного потомства.
Не смотря на хорошие результаты в использовании сперматозоидов для получения трансгенных мышей, а так же отдельные успешные попытки получения трансгенных свиней и КРС [Gandolfl et al, 1989, Schelander et al, 1995, Sperandio et al, 1996], каких-либо значительных успехов в получении трансгенных сельскохозяйственных животных с помощью трансформированных сперматогониев и спермиев до настоящего времени достигнуто не было. Достижения в использовании трансгенных технологий.
| Год | Событие | Автор |
| 1971 | Доставка чужеродной ДНК в ооциты кролика сперматозоидами | Bracket |
| 1974 | Получение трансгенных мышей с помощью вирусных векторов | Jaenish, Mintz |
| 1976 | Передача трансгена по наследству | Jaenish |
| 1980 | Получение трансгенных мышей микроинъекцией | Gordon |
| 1981 | Получение стволовых клеток | Ewans, Kaufman, Martin |
| 1984 | Эмбриональные химеры из клеток тератокарциномы | Bradley |
| 1985 | Получение трансгенных сельскохозяйственных животных | Brem, Hammer |
| 1986 | Эмбриональные химеры с использованием ЭСК Получение овец посредством пересадки ядер | Gossler, Willadsen |
| 1987 | Гомологичная рекомбинация в ЭСК Получение КРС методом пересадки ядер | Thomas, Capeccha Brather |
| 1988 | Получение кроликов методом пересадки ядер | Slice и Robl |
| 1989 | Генный таргетинг у мышей Получение трансгенных мышей и свиней с помощью спермиев в качестве векторов Получение трансгенного КРС методом микроинъекции Получение свиней методом пересадки ядер | Thompson el al., Lavitrano el at.,Gandolfi et al. Roschlau el al., Prather et al., |
| 1995 | Получение трансгенного КРС с помощью спермиев | Schelander et al |
| 1996 | Получение овец методом пересадки ядер культивируемых эмбриональных клеток Получение ЭСК приматов | Campbell Thomson |
| 1997 | Получение овец методом пересадки ядер фетальных клеток и соматических клеток взрослого животного Получение трансгенных овец методом пересадки ядер трансформированных культивируемых клеток Получение химерных трансгенных свиней, с использованием ПЗК | Wilmutetal, Schnieke Piedrahita |
| 1998 | Получение трансгенного КРС методом пересадки ядер трансформированных фетальных фибробластов Получение трансгенного КРС с использованием псевдотипных ретровирусных векторов Получение ЭСК из бластоцист человека Получение мышей методом инъекции в цитоплазму ядер кумулюсных клеток Получение КРС методом пересадки ядер дифференцированных клеток | Cibelli Chan Thomson Wakayama Kato |
| 1999 | Получение трансгенных мышей методом коинъекции ооцитов спермиями и экзогенной ДНК | Perry |
| 2000 | Получение свиней методом пересадки ядер соматических клеток (клетки гранулезы) | Polejaeva |
Похожие работы
... например, "людей-свиней". Но есть и более логичные доводы. Скажем, новые медицинские и биологические препараты разрешаются к использованию на людях только после многолетних проверок на животных. Трансгенные продукты поступают в свободную продажу и уже охватывают несколько сотен наименований, хотя созданы они были всего несколько лет назад. Противники трансгенов подвергают сомнению и методы оценки ...
... , вызванные динамическими му-тациями.-----------------------T-----------T-------T-----T------T------T----------------------¬ Болезнь, номер по ¦ Ген, лока-¦Триплет¦Норма¦Прему-¦Мута- ¦Литература ¦ МакКьюсику (MIM) ¦ лизация ¦ ¦ ¦тация ¦ция ¦ ¦ -----------------------+-----------+-------+-----+------+------+----------------------+ Синдром ломкой X-хро- ¦FMR1, FRAXA¦(CGG)n ...
... при постановке биологических или медицинских экспериментов. Составлять его должны ведущие специалисты в этой области и знающие предмет юристы. 3. Другие применения генной инженерии Несмотря на успехи ученых в генной инженерии в таких отраслях, как создание генно-модифицированных продуктов и клонировании животных и человека, они на этом не останавливаются. В целях сохранения военного ...
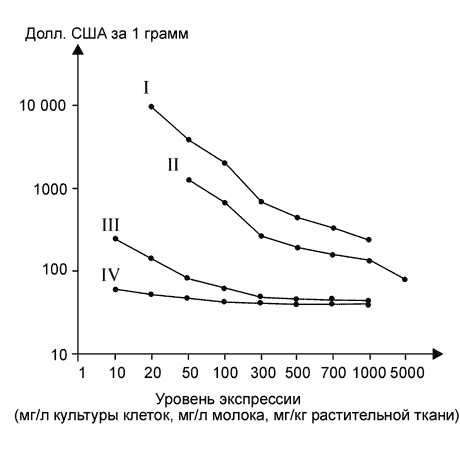
... растений позволит значительно снизить её стоимость (Giddings et al., 2000). В заключение хотелось бы отметить, что несмотря на значительные достижения в области продукции реком-бинантных белков медицинского назначения в растениях, это направление находится лишь на начальном этапе своего развития. Учёные-биотехно-логи уверены, что в будущем рекомбинантные препараты, получаемые из генетически ...

0 комментариев