Навигация
Анализ учебной программы по данной теме. Отбор основного содержания ее, структурирование на разделы (выделение блоков информации)
1. Анализ учебной программы по данной теме. Отбор основного содержания ее, структурирование на разделы (выделение блоков информации),
2. Вычленение опорных понятий (знаний) в каждом блоке, изображение их в сжатой, образной форме в виде общепринятых или специально придуманных простых и емких знаков (символов, рисунков), с которыми ассоциируется содержание понятий. При этом не следует увлекаться деталями, усложнять рисунки. Наоборот, лучше придать им простые очертания. Главное условие: краткость, наглядность, минимум текстовой информации. Новые термины целесообразно записывать полностью.
3. Компоновка закодированных понятий в блоки. Выбор геометрической формы для оформления каждого блока. Отдельные блоки информации должны быть обведены четким контуром и отличаться друг от друга не только формой (обычно неправильной), но и размерами.
4, Размещение блоков информации на плакате в логической последовательности в соответствии с их содержанием. Между блоками должно оставаться достаточное пространство, что способствует более четкому зрительному вычленению их.
5, Решение цветовой гаммы ОС. Необходимо, чтобы блоки отличались друг от друга цветом. Если ОС выполнен в черно-белом варианте (например, черным на белом фоне), то затем можно тонировать фон каждого блока.
В качестве примера рассмотрим структуру двух обобщающих ОС2.
I. Кислород. Оксиды
Основное содержание ОС в соответствии с программой VII класса: кислород — химический элемент (химический знак, относительная атомная масса, валентность, распространение в природе); кислород — простое вещество (химическая формула, физические и химические свойства, оксиды); получение и биологическая роль кислорода, его применение.
Исходя из содержания, можно выделить следующие блоки ОС: 1- Кислород — химический элемент; 2. Получение кислорода; 3. Физические свойства кислорода; 4. Химические свойства кислорода. Оксиды. 5. Применение кислорода,
В блоке I опорного плаката изображен химический знак кислорода; цифры внутри него (16, 49, II) соответственно обозначают относительную атомную массу, распространенность в природе и валентность элемента в соединениях.
Стрелки от химического знака указывают, на формулы сложных веществ, в состав которых входит кислород, и формулу простого вещества 02, крупно написанную в центре ОС и связанную с блоками: 2. Получение кислорода; 3. Физические свойства кислорода; 4. Химические свойства кислорода.
Химический знак кислорода во всех блоках выделен жирным шрифтом.
В блоке 2 схематично даны сведения о способах получения кислорода в лаборатории (разложение кислородсодержащих веществ) и в промышленности. Изображение зеленого листа напоминает о роли растений в круговороте кислорода в природе.
Изучая физические свойства кислорода, школьники должны усвоить, что кислород при обычных условиях — газ без цвета, вкуса и запаха, немного тяжелее воздуха, растворимость кислорода в воде невелика. В соответствии с этим в блоке 3 написано слово «газ» и далее перечеркнутые буквы Ц, В, 3 (газ без цвета, вкуса, запаха). Ниже показаны способы собирания кислорода в лаборатории, основанные на его плотности и малой растворимости в воде, достаточной, однако, для поддержания в ней жизни, о чем напоминает изображение рыбки.
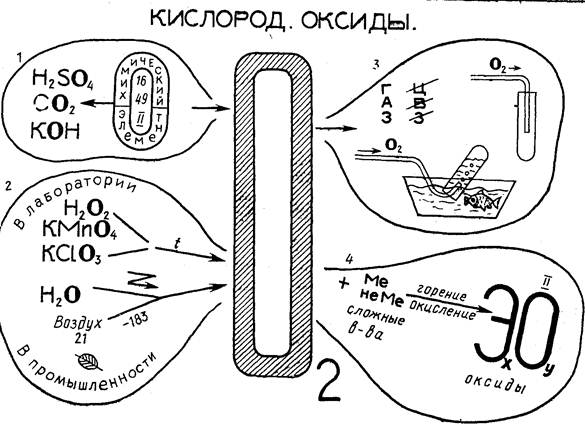
В блоке 4 выделены опорные понятия «окисление», «оксиды». Схемы взаимодействия кислорода с простыми и сложными веществами, а также формулы оксидов представлены в общем виде.
Обобщение знаний учащихся о применении кислорода целесообразно проводить на основе красочной схемы, помещенной в учебнике. В связи с этим нет необходимости включать в ОС соответствующий блок,
П. Типы кристаллических решеток
Главная цель опорного плаката — акцентировать внимание учащихся на причинно-следственной связи между строением вещества и его свойствами. Свойства веществ в твердом состоянии зависят от типа кристаллической решетки (прежде всего от того, какие частицы находятся в ее узлах), что, в свою очередь, обусловлено типом химической связи в данном веществе. Эта важнейшая мысль подчеркивается длинной красной стрелкой, внутри которой написано «Химическая связь». Стрелка направлена к фрагменту кристаллической решетки, а от него — к слову «Свойства». От главной стрелки отходят более мелкие к четырем блокам, соответствующим типам кристаллических решеток: ионной, молекулярной, атомной, металлической. В каждом блоке сохраняется одинаковая логическая последовательность: тип химической связи тип кристаллической решетки, свойства вещества. Блоки имеют различную форму, размеры и цвет и окаймлены четким контуром.
Для описания свойств веществ используются образы, ассоциации, жизненный опыт учащихся. Так, электропроводность твердого вещества, раствора или расплава обозначена отклоняющейся стрелкой гальванометра, для диэлектриков изображение гальванометра перечеркнуто; летучесть веществ отмечена рисунком воздушных шаров, пластичность и блеск металлов — изображением подковы и золоченого купола церкви (запись мм» напоминает слова учителя о том, что золото можно прокатывать в фольгу такой толщины), прочность некоторых веществ с атомной кристаллической решеткой — изображением кирпичной кладки.
Глядя на ОС, ребята сами могут сказать, что из молекул (мельчайших нейтральных частиц вещества, участвующих как единое целое в тепловом движении) состоят только вещества с молекулярным типом кристаллической решетки, в узлах которой находятся отдельные молекулы или их ассоциаты. Для остальных веществ весь кристалл в целом является единой гигантской макромолекулой.
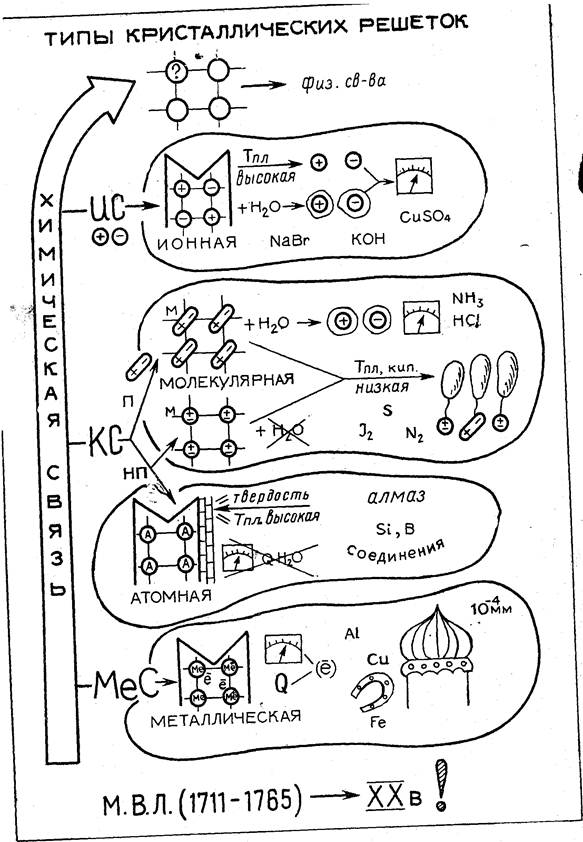
По нему же можно проводить актуализацию знаний о кристаллических решетках перед изучением темы «Металлы», и далее весь ОС будет полезен при заключительном повторении и обобщений курса химии. Способы выполнения ОС могут быть различными. Их выбирает учитель по своему усмотрению: в виде рисунка на сдвоенном листе ватмана, откидном крыле доски или кодопленке.
В целях активизации мышления учащихся полезно вовлечь их в процесс создания обобщающего ОС. На первом этапе для этого целесообразно использовать предварительно выполненные на отдельных листах (или кодопленках) готовые блоки, которые на глазах учащихся и с их помощью можно скомпоновать в опорный плакат на магнитной или фланелевой доске. При этом осмысливаются логические связи между разделами темы. В дальнейшем можно поручить учащимся не только компоновать ОС из готовых блоков, но и составлять их. Например, предложить в качестве домашнего задания обобщить материал одного или нескольких уроков в виде небольшой схемы. Наиболее удачные работы полезно обсудить в классе и использовать их впоследствии при составлении обобщающего ОС.
Опорные схемы (конспекты) и особенно совместное конструирование их с учащимися способствуют выработке у них навыков обобщения и логического мышления, знания становятся более осмысленными, прочными.
Глава 3. Методические разработки по теме: Урок по теме: «Строение атома. Химическая связь»Цели:
· обобщить и повторить знания учащихся по данной теме;
· выявить степень усвоения материала,
· уметь составлять электронные формулы атомов, схемы видов химической связи,
· решать творческие задания.
Оборудование:
· периодическая система химических элементов Д.И.Менделеева;
· портрет Д. И. Менделеева;
· карточки с заданиями, играми;
· опросный лист;
· табло с названиями конкурсов, игр.
| Кто хочет съесть ядро ореха, должен расколоть его скорлупу. |
| Плавт |
| Старайся дать уму как можно больше пищи. |
| А. Толстой |
Ход урока
Подготовка к уроку начинается за неделю до смотра. Учащиеся знакомятся с основной частью смотра, указывается, что необходимо повторить по учебнику и тетради.
Домашнее задание к этому уроку
1. Составить кроссворд и красиво его оформить.
2. Приготовить 1–2 сообщения из рубрики “В мире занимательной химии” и “Знаешь ли ты?”
УЧИТЕЛЬ. Добрый день, ребята! Сегодня на уроке мы повторим и закрепим знания по теме строение атома, химическая связь. На нашем уроке разделим класс на три группы (по рядам), они будут соревноваться в конкурсах. За каждое выполненное задание команда получает по одному баллу. Конкурсы оценивает жюри. Баллы заносят в опросный лист.
Конкурс “химические понятия”Учащиеся пишут химический диктант – учитель читает определение понятий по теме, а ученики на листках записывают по порядку названия терминов. После окончания диктовки ассистенты собирают работы и сдают их на проверку членам жюри.
Задания.
1. Сложная элетронейтральная система, состоящая из протонов, нейтронов, электронов.
(Атом)
2. Разновидности одного и того же химического элемента, имеющие одинаковый заряд ядра, но разное число нейтронов.
(Изотоп)
3. Совокупность атомов с одинаковым зарядом ядра.
(Химический элемент)
4. Заряженные частицы, образующиеся при присоединении или отдачи электронов атомами.
(Ионы)
5. Способность атомов химического элемента притягивать к себе общие электронные пары, участвующих в образовании химической связи.
(Электроорицательность).
6. Химическая связь, образующаяся при взаимодействии атомов одного и того же элемента-неметалла.
(Ковалентная неполярная связь)
7. Знаменитый английский физик, разработавший планетарную модель атома.
Конкурс капитановК доске вызываются “сильные” ученики представители каждой из команд и выполняют задание по карточкам.
Задание № 1.
1. Напишите электронную формулу и постройте энергетическую диаграммы для следующих атомов: Li, N, Cl.
2. Укажите положение этих элементов в Периодической системе химических элементов Д. И Менделеева.
Задание № 2.
1. Определите тип химической связи и запишите схему ее образования для веществ формулы, которых N2, LiCl, Ca.
Задание № 3.
Укажите знаком “—> ” ослабление металлических свойств и усиление неметаллических в следующих пятерках элементов. Объясните, на каком основании расставлялись знаки.
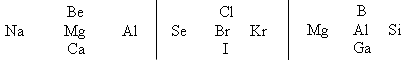
УЧИТЕЛЬ. Для химика очень важно уметь логически мыслить. Вам предлагаются следующие задания.
Задание первой команде.
Пергамент Элюара.
Зная о высоких ценах на археологические находки, Жан Элюар, владелец антикварной лавки в Париже, решил разбогатеть. Он нанес на старинный пергамент фрагменты Периодической системы химических элементов, а затем состарил его. Затем инсценировал находку пергамента в песках у одной из египетских пирамид в присутствии толпы американских туристов. Однако эксперт, приглашенный оценить манускрипт, объявил его грубой фальшивкой.
Чем руководствовался эксперт, делая свое заключение? В чем была ошибка Жана Элюара?

Ответ. Впервые символы химических элементов ввел в употребление И. Я. Берцелиус в 1814 г. Цифры перед символами – порядковые номера были введены намного позже, неизвестно каким образом обозначали жрецы Древнего Египта известные им металлы и неметаллы.
Задание для второй команды.
На записи в тетради одного не очень аккуратного ученика, при проведении лабораторного опыта, попала кислота, и часть текста была испорчена. Восстановите пропавшие слова.

Ответ. Атом состоит из ядра и электронной оболочки. Число электронов в электронной оболочке равно числу протонов, а также равно номеру элемента. Число энергетических уровней определяется номером периода. Число внешних электронов определяется номером группы для элементов главных подгрупп.
Задание для третьей команды.
В начале XX столетия геологи зашифровывали на картах места открытия руд ценных металлов при помощи координат химических элементов в Периодической системе. Арабской цифрой указывали номер периода, а римской – номер группы. Кроме того, в записях были еще буквы русского алфавита – А и Б. На одной из старых карт нашли обозначения: 4VIБ, 4VIIIБ2, 6IБ, 6IIБ. Расшифруйте записи геологов.
Ответ. Координаты 4VIБ в Периодической системе означают 4-й период и VIБ – группу, элемент хром; 4VIIIБ2 – никель; 6IБ – золото; 6IIБ – ртуть.
Конкурс “Кто лучше заполнит таблицу”УЧИТЕЛЬ. Сейчас мне хотелось бы увидеть, как вы умеете заполнять таблицы. Таблицу заполняет каждый участник команды индивидуально. По окончании отведенного времени все сдают заполненные таблицы членам жюри, которые определяют общую сумму правильных ответов. Кроме того, каждый участник получает свою оценку за таблицу.
Задание № 1.
Используя понятие о простом и сложном веществе, определите, какие из формул соответствуют простым и сложным веществам и поставьте в таблице буквы “С” и “П” соответственно.
| Формула вещества | Поваренная соль NaCl | Вода H2O | Озон O3 | Мел CaCO3 | Медь Cu | Оксид цинка (II) ZnO | Хлор CL2 | Соляная кислота HCL |
| Буквы | ( С ) | ( С ) | ( П ) | ( С ) | ( П ) | ( С ) | ( П ) | ( С ) |
Примечание. В скобках здесь и далее в таблицах приведены ответы.
Задание № 2.
Вы должны определить в каких предложениях идет речь об элементах (Э), а в каких о веществах (В).
| Предложения | Ответ |
| 1. Медь входит в состав медного купороса | ( Э ) |
| 2. Рыба дышит кислородом, растворенным в воде | ( В ) |
| 3. Железо входит в состав ржавчины | ( Э ) |
| 4. Сера не смачивается водой | ( В ) |
| 5. Оксид меди (II) состоит из меди и кислорода | ( Э ) |
| 6. Железо во влажном воздухе ржавеет | ( В ) |
Задание № 3.
Конкурс «Химических ребусов»В клетках изображены химические символы, под которыми стоят одна или несколько цифр. Чтобы прочесть зашифрованное слово, надо заменить эти цифры буквами из названия изображенного над цифрами символа. А буквы берутся из каждого слова в порядке стоящих под ним цифр.
Ответ. Ионная связь возникает между ионами.
УЧИТЕЛЬ. Ребята, наш урок – смотр знаний подошел к концу. Скажите, как вы себя чувствовали на уроке? На каких этапах урока вам было трудно? Какой вид работы вам был наиболее интересен?.
Литература
1. Зорина Л. Я. Слово учителя в учебном процессе Серия «Педагогика и психология», М.: Знание, 1984, № 3, 2. Шаталов В. Ф. Куда и как исчезли тройки. М.: Просвещение, 1979; Педагогическая проза. М.: Просвещение, 1980.
3. Лысенко С. М. Использование на уроках опорных конспектов при изучении химической связи//Химия в школе, 1978. № 5. С. 29.
4. Воронцов А. В. Применение схем-конспектов при обобщении и закреплении знаний учащихся//Химия в школе. 1978. № 4. С. 22.
5. Троицкая Е. В., Перовская Л. Т. Как мы используем схемы-конспекты на уроках химии//Химия в школе. 1Р80. № 1. С. 29.
6. Чертков И. Н. Как воспитывает и обучает учащихся учитель Л;- В. Махова Химия в школе. 1986. № 2. С. 24.
7. Ганзен В. А. Восприятие целостных объектов. Л.: Изд-во ЛГУ, 1974. С. 114—121.
8. Груденов Я. И. Психолого-дидактические основы усвоения учебного материала // Химия в школе, 1985, № 4. С, 20.
Похожие работы
... Заключение Таким образом, рассмотрев в трёх главах комплекс проблем и вопросов, поставленные во введении цель и задачи, можно подвести итоги и сделать выводы в рамках темы настоящей дипломной работы «Игровые моменты и опорные конспекты на уроках истории». Практика показала, что уроки истории с использованием игровых ситуаций, театрализованных форм и опорных конспектов, делая увлекательным ...
... - могут. Такие комбинированные продукты питания, которые содержат взаимодополняющие (комплементарные) белки, входят в состав традиционной кухни всех народов мира [5,6]. ГЛАВА 3. ЭКОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ИЗУЧЕНИЯ ТЕМЫ «АМИНОКИСЛОТЫ» Человеческое тело не может запасать белки, поэтому сбалансированное белковое питание требуется человеку каждый день. Взрослому человеку весом 82 кг требуется 79 г ...
... общие и специфические для данного класса цели и задачи урока, выбрать оптимальный методический путь для их достижения. Для иллюстраций возможностей вариативного построения урока выбрана тема «Соли аммония». Это самый обычный, рядовой урок, каких много в школьном курсе химии. Его содержание в основном отвечает тексту § и в учебнике IX класса, а не требует значительных дополнений. Урок «Соли ...
... выше, нежели в предыдущем. Пищевые продукты, выращенные и полученные при соблюдении необходимых условий, обычно характеризуются допустимым содержанием ртути [17]. Глава III. МЕТОДИЧЕСКИЕ РАЗРАБОТКИ ПО ТЕМЕ «ЭЛЕМЕНТЫ II ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д.И.Менделеева» Эксперимент начался со знакомства с ученическим коллективом. При этом для получения представления об успеваемости класса по химии ...





0 комментариев