Навигация
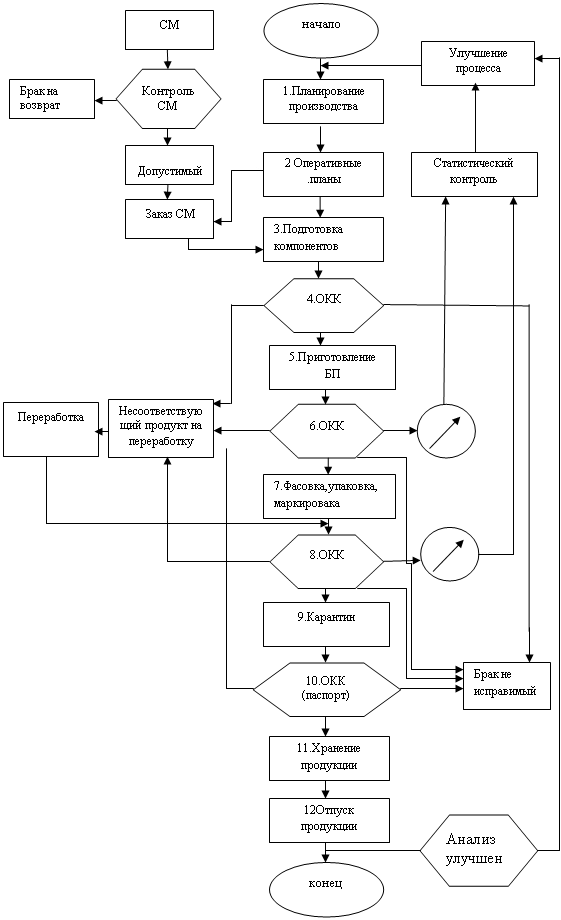
5. Управление качеством
Под управлением качеством (Quality Management) в фармацевтической промышленности понимают обеспечение надлежащего производства и контроля качества на всех этапах процесса производства лекарственных препаратов.
Понятия “Контроль качества” (Quality Control), “Правила правильного производства (GMP)” и “Обеспечение качества” (Quality Assurance) являются взаимосвязанными частями управления качеством.
5.1 Обеспечение качества
5.1.1.Обеспечение качества - это широко распространенная концепция, включающая комплекс мероприятий, которые оказывают влияние на качество готового продукта и гарантируют соответствие его требованиям нормативной документации. Система обеспечения качества включает в себя выполнение требований “Правил...”, в том числе и производственный контроль качества, а также другие требования, не включенные в них, а именно, “Правила доклинической оценки безопасности фармакологических средств” (“Good Laboratory Practice” - GLP), “Правила проведения клинических испытаний” (“Good Clinical Practice” - GCP).
Система обеспечения качества предназначена для того, чтобы фармацевтическое предприятие могло гарантировать, что:
-разработка, испытания и изготовление лекарственных препаратов проведены с учетом требований GLP, GCP и GMP;
-производство обеспечено утвержденными технологическими регламентами и методиками и/или инструкциями, учитывающими требования “Правил...”;
-четко определена ответственность руководящего персонала за качество готового продукта, что должно быть установлено должностными инструкциями;
-контроль качества исходного сырья, вспомогательных, упаковочных и маркировочных материалов проведены на стадиях их изготовления и/или поставки и перед применением в производстве;
-проведена регистрация всех производимых контрольных испытаний сырья, вспомогательных, упаковочных и маркировочных материалов, полупродуктов и готовых продуктов, постадийного контроля процесса производства, калибровки приборов и валидации;
-готовый продукт произведен в соответствии с утвержденными технологическими регламентами;
-реализация готового продукта осуществлена только после получения соответствующего разрешения руководителя отдела контроля качества;
-имеется документация, позволяющая контролировать условия хранения продукта в течение срока годности у производителя, а также при транспортировке и до реализации.
Фармацевтическое предприятие должно нести ответственность за качество выпускаемых им лекарственных средств и гарантировать соответствие их требованиям нормативной документации. Ответственность за производство готовых лекарственных средств необходимого качества возлагается на руководящий персонал и персонал, занятый на всех стадиях производства и контроля, что должно быть определено и зафиксировано в соответствующих нормативных документах предприятия.
5.2 «Правила правильного производства (GMP)»
“Правила...” являются составной частью системы обеспечения качества, гарантирующей, что производство и контроль осуществляются на предприятии согласно требованиям соответствующей документации. “Правила...” позволяют свести к минимуму риск производственных ошибок, которые не могут быть устранены или предотвращены только посредством контроля качества готового продукта. Наиболее часто встречаются ошибки двух типов:
-перекрестная контаминация;
-смешивание и/или перепутывание готовых продуктов.
“Правила...” предусматривают:
-четкую регламентацию всех производственных процессов и контроля процесса для подтверждения его пригодности для выпуска готовых лекарственных средств требуемого качества;
-проведение валидации всех стадий производства, которые могут оказывать влияние на качество продуктов и всех существенных изменений в нем;
-обеспеченность производства должным образом обученным и квалифицированным персоналом, необходимыми помещениями, соответствующим оборудованием и обслуживанием, сырьем, вспомогательными, упаковочными и маркировочными материалами необходимого качества, а также хранение сырья и материалов в соответствующих условиях и надлежащая транспортировка;
-наличие написанных четко и однозначно технологических регламентов и инструкций для каждого конкретного производства;
-обучение персонала надлежащему выполнению технологических операций;
-регистрацию всех этапов производства, подтверждающую, что все требуемые по регламенту операции были выполнены, а полученные продукты по количеству и качеству соответствуют установленным требованиям. Все отклонения должны быть тщательно зарегистрированы и изучены;
-хранение текущей производственной документации (отчетов о серии, маршрутных карт и др.), включая документацию по реализации готового продукта, что делает возможным в течение определенного времени проследить прохождение каждой серии продукции, в доступной форме в определенном месте;
-хранение и реализацию готового продукта таким образом, чтобы свести к минимуму возможность риска снижения качества;
-порядок возврата при необходимости любой серии готового лекарственного средства на стадии продажи или поставки с последующим анализом причин нарушения его качества и для предупреждения повторения выявленных недостатков.
Похожие работы
... и контролирует правильность оформления прописей для индивидуального производства лекарств. Ведет текущую и отчетную документацию. Проводит целевое фармацевтическое исследование аптек, других учреждений с целью оценки состояния контроля качества лекарственных средств при их изготовлении, транспортировке, хранении и отпуске. Экспресс-анализ лекарственных форм. Необходимость внутриаптечного ...
... настоящего стандарта обязательны для исполнения всеми участками процесса. Требования настоящего СТО распространяются на действия по производству лекарственного препарата Нитокс 200 и область возможного его улучшения. Сознательное нарушение требований настоящего стандарта организации является нарушением исполнительской дисциплины и может быть основанием для административного взыскания. 2. ...
... показателей и методов контроля качества Л С. Он должен обеспечивать разработку эффективного и безопасного Л С. Новый ОСТ предусматривает наличие двух категорий стандартов качества: I. Государственные стандарты качества лекарственных средств (ГСКЛС), к которым относятся: общая фармакопейная статья (ОФС) и фармакопейная статья (ФС); II. Стандарт качества (СКЛС); фармакопейная ...
... стратегические цели, принципы и задачи развития фармацевтической промышленности, ситуацию в отрасли, проблемы отрасли, способы и пути решения указанных проблем.[12] 7.Исследование доли выпускаемой продукции отечественных производителей в ассортименте товаров аптек базы практики. 7.1.Анализ доли препаратов ЗАО «Эвалар» В Аптеке ООО «Сатурн», расположенной по адресу: Республика Марий Эл, пгт. ...

0 комментариев