Навигация
Равновесие пар — жидкий раствор в системах с ограниченной взаимной растворимостью жидкостей
3.3.2 Равновесие пар — жидкий раствор в системах с ограниченной взаимной растворимостью жидкостей
Если система образована из двух летучих ограниченно смешивающихся жидкостей, то при испарении такой системы пар будет содержать оба компонента и находиться в равновесии с каждой из жидких фаз. Согласно правилу сосуществования фаз в гетерогенной системе две фазы, порознь находящиеся в равновесии с третьей фазой, равновесны и между собой. Следовательно, оба жидких раствора равновесны не только с паром, но и между собой. При равновесии химический потенциал каждого из компонентов гетерогенной системы во всех равновесных фазах одинаков:
![]() (13)
(13)
![]() (14)
(14)
При невысоких давлениях пар можно рассматривать как смесь идеальных газов. Тогда
![]() (15)
(15)
Поскольку при заданной температуре ![]() , то парциальное давление пара Рi одного и того же компонента над обеими равновесными жидкими фазами одинаково. Так как общее давление пара над раствором равно сумме парциальных давлений компонентов, то при равновесии над обоими жидкими слоями общее давление пара также одинаково. В расслаивающихся равновесных системах с изменением состава системы составы равновесных жидких фаз не изменяются.
, то парциальное давление пара Рi одного и того же компонента над обеими равновесными жидкими фазами одинаково. Так как общее давление пара над раствором равно сумме парциальных давлений компонентов, то при равновесии над обоими жидкими слоями общее давление пара также одинаково. В расслаивающихся равновесных системах с изменением состава системы составы равновесных жидких фаз не изменяются.
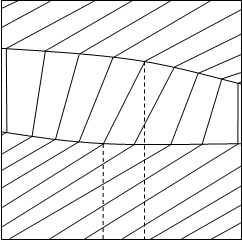
Следовательно, при постоянной температуре с изменением состава расслаивающейся системы парциальные давления отдельных компонентов и общее давление пара сохраняются постоянными (правило Коновалова). Характер изменения общего и парциальных давлений пара от состава раствора с ограниченной растворимостью жидкостей показан на рис. ниже. Заштрихованная область на диаграмме соответствует области расслоения при температуре Т. Пунктирными линиями Аb и Ва показан характер изменения парциальных давлений компонентов в системе, подчиняющейся закону Рауля. Кривые аСDВ и АFНb изображают изменения парциальных давлений пара компонентов А и В, кривая аКLb — изменение общего давления пара в зависимости от состава жидких фаз.
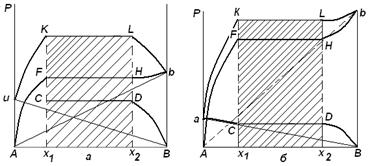
рис. зависимость общего и парциальных давлений пара от состава раствора в системах с ограниченной взаимной растворимостью жидкостей при Т=const. ![]()
Для изучения равновесия пар – жидкий раствор в системах с ограниченной взаимной растворимостью жидкостей, пользуются диаграммами состояния давление – состав и температура кипения – состав.
3.3.3 Равновесие пар—жидкий раствор в системах с взаимно нерастворимыми жидкостями
Совершенно несмешивающихся жидкостей не существует, так как любые жидкости в какой-то степени растворимы друг в друге. Однако если взаимная растворимость жидкостей ничтожно мала, то эти жидкости можно рассматривать как взаимно нерастворимые. В системах, состоящих из взаимно нерастворимых жидкостей, испарение каждой жидкости происходит независимо от присутствия другой, и давление пара каждого компонента при данной температуре сохраняется постоянным для любых соотношениях жидкостей. Температура кипения смеси из двух взаимно нерастворимых жидкостей ниже температур кипения чистых компонентов, так как общее давление паров (Р) над системой выше давления пара каждого из компонентов в отдельности (![]() и
и ![]() ) и равно
) и равно
![]() .
.
Если паровую фазу рассматривать как смесь идеальных газов, то в соответствии с законом Дальтона состав пара можно определить по уравнению
![]() ;
; ![]()
При заданной температуре пар такого состава изображается фигуративной точкой. Если составы исходной жидкой смеси и пара совпадают, то при изобарном испарении вся жидкость превращается в пар того же состава, а при конденсации такого пара образуются два жидких слоя, суммарный состав которых совпадает с составом исходной смеси. Если составы исходной смеси и пара различны, например жидкая смесь, то при давлении будут испаряться обе жидкости и образуется пар определенного состава. Дальнейшее испарение жидкого компонента приведет к изменению состава пара и к понижению давления над жидкостью. Во всем интервале давлений пар насыщен относительно одного компонента. После исчезновения жидкой фазы пар становится ненасыщенным относительно обоих компонентов и при неизменном составе будет перегреваться. При изотермическом сжатии пара рассмотренные стадии будут происходить в обратной последовательности. Таким образом, испарение и конденсация аналогичных смесей характеризуются наличием некоторого интервала давлений, в котором сосуществуют чистый жидкий компонент и паровая смесь.
Похожие работы
... MnY2S4 и фазы MgLn4S7 моноклинной сингонии. Условие существования фаз, характер плавления не известны. Ограниченность и неполнота литературных данных определяет актуальность задачи изучения фазовых равновесий в системе MgS – Y2S3. Глава 2. Методическая часть. 2.1. Методы физико-химического анализа Исходя из свойств полуторных сульфидов, таких, как термическая стабильность, летучесть, и ...
... Точками области 1 соответствует газообразное, области 2 - жидкое, области 3 - твердое состояние вещества. Плоскость ТР с указанными тремя кривыми равновесия называется диаграммой состояния. Диаграмма состояния позволяет судить, какие будут происходить фазовые превращения при том или ином процессе. Допустим, например, что производится нагревание при постоянном давлении. На диаграмме состояния такой ...
... равны удельным значениям энтропии, взятой с обратным знаком, и объеме: (4.30) Если в точках, удовлетворяющих фазовому равновесию: , первые производные химического потенциала для разных фаз испытывают разрыв: , (4.31) говорят, что термодинамическая система испытывает фазовый переход I-го рода. Для фазовых переходов первого рода характерно наличие срытой теплоты фазового перехода, ...
... как в азеотропных смесях коннода вертикальна, нода вырождается в точку. 3. Фазовые эффекты и уравнение Ван-дер-Ваальса для бинарных азеотропных смесей. Фазовые эффекты в бинарных азеотропных смесях. На рисунках 3.1 - 3.4 изображены диаграммы объем - состав фаз, и энтропия – состав фаз для азеотропа с минимумом температуры кипения. Если рассматриваемый состав равен составу ...

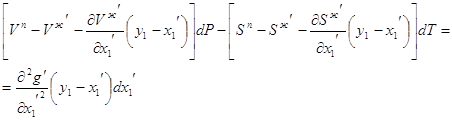
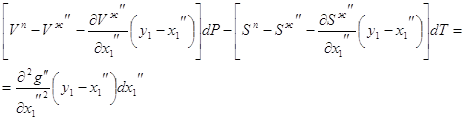
0 комментариев