Навигация
Равновесные состояния при фазовых переходах
3. Равновесные состояния при фазовых переходах
3.1 Равновесие газ—жидкий раствор в двухкомпонентных системах
При растворении газов в жидкостях устанавливается равновесие между жидкой фазой, содержащей растворитель и растворенный газ, и газовой фазой, содержащей данный газ и пары растворителя. Если растворитель относительно мало летуч, то установится равновесие между раствором и практически чистым растворяемым газом. Растворимость вещества определяется его концентрацией в насыщенном растворе. Растворимость газов в жидкостях зависит от природы растворяемого газа и растворителя, давления газа, температуры и от присутствия в растворе различных веществ, особенно электролитов. Числовое значение растворимости газа в жидкости зависит от способа ее выражения. Растворимость газов выражают числом граммов газа в 100 г чистого растворителя или в 100 г раствора, числом молей газа в 1000 г растворителя или в 1 л раствора, молярной долей. Кроме того, растворимость газов в жидкостях характеризуют коэффициентом растворимости о или коэффициентом поглощения ![]() . Коэффициент растворимости равен объему газа, выраженному в кубических метрах, растворенному в 1 м3 растворителя при данной температуре и приведенному к давлению
. Коэффициент растворимости равен объему газа, выраженному в кубических метрах, растворенному в 1 м3 растворителя при данной температуре и приведенному к давлению ![]() Па (1 атм). Коэффициент поглощения равен объему газа, выраженному в кубических метрах, растворенному в 1 м3 растворителя и приведенному к Р=
Па (1 атм). Коэффициент поглощения равен объему газа, выраженному в кубических метрах, растворенному в 1 м3 растворителя и приведенному к Р= ![]() Па (1 атм) и Т= 273 К. Отсюда
Па (1 атм) и Т= 273 К. Отсюда ![]()
3.1.1 Зависимость растворимости газов в жидкостях от природы газа и растворителя
Растворимость различных газов в одном и том же растворителе при одинаковых условиях изменяется в очень широких пределах. Растворимость газов повышается при химическом взаимодействии растворяемого газа с растворителем. На растворимость газов в жидкостях оказывает влияние и природа растворителя. Если растворители относятся к одному и тому же классу соединений, то растворимость газа часто мало зависит от индивидуальных свойств растворителя. В присутствии электролитов растворимость газов в жидкостях уменьшается. Так, при 298 К и ![]() Па в 1 м3 воды растворяется 0,01915 м3 водорода, а в 1 м3 3н NaОН — 0,0072 м3. Влияние электролитов на растворимость газов в водных растворах описывается уравнением И.М.Сеченова:
Па в 1 м3 воды растворяется 0,01915 м3 водорода, а в 1 м3 3н NaОН — 0,0072 м3. Влияние электролитов на растворимость газов в водных растворах описывается уравнением И.М.Сеченова:
![]()
где![]() и
и ![]() — растворимость газа в воде и в растворе электролита соответственно; k — постоянная, характерная для данного электролита; с — концентрация электролита, моль/л. Уменьшение растворимости газов в присутствии солей называется высаливанием. Высаливающее действие иона повышается с ростом заряда и уменьшается с увеличением радиуса иона. Уменьшение растворимости газов в присутствии электролитов объясняется в основном тем, что ионы притягивают молекулы воды и не притягивают неполярные и слабо поляризуемые молекулы газов, вследствие чего увеличивается фугитивность растворенного газа.
— растворимость газа в воде и в растворе электролита соответственно; k — постоянная, характерная для данного электролита; с — концентрация электролита, моль/л. Уменьшение растворимости газов в присутствии солей называется высаливанием. Высаливающее действие иона повышается с ростом заряда и уменьшается с увеличением радиуса иона. Уменьшение растворимости газов в присутствии электролитов объясняется в основном тем, что ионы притягивают молекулы воды и не притягивают неполярные и слабо поляризуемые молекулы газов, вследствие чего увеличивается фугитивность растворенного газа.
3.1.2 Зависимость растворимости газов в жидкостях от давления
Если газ химически не взаимодействует с растворителем, то зависимость растворимости газа в жидкости от давления выражается законом Генри. Закон Генри справедлив только тогда, когда растворение газа в жидкости не связано с процессами диссоциации или ассоциации молекул растворенного газа. При наличии диссоциации или ассоциации молекул закон Генри следует применять отдельно к каждому роду молекул, концентрации которых не произвольны, а связаны между собой законами химического равновесия и могут быть выражены через общую концентрацию газа в растворе. В этом случае общая концентрация газа уже сложным образом связана с давлением газа над раствором. Однако в ряде случаев пропорциональность сохраняется, и тогда закон Генри остается справедливым. С изменением давления газа растворимость различных газов меняется неодинаково, и подчинение закону Генри наблюдается лишь в области невысоких давлений. Различие в растворимости определяется взаимным влиянием отдельных газов друг на друга в газовой фазе и взаимным влиянием растворенных газов в жидкой фазе. При низких давлениях, когда взаимное влияние отдельных газов невелико, закон Генри справедлив для каждого газа, входящего в газовую смесь, в отдельности.
3.1.3 Зависимость растворимости газов в жидкостях от температуры
При небольших давлениях растворимость газов в жидкостях с повышением температуры обычно уменьшается. При высоких давлениях растворимость газов в жидкостях с ростом температуры может и увеличиваться. Так, например, растворимость водорода, гелия, неона и других газов в органических растворителях и водорода в жидком аммиаке увеличивается при повышении температуры. В ряде случаев растворимость газов в жидкостях с ростом температуры проходит через минимум. Количественную зависимость растворимости газов в жидкости от температуры можно найти из условий равновесия между раствором, содержащим растворенный газ, и газовой фазой, которая при малой летучести растворителя представляет собой чистый растворяемый газ. Эта зависимость выражается уравнением:
![]() (8)
(8)
где ![]() — изменение энтальпии в процессе перехода 1 моль газа из газообразного состояния в состояние насыщенного раствора или последняя теплота растворения. При низких температурах
— изменение энтальпии в процессе перехода 1 моль газа из газообразного состояния в состояние насыщенного раствора или последняя теплота растворения. При низких температурах ![]() т.е. растворимость газов в жидкостях уменьшается с ростом температуры. В области высоких температур
т.е. растворимость газов в жидкостях уменьшается с ростом температуры. В области высоких температур ![]() т.е. растворимость газов в жидкостях увеличивается с ростом температуры. При температуре, которой соответствует
т.е. растворимость газов в жидкостях увеличивается с ростом температуры. При температуре, которой соответствует ![]() = 0, растворимость газа в жидкости будет минимальной. В небольшом температурном интервале последняя теплота растворения
= 0, растворимость газа в жидкости будет минимальной. В небольшом температурном интервале последняя теплота растворения ![]() практически постоянна. Тогда в соответствии с уравнением (8) логарифм растворимости газа в жидкости линейно зависит от 1/Т:
практически постоянна. Тогда в соответствии с уравнением (8) логарифм растворимости газа в жидкости линейно зависит от 1/Т:

Похожие работы
... MnY2S4 и фазы MgLn4S7 моноклинной сингонии. Условие существования фаз, характер плавления не известны. Ограниченность и неполнота литературных данных определяет актуальность задачи изучения фазовых равновесий в системе MgS – Y2S3. Глава 2. Методическая часть. 2.1. Методы физико-химического анализа Исходя из свойств полуторных сульфидов, таких, как термическая стабильность, летучесть, и ...
... Точками области 1 соответствует газообразное, области 2 - жидкое, области 3 - твердое состояние вещества. Плоскость ТР с указанными тремя кривыми равновесия называется диаграммой состояния. Диаграмма состояния позволяет судить, какие будут происходить фазовые превращения при том или ином процессе. Допустим, например, что производится нагревание при постоянном давлении. На диаграмме состояния такой ...
... равны удельным значениям энтропии, взятой с обратным знаком, и объеме: (4.30) Если в точках, удовлетворяющих фазовому равновесию: , первые производные химического потенциала для разных фаз испытывают разрыв: , (4.31) говорят, что термодинамическая система испытывает фазовый переход I-го рода. Для фазовых переходов первого рода характерно наличие срытой теплоты фазового перехода, ...
... как в азеотропных смесях коннода вертикальна, нода вырождается в точку. 3. Фазовые эффекты и уравнение Ван-дер-Ваальса для бинарных азеотропных смесей. Фазовые эффекты в бинарных азеотропных смесях. На рисунках 3.1 - 3.4 изображены диаграммы объем - состав фаз, и энтропия – состав фаз для азеотропа с минимумом температуры кипения. Если рассматриваемый состав равен составу ...
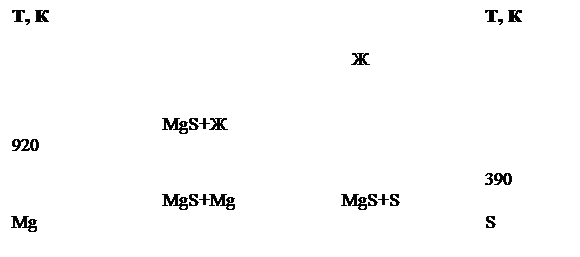

0 комментариев