Навигация
1.1.1 Нахождение в природе
Железо – один из самых распространенных элементов в природе, его содержание в земной коре составляет 4,65% по массе. Известно свыше 300 минералов, из которых слагаются месторождения железных руд. Промышленное значение имеют руды с содержанием Fe свыше 16%. Важнейшие рудные минералы железа: магнетит (магнитный железняк) Fe3O4 (содержит 72,4% Fe), гематит (железный блеск, красный железняк) Fe2O3 (70% Fe), гётит α-FeO(OH), или Fe2O3 * H2O, лепидокрокит g-FeO(OH) и гидрогётит (лимонит) Fe2O3 * H2O (около 62% Fe), сидерит FeCO3 (48,2% Fe), ильменит FeTiO3 (36,8% Fe). Наряду с полезными примесями - Mn, Cr, Ni, Ti, V, Co - железные руды содержат и вредные примеси - S, P и другие. Железо входит в состав природных силикатов, значительные скопления которых могут иметь промышленное значение для производства железа или его соединений. Различают такие основные типы железных руд: Бурые железняки – руды гидроксидов Fe(III), содержат до 66,1% Fe (чаще 30–55%), имеют осадочное происхождение. Гематитовые руды, или красные железняки (главный минерал - гематит), содержат обычно 50–65% Fe. Для них характерно залегание богатых руд поверх мощных толщ бедных (30–40% Fe) магнетитовых кварцитов. Магнетитовые руды, или магнитные железняки (главный минерал – магнетит), содержат чаще всего до 45–60% Fe. Верхние горизонты магнетитовых рудных тел обычно частично окислены до гематита (полумартиты и мартиты). Силикатные руды (25-40% Fe) осадочного происхождения, относятся к группе зеленых слюд-хлоритов. Главные минералы - шамозит Fe4(Fe, Al)2[Al2Si2O10](OH)8 и тюрингит (Mg, Fe)3,5Al1,5[Si2,5Al1,5O10](ОН)6*nН2О – содержат до 42% Fe. Мировые разведанные запасы железных руд составляют 231,9 млрд. т, или 93 млрд. т в пересчете на железо. Перспективно использование бедных железом горных пород и железомарганцевых конкреций. Их мировые запасы оцениваются в 3000 млрд. т. В чрезвычайно редких случаях железо встречается в земной коре в составе минерала иоцита FeO, а также в виде самородного железа – метеоритного и теллурического (земного происхождения). Теллурическое железо образуется в результате восстановления оксидов и сульфидов железа углеродом из железистой магмы и при подземных пожарах угля, контактирующего с пластами руды. [1].
1.1.2 Характеристика простого вещества
Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами.
Для железа характерен полиморфизм, он имеет четыре кристаллические модификации:
— до 769 °C существует α-Fe (феррит) с объемно-центрированной кубической решёткой и свойствами ферромагнетика (769 °C ≈ 1043 K — точка Кюри для железа)
— в температурном интервале 769—917 °C существует β-Fe, который отличается от α-Fe только параметрами объемно-центрированной кубической решётки и магнитными свойствами парамагнетика
— в температурном интервале 917—1394 °C существует γ-Fe (аустенит) с гранецентрированной кубической решёткой
— выше 1394 °C устойчив δ-Fe с объемно-центрированной кубической решёткой
Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря α—γ переходам кристаллической решётки происходит термообработка стали. Без этого явления железо как основа стали не получило бы такого широкого применения.
Железо тугоплавко, относится к металлам средней активности. Температура плавления железа 1539 °C, температура кипения — 2862 °C.
1.1.3 Промышленное получение металлического железа
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (Fe3O4). Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
В печи углерод кокса окисляется до монооксида углерода (угарного газа) кислородом воздуха:
2C + O2 → 2CO↑.
В свою очередь, угарный газ восстанавливает железо из руды:
3CO + Fe2O3 → 2Fe + 3CO2↑.
Флюс добавляется для извлечения нежелательных примесей из руды, в первую очередь силикатов, таких как кварц (диоксид кремния). Типичный флюс содержит известняк (карбонат кальция) и доломит (карбонат магния). Против других примесей используют другие флюсы.
Действие флюса: карбонат кальция под действием тепла разлагается до оксида кальция (негашёная известь):
CaCO3 → CaO + CO2↑.
Оксид кальция соединяется с диоксидом кремния, образуя шлак:
CaO + SiO2 → CaSiO3.
Шлак, в отличие от диоксида кремния, плавится в печи. Более лёгкий, чем железо, шлак плавает на поверхности, и его можно сливать отдельно от металла. Шлак затем употребляется в строительстве и сельском хозяйстве. Расплав железа, полученный в доменной печи, содержит довольно много углерода (чугун). Кроме случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Излишний углерод и другие примеси (сера, фосфор) удаляют из чугуна окислением в мартеновских печах или в конвертерах. Электрические печи используют и для выплавки легированных сталей.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, содержащими водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями как сера и фосфор — обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
Похожие работы
... их спектральных линий с коррекцией фона и возможных спектральных наложений. Соответственно такие анализаторы отличаются высокой точностью и продуктивностью.[3-7] 2. ПРИМЕРЫ ИСПОЛЬЗОВАНИЯ МЕТОДА В АНАЛИЗЕ ПОЧВ Определение тяжелых металлов атомно-абсорбционным методом Методика предназначена для выполнения измерений массовой концентрации металлов (марганца, меди, железа, цинка, молибдена) в ...
... (коэффициентом пропускания) или прозрачностью раствора. Взятый с обратным знаком логарифм T называют светопоглощением, поглощением или абсорбционностью (А). Обозначение А соответствует первой букве в названии этой величины (ранее которую называли оптической плотностью и обозначали D). . Уменьшение интенсивности света при прохождении через окрашенный раствор подчиняется закону Бугера-Ламберта- ...
... и природы вещества, участвующего в электрохимической реакции. Электрохимические параметры при этом служат аналитическими сигналами, при условии, что они измерены достаточно точно. Электрохимические методы анализа в практику химического анализа вошли сравнительно давно и занимают в ней важную роль. Впервые потенциометрическое титрование было проведено в 1893 г. в институте Оствальда в Лейпциге, а ...
... . Это дает возможность элементного анализа вещества: определение количества атомов каждого элемента, входящего в состав образца. ГЛАВА 2. ОБЛАСТИ ПРИМЕНЕНИЯ ФЛУОМЕТРИИ В АНАЛИЗЕ ОБЪЕКТОВ ОКРУЖАЮЩЕЙ СРЕДЫ Сегодня люминесцентный метод анализа охватывает широкий круг методов определения разнообразных объектов от простых ионов и молекул до высокомолекулярных соединений и биологических объектов. ...






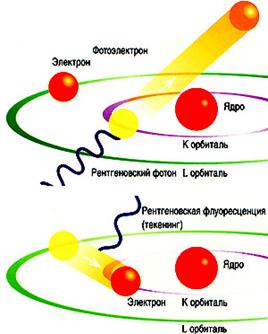
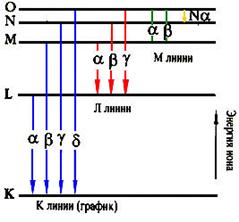


0 комментариев