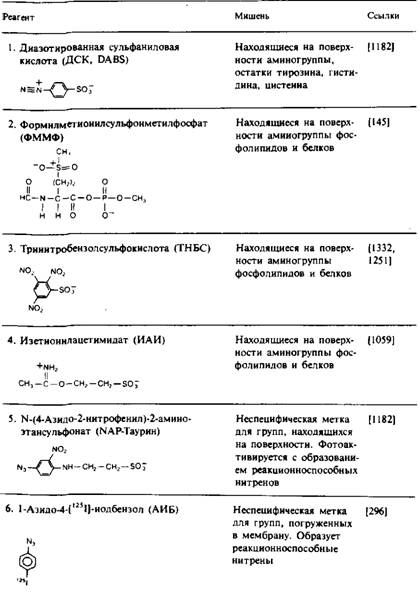
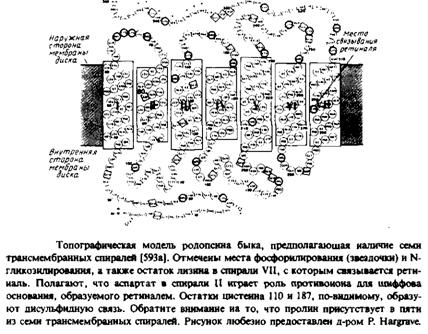
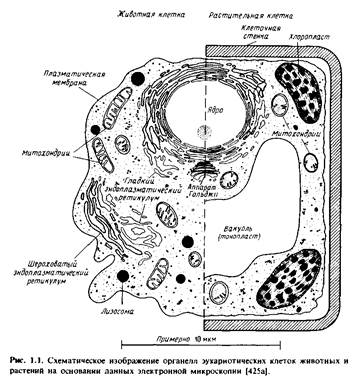
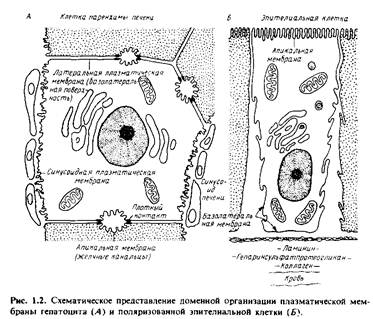
Навигация
Динамические свойства остова мембранных белков и их боковых цепей
5.3 Динамические свойства остова мембранных белков и их боковых цепей
Проводя ЯМР-исследования твердых образцов, можно получить детальную информацию о динамических свойствах отдельных аминокислотных остатков мембранных белков. Однако при этом необходимы большие количества препарата равномерно меченного белка. Наиболее информативным этот метод является в случае небольших белков, когда можно проводить спектроскопические измерения. Возможности этих методов иллюстрируют работы по исследованию белков оболочки нитевидных бактериофагов. При вирусной инфекции эти белки встраиваются в плазматическую мембрану Е. соН с помощью единственной трансмембранной спирали, а во время сборки фага липиды и белки клетки-хозяина исключаются из его оболочки. Малый размер белков оболочки, возможность получения их в больших количествах и легкость выделения создают значительные преимущества при их изучении методом ЯМР, а также другими методами.
Для исследования динамических свойств аминокислотных остатков белка оболочки фага fd в реконструированных фосфолипидных бислоях использовались методы 2Н- и 15N-flMP. Результаты показали, что полипептидный остов на участке от 5-го до 43-го остатков включительно относительно жесткий, при этом данный сегмент превосходит по длине участок, находящийся внутри липидного бислоя. Несколько остатков на концах полипептида свободны и могут совершать движения с большой амплитудой. Большинство боковых цепей в состоянии совершать такие движения, даже когда соответствующие остатки находятся внутри бислоя.
Работы, в которых использовались упомянутые методы, слишком немногочисленны для того, чтобы можно было составить полное представление о характере влияния липидно-белковых взаимодействий на внутреннюю динамику мембранных белков.
5.4 Связывание периферических мембранных белков с липидным бислоем
При изучении липидно-белковых взаимодействий основное внимание уделялось трансмембранным белкам, однако в последнее время проявляется все больший интерес к связыванию с бислоем периферических мембранных белков. Многие такие белки связываются с мембраной главным образом через взаимодействие с интегральными белками. Но существует большая группа разнообразных белков, которые связываются непосредственно с поверхностью липидного бислоя. Некоторые из этих белков, например основный белок миелиновой оболочки, спектрин и матриксный белок вируса везикулярного стоматита, играют в основном структурную роль. Множество растворимых белков связываются с поверхностью мембраны на непродолжительное время или при специфических условиях. В некоторых случаях связывание белка является необходимым условием проявления его ферментативной активности; такими белками являются, например, протеинкиназа С, факторы свертывания крови, пируватоксидаза. Еще одним примером белков, связывающихся с поверхностью бислоя, служат амфифильные пептидные гормоны и, возможно, сигнальные последовательности, которые ответственны за перемещение секретируемых или мембранных белков в нужное место.
По-видимому, существует два основных, не исключающих друг друга типа связывания белков с липидами: 1) связывание осуществляется при участии амфифильной структурной единицы, обычно а-спирали. Эта вторичная структура может индуцироваться и стабилизироваться при взаимодействии с липидами; 2) связывание имеет в основном электростатическую природу и осуществляется при участии положительно заряженного участка белковой молекулы и кислых фосфолипидов. При этом значительную роль могут играть гидрофобные взаимодействия, зависящие от того, насколько глубоко белок проникает в бислой. Во многих случаях для связывания с кислыми фосфолипидами необходим Са2+, но истинная роль этого двухвалентного катиона точно не определена.
Взаимодействие периферических мембранных белков с фосфолипидами изучали многими методами. Так, за связыванием белков с везикулами можно следить с помощью светорассеяния или путем измерения флуоресценции белков, при этом можно определить константы диссоциации. Возмущения в бислое, вызванные связыванием с ним белков, можно выявить по изменению проницаемости везикул или параметров температурного фазового перехода липидов, хотя анализировать эти результаты на молекулярном уровне довольно трудно. Весьма полезным оказалось также изучение монослоев, при этом степень проникновения белка в монослой можно оценить по изменению площади поверхности монослоя после внедрения белка.
Для получения детальной информации на молекулярном уровне одним из наиболее ценных методов оказался ЯМР. С помощью ЯМР были детально проанализированы последствия взаимодействия липидного бислоя с основным белком миелиновой оболочки и цитохромом с. Оба этих белка взаимодействуют с кислыми липидами главным образом электростатически, хотя физиологическая роль такого взаимодействия цитохрома с с липидами неясна. В отличие от трансмембранных белков два указанных периферических белка значительно различаются по взаимодействию с фосфолипидами. Так, при изучении везикул, содержащих димиристоил-фосфатидилглицерол и фосфатидилхолин, обнаружилось, что основный белок миелиновой оболочки специфически взаимодействует с первым из этих липидов. Исследования методом инфракрасной спектроскопии с фурье-преобразованием показывают, что при связывании с фосфатидилглицеролом белок приобретает высокоупорядоченную вторичную структуру; в основном он образует /3-слой, который в отсутствие этого липида не наблюдается. По данным 2Н-ЯМР белково-липидные взаимодействия приводят к существенному изменению упаковки полярных головок кислых фосфолипидов. Сходные работы, выполненные на цитохроме с с использованием метода 2Н-ЯМР, показали, что при связывании с этим белком происходят лишь небольшие изменения в упаковке головок фосфатидилсерина; в этих опытах использовались везикулы, содержащие также фосфатидилхолин. В обеих системах не наблюдалось никакого латерального разделения фаз и происходил быстрый обмен между свободными и связанными с белками липидами. Однако с другими кислыми фосфолипидами цитохром с взаимодействует по-разному. Например, в везикулах, содержащих кардиолипин и фосфатидилхолин, он вызывает латеральное разделение фаз, а в везикулах, содержащих кардиолипин и фосфатидилэтаноламин, стабилизирует иебислойные структуры.
Итак, по-видимому, типы взаимодействия между периферическими мембранными белкам и фосфолипидным бислоем весьма разнообразны.
Резюме
Чтобы до конца установить функции биологических мембран, необходимо изучить динамические свойства их компонентов. Для измерения скорости вращения липидов и белков внутри мембраны и скорости латеральной диффузии этих компонентов в плоскости мембраны были разработаны специальные спектроскопические методы. Они основаны на использовании спиновых или флуоресцентных зондов, которые встраиваются в мембрану или связываются с конкретными белками. Как правило, мембранные липиды могут свободно диффундировать в плоскости мембраны со скоростью, сравнимой со скоростью их диффузии в модельных мембранах. Напротив, латеральное движение интегральных белков в биологических мембранах часто ограничено. Это может быть связано с их ассоциацией с другими мембранными белками или с элементами цитоскелета либо внеклеточного матрикса. Многие белки способны свободно вращаться в плоскости мембраны, но это вращение также может быть затруднено из-за образования белковых агрегатов.
В любой момент времени с белком в биологической мембране соседствует значительная доля липидов. Слой липидов, непосредственно прилегающих к белку, называется пограничным. Эти липиды очень быстро обмениваются с основной массой липидов бислоя, и обычно вероятность нахождения тех или иных липидов по соседству с белком или в основной липидной фракции почти одинакова. Правда, для некоторых белков характерна определенная избирательность в связывании с липидами, но для всех известных случаев различие в связывании, измеряемое сродством липидов к пограничному слою, не превышает пяти. И даже такая слабая избирательность может приводить к тому, что липидный состав пограничного слоя будет отличаться от состава основной липидной фазы.
Похожие работы
... является курсом, для изучения которого необходимо наличие знаний об основных принципах организации биологических молекул, строении и механизмах действия ферментов. Дисциплина биохимия мембран относится к дисциплинам специализации федерального компонента. 5. Распределение времени, отведенного на изучение дисциплины по учебному плану Форма учебной работы Форма обучения Очная По ...
... Рисунок Кинетика биопроцессов Динамические свойства биопроцессов Каждая система состоящая из элементов будет характеризоваться динамикой, складывающейся из элементов. Кинетика биопроцессов – раздел биофизики, изучающий динамические свойства биопроцессов. 1. Параметры, меняющие свое значение со временем. Переменные величины: численность клеток, биомасса, концентрация ...
... и индуцируют трансмембранную миграцию липидных молекул, поэтому полученные результаты бывает трудно интерпретировать. Детальная оценка достоинств и недостатков методов изучения липидной асимметрии в мембранах дается, например, в обзорах. МЕТОДЫ УСТАНОВЛЕНИЯ ТРАНСМЕМБРАННОГО РАСПРЕДЕЛЕНИЯ ЛИПИДОВ Химическая модификация фосфолипидов Относительно легко подвергаются химической модификации только ...
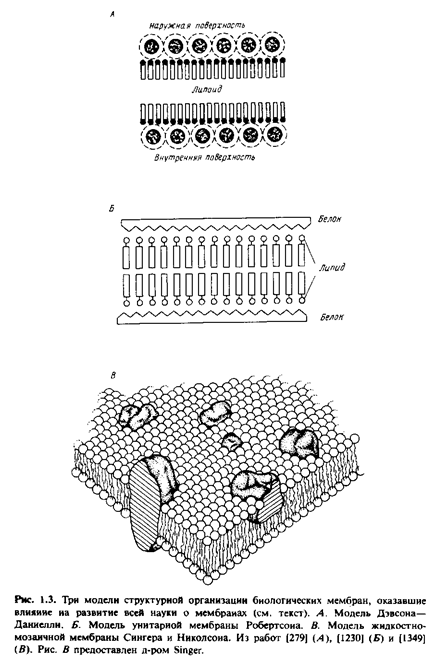
... правильным только благодаря взаимной компенсации ошибок, однако в историческом плане эта работа имела большое значение, поскольку с тех пор концепция липидного бислоя как структурной основы биологических мембран стала доминирующей и на самом деле оказалась верной. Концепция бимолекулярной липидной мембраны получила дальнейшее развитие в предложенной в 1935 г. модели Дэвсона-Даниелли, или ...



0 комментариев