Навигация
Прогестерон
1.3.2. Прогестерон
Прогестерон относится к прогестинам, или гестагенам (лат. gestatio – беременность), то есть к гормонам, благоприятствующим развитию беременности. По химическому строению принадлежит к прегнановой (С21) группе.
Синтез и секреция прогестерона осуществляется желтым телом яичников под влиянием ЛГ. При беременности (после 6-8 недель) основным источником данного гормона становится плацента, продуцирующая на поздних стадиях в 30-40 раз больше прогестерона, чем желтое тело [32]. Кроме того, как известно, прогестерон является промежуточным продуктом при синтезе многих других стероидных гормонов (андрогенов, минералокортикоидов, глюкокортикоидов). Поэтому немаловажную роль в создании общего пула прогестерона в крови играют надпочечники. Здесь секреция прогестерона находится под контролем АКТГ [40]. В плазме крови значительная часть прогестерона связывается с транскортином (кортикостероид-связывающий белок, синтез которого осуществляется в печени), альбумином и оросомукоидом [32, 27]. Биологической активностью, как и в случае с тестостероном, обладает свободная (несвязанная) форма гормона. Количество прогестерона в плазме изменяется в широких пределах (у человека от 0,3 до 15 пг/мл [27]) и зависит от фазы эстрального цикла. Период полураспада прогестерона в плазме крови составляет 90-105 мин [42].
Некоторые исследователи [40] отмечают, что изменение уровня прогестерона в крови в течение эстрального цикла обусловлено секрецией прогестерона надпочечниками. Максимальная концентрация достигается после овуляции, а именно после спада овуляторной волны ЛГ. С другой стороны предполагают, что именно прогестерон надпочечников является стимулятором овуляторной волны ЛГ [40]. Необходимо отметить определенную взаимосвязь в синтезе надпочечниками прогестерона и других стероидов. В стадии проэструса, когда происходит выброс овуляторной волны ЛГ, концентрация глюкокортикоидов достигает своего максимального значения [40]. Известно также, что глюкокортикоиды повышают чувствительность яичников к гонадотропинам (ЛГ и ФСГ) как у взрослых, так и у неполовозрелых животных [40]. Кроме того, концентрация прогестерона в плазме крови изменяется в течение суток. Эти изменения в основном сопадают с циркадным ритмом кортикостерона [32, 40]. Подобное совпадение, по всей вероятности, обусловлено суточным ритмом высвобождения АКТГ [32]. С другой стороны, у сокола Falco cherrug обнаружена обратная взаимосвязь между уровнем прогестерона и кортикостерона в крови [47].
Прогестерон инактивируется в печени, где образует ряд соединений. Основной путь метаболизма – восстановление, с образованием прегнандиола [24, 32]. Через почки выводится, главным образом, в виде прегнандиол-20-глюкуронида натрия.
Главный физиологический эффект прогестерона заключается в подготовке эндометрия, путем разрыхления субгландулярной стромы, к имплантации бластоцита и создании благоприятных условий для его развития [24, 27, 39]. Кроме того, прогестерон расслабляет гладкую мускулатуру матки и понижает ее чувствительность к окситоцину [24, 27, 39]. Экзогенный прогестерон способствует увеличению уровня свободного холестерина в плазматических мембранах клеток, что вызывает изменение свойств последних (увеличивается вязкость, уменьшается проницаемость для ионов и молекул) [41]. Ткачева Н.Ю. объясняет данный эффект стимулирующим влиянием прогестерона на липогенез в печени и жировой ткани, повышением липопротеинлипазной активности, ингибированием липолиза, а также возможным участием в этом процессе инсулина (при введении прогестерона наблюдается повышение секреции инсулина) [41, 137]. Таким образом, действие прогестерона на жировую ткань противоположно эффекту тестостерона [67].
Прогестерон in vitro ингибирует секрецию катехоламина, вызванную ацетилхолином или никотином в клетках мозгового слоя надпочечников, возможно через блокаду притока Ca2+ [86]. In vitro этот гормон увеличивает содержание в олигодендроцитах основного миелинового пептида и циклонуклеотидфосфодиэстеразы [164]. Кроме этого, in vitro рассматриваемый половой стероид способен (в зависимости от дозы) снижать уровни мРНК рецепторов эстрадиола, андрогенов и своих собственных в клетках стромы эндометрия [162]. Он способен снижать продукцию тестостерона у эмбрионов (при этом увеличивается уровень циркулирующего ЛГ) [228]. Прогестерон стимулирует реинициацию, дальнейшее развитие и мейоз ооцитов in vitro [243]. Он также активирует продукцию цАМФ и цГМФ в клетках яичников свиньи [244] и ингибирует секрецию пролактин-подобного пептида клетками яичников [245]. Этот гормон ингибирует активность 5a-редуктазы в коже гениталий [79]; повышает активность 11β-гидроксистероид-дегидрогеназы в норме и у адреноэктомированных крыс [218] и ингибирует активность N-деметилазы, участвующей в N-деметилировании этилморфина [127]. Прогестерон оказывает влияние и на иммунный ответ организма. В частности, контролирует способность макрофагов участвовать в иммунном ответе [204].
Прогестерон in vivo ингибирует продукцию окситоцина в гипофизе [32], но in vitro в физиологических дозах стимулирует секрецию этого пептида в фолликулах [274]. У самок, перед родами, увеличение уровня мРНК окситоцина в паравентрикулярном и супраоптическом ядрах гипоталамуса связано со спонтанным спадом уровня прогестерона. В то же время уровень мРНК Arg8-вазопрессина в этих отделах гипоталамуса не подвержен влиянию уменьшения уровня прогестерона [266].
Прогестерон вместе с эстрогенами препятствует началу лактации во время беременности, блокируя действие пролактина на молочные железы [39]. Рассматриваемый гормон увеличивает аккумуляцию кальцитонин-ген-зависимого пептида в ядрах троиничного нерва [208].
Прогестерон увеличивает как связывание, так и деградацию инсулина в гепатоцитах, причем увеличение деградации превышает увеличение связывания [167].
In vivo рассматриваемый гормон способствует снижению базального уровня интерлейкина-6 [52] и высвобождению интерлейкина-1 [174]. При этом in vitro уменьшает индуцированное интерлейкином-1 разрушение хрящей [88]. С другой стороны, интерлейкин-1β в культуре клеток гранулезы яичника крысы стимулирует деградацию прогестерона [99].
Эндогенный прогестерон играет определенную роль в контроле активности раковых новообразований [51, 70]. В частности, через свои ядерные рецепторы он регулирует рост и развитие рака груди [231], индуцирует дозозависимое увеличение уровня фактора роста сосудистого эндотелия и ”простатического специфического антигена” в клетках Т47-D рака груди [29, 157].
Прогестерон модулирует активность цистиновой аминопептидазы как у самок, так и у самцов [191].
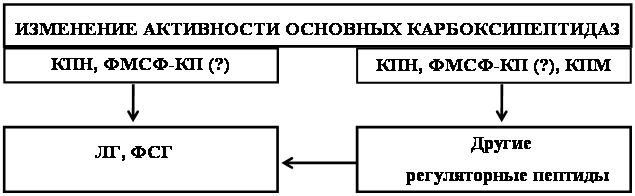
Таким образом, факты, свидетельствующие о влиянии тестостерона и прогестерона на функционирование пептидергических систем [2, 67, 167, 175, 213, 214, 245, 274, 266, 277 и др.], а также на активность некоторых протеолитических ферментов [24, 67, 127, 191 и др.], позволяют предположить, что эти половые стероиды могут участвовать в регуляции обмена нейропептидов. В связи с этим представляет интерес изучение активности ферментов обмена нейропептидов: КП Н и ФМСФ-ингибируемой КП при введении тестостерона и прогестерона.
Гонады (семенники и яичники) являются основными источниками половых стероидов в организме. Регуляция функции половых желез происходит под влиянием гормонов аденогипофиза – фоллитропина (фолликулостимулирующий гормон, ФСГ) и лютропина (лютеинизирующий гормон, ЛГ) [24, 27, 32, 39, 42]. Первый осуществляет морфофункциональную регуляцию, то есть усиливает деятельность клеток Сертоли (в семенниках) и активирует развитие фолликулов (в яичниках), что способствует выработке сперматозоидов и яйцеклеток. ЛГ ответственен непосредственно за выработку мужских и женских половых гормонов: андрогенов, эстрогенов и прогестинов [27, 32]. В то же время, синтез ФСГ и ЛГ контролируется гонадотропин-рилизинг-фактором (ГнРФ). Секреция последнего регулируется по принципу длинной (половые гормоны ингибируют секрецию ГнРФ), короткой (ингибиторное влияние гонадотропинов) и ультракороткой (гонадотропин-рилизинг фактор ингибирует свою собственную секрецию) обратной связи [27, 32, 63, 145]. Поэтому гипоталамус, гипофиз и половые железы объединяют в одну систему – гипоталамо-гипофизарно-гонадную (ГГГС) [24, 27, 39, 42].
С другой стороны, в надпочечниках также синтезируются тестостерон и прогестерон [27, 32]. Синтез стероидных гормонов надпочечников находится под влиянием кортикотропина. Следует отметить, что АКТГ стимулирует синтез не только кортикостероидов, но и половых гормонов [40, 32]. Секреция АКТГ, в свою очередь, зависит от синтеза кортиколиберина – рилизинг фактора гипоталамуса [27, 32, 39]. Принцип регуляции синтеза и секреции этого нейрогормона такой же, как и в случае ГнРФ, то есть половые гормоны, гонадотропины и сам АКТГ ингибируют высвобождение этого нейрогормона [24, 32, 39]. Поэтому гипоталамус, гипофиз и надпочечники объединяют в гипоталамо-гипофизарно-надпочечниковую систему (ГГНС) [24, 27, 42].
Таким образом, при исследовании влияния половых гормонов, ГГГС и ГГНС можно рассматривать как единую гипоталамо-гипофизарно-надпочечниково-гонадную систему (ГГНГС).
Следует также отметить, что в гипофизе и гипоталамусе обнаружена высокая активность КП Н, а в надпочечниках и половых железах – высокая активность ФМСФ-ингибируемой КП у многих видов животных [12, 44, 45, 81, 117, 122, 165, 180, 222, 225, 256, 262 и др.]. Именно поэтому активность ферментов определяли в гипоталамусе, гипофизе, надпочечниках и половых железах самцов и самок мышей.
ГЛАВА 2. МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1. Материал исследования
Опыты проводили на самках и самцах белых беспородных мышей в возрасте 90-100 дней. Использовали следующие препараты половых стероидных гормонов: пропионат тестостерона (АО ”Эмпилс” завод ”Фармадон”, г. Ростов-на-Дону), прогестерон (АО ”Эмпилс” завод ”Фармадон”, г. Ростов-на-Дону), а также оливковое масло. В качестве специфических ингибиторов применяли ФМСФ (Serva”, США) и ГЭМЯК (“Serva”, США). Все остальные реактивы были отечественного производства с квалификацией ”ХЧ” и ”ОСЧ”.
Похожие работы
... нервной и эндокринной регуляции в организме // Усп. совр. биол. – 1981. – 19, № 3. – С. 380-382. 23. Вернигора А.Н., Бардинова Ж.С., Сметанин В.А., Генгин М.Т. Активность основных карбоксипептидаз в тканях самок крыс на разных стадиях эстрального цикла // Укр. биохим. журн. – 2003. – 75, № 5. – С. 99-102 24. Вернигора А.Н. Карбоксипептидаза Н мозга животных в норме и при действии стресс- ...
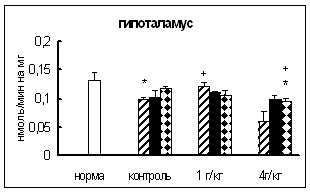
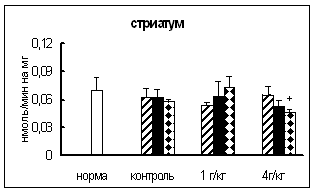
... о динамике изменения активности ферментов. ГЛАВА 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 3.1. Исследование активности основных карбоксипептидаз в тканях крыс разного возраста, испытавших пренатальное воздействие этанола 3.1.1. Исследование активности карбоксипептидазы Н в тканях пренатально алкоголизированных крыс разного возраста Согласно данным дисперсионного анализа пренатальное воздействие ...

0 комментариев