Навигация
Активность основных карбоксипептидаз у самцов мышей при введении тестостерона и прогестерона
3.3. Активность основных карбоксипептидаз у самцов мышей при введении тестостерона и прогестерона
В связи с отсутствием зависимости изменения активности КП Н и ФМСФ-ингибируемой КП от дозы вводимого гормона у самок, у самцов активность ферментов исследовалась только при введении тестостерона в дозе 3 мг на кг массы и прогестерона в дозе 1 мг на кг массы.
3.3.1. Активность карбоксипетидазы Н и ФМСФ-ингибируемой карбоксипептидазы при введении тестостерона в тканях самцов мышей
Результаты исследования активности КП Н в ГГНГС самцов при введении тестостерона в дозе 3 мг на кг массы представлены на рис. 3.3.1. Через 0,5 и 4 ч после инъекции активность фермента в гипофизе по сравнению с контрольными самцами была ниже примерно на 40%. В гипоталамусе и надпочечниках на все исследованные временные интервалы активность КП Н не отличалась от контроля. В семенниках активность исследуемой карбоксипептидазы через 4 ч была в 1,9 раза выше, а через 0,5 и 24 ч не отличалась от таковой у контрольных животных.
Данные об изменении активности ФМСФ-ингибируемой КП при введении тестостерона в дозе 3 мг на кг массы представлены на рис. 3.3.2. По сравнению с контрольной группой, статистически достоверное увеличение активности ФМСФ-ингибируемой КП обнаружено только в гипофизе (на 21%) через 24 ч. В остальных отделах ГГНГС самцов изменений активности ФМСФ-ингибируемой КП не выявлено.
Таким образом, при введении тестостерона в дозе 3 мг на кг массы в гипофизе самцов активность КП Н снижалась в начальный период времени (0,5-4 ч), в то время как активность ФМСФ-ингибируемой КП повышалась через 24 ч.
3.3.2. Активность карбоксипетидазы Н и ФМСФ-ингибируемой карбоксипептидазы при введении прогестерона в тканях самцов мышей
При введении прогестерона в дозе 1 мг на кг массы, в гипофизе через 0,5 ч активность КП Н была на 25% ниже, чем у контрольных самцов (рис. 3.3.3). В остальных отделах ГГНГС самцов изменений активности этого фермента не обнаружено.
У самцов, которым вводили прогестерон, активность КП Н в семенниках через 0,5 ч была в 3,3 раза выше, а через 4 и 24 ч – в 1,5-2 раза ниже, чем у животных, которым вводили тестостерон в дозе 3 мг на кг массы (рис. 3.3.3). В остальных отделах ГГНГС самцов отличий между активностью КП Н после введении тестостерона или прогестерона не обнаружено.
Прогестерон достоверно увеличивал активность ФМСФ-ингибируемой КП по отношению к контрольным животным в надпочечниках через 0,5 ч на 28%, а в семенниках – через 0,5 и 4 ч после инъекции, примерно, на 40% (рис. 3.3.4).
После введения прогестерона в гипоталамусе, гипофизе и надпочечниках влияния времени после инъекции на активность как КП Н, так и ФМСФ-ингибируемой КП не обнаружено (таблица 3.3.1). В семенниках время после инъекции достоверно влияло на активность КП Н: активность плавно снижалась к 24 ч.
Достоверной зависимости активности КП Н и ФМСФ-ингибируемой КП от времени после введении тестостерона во всех отделах ГГНГС самцов не обнаружено (таблица 3.3.1).
3.4. Активность карбоксипетидазы Н и ФМСФ-ингибируемой карбоксипептидазы in vitro при действии тестостерона и прогестерона
Для выяснения механизма действия тестостерона и прогестерона на активность основных карбоксипептидаз в ГГНГС мышей in vivo было исследовано влияние данных половых стероидов in vitro (таблица 3.4).
Исходя из полученных данных можно сделать вывод, что ни один из гормонов не влияет на активность исследуемых ферментов. Другими словами, прямое влияние тестостерона или прогестерона на молекулы КП Н и ФМСФ-ингибируемой КП, по-видимому, исключено.
Вместе с тем, в опытах in vivo активность обоих ферментов изменялась при введении гормонов. Следовательно, влияние тестостерона и прогестерона in vivo на активность КП Н и ФМСФ-ингибируемой КП опосредуется какими-то внутриклеточными механизмами.
Сопоставление результатов дисперсионного анализа влияния времени после введения у самцов и самок (таблица 3.5.1) позволяет заключить, что тестостерон не влияет на динамику активности КП Н ни у самцов, ни у самок. В то же время, во влиянии прогестерона на активность КП Н в половых железах выявлены отличия: в яичниках гормон не влиял на динамику изменения активности, а в семенниках наблюдалось плавное снижение активности КП Н. Следует отметить, что в надпочечниках ни одно из вводимых веществ достоверно не влияло на динамику активности КП Н у животных обоего пола.
Результаты дисперсионного анализа влияния времени на активность ФМСФ-ингибируемой КП в тканях самцов и самок при введении различных веществ представлены в таблице 3.5.2. Достоверного влияния времени на активность ФМСФ-ингибируемой КП ни в одном отделе ГГНГС самцов не обнаружено.
С другой стороны, практически во всех изученных случаях наблюдается статистически значимая временная динамика активности ФМСФ-ингибируемой КП в тканях самок (таблица 3.5.2). При введении оливкового масла во всех отделах ГГНГС, исключая гипофиз, наблюдается повышение активности фермента к 0,5 ч и снижение к 4 ч. В интервале 4-24 ч активность ФМСФ-ингибируемой КП не изменялась. При введении оливкового масла активность исследуемого фермента была постоянной в интервале 0,5-24 ч. Оба половых гормона влияли на динамику активности исследуемого фермента в гипофизе, по сравнению с таковой при введении оливкового масла. После инъекции тестостерона активность повышалась к 0,5 ч, затем снижалась к 4 ч и не изменялась в интервале 4-24 ч. В тоже время, активность ФМСФ-ингибируемой КП после введения прогестерона не изменялась в интервале 0,5-4 ч и снижалась к 24 ч.
Следует также отметить, что в случае введения прогестерона в яичниках происходило плавное снижение активности ФМСФ-ингибируемой КП к 24 ч, тогда как в случае введения оливкового масла снижение наблюдалось уже к 4 ч.
Сопоставление результатов влияния тестостерона в дозе 3 мг на кг массы и прогестерона в дозе 1 мг на кг массы в ГГНГС самцов и самок мышей позволяет выделить следующие особенности.
При введении прогестерона активность КП Н в семенниках и активность ФМСФ-ингибируемой КП в яичниках изменялись сходным образом: плавное снижение к 24 ч (табл. 3.5.1. и 3.5.2).
В половых железах через 0,5 ч после инъекции прогестерон у самцов повышал, а тестостерон у самок – снижал активность ФМСФ-ингибируемой КП (рис. 3.3.4. и 3.2.3). При этом активность КП Н через 4 ч после инъекции у самцов повышается при введении тестостерона, а у самок – прогестерона (рис. 3.3.1. и 3.2.5).
В гипофизе через 4 ч активность КП Н у самцов при введении тестостерона снижается, а у самок при введении прогестерона повышается (рис. 3.3.1. и 3.2.5).
В гипофизе через 0,5 ч тестостерон у самок повышал активность КП Н, а у самцов снижал. В этом же органе, но через 24 ч после введения тестостерон у самок снижал активность ФМСФ-ингибируемой КП, а у самцов – повышал (рис. 3.2.1., 3.3.1. и 3.2.3., 3.3.2).
Выявленные отличия во влиянии половых стероидов на активность исследуемых карбоксипептидаз у самцов и самок могут быть, вероятно, связаны с отличиями в чувствительности ГГНГС самцов и самок к половым гормонам [75, 94], а также с половыми отличиями в функционировании пептидергических систем [2, 40].
Необходимо заметить, что влияние прогестерона и тестостерона как у самцов, так и у самок, всегда было однонаправленным. Возможно это обусловлено тем, что в организме животных первый является предшественником второго [24, 27, 32, 39], и следовательно, многие эффекты прогестерона опосредуются его превращением в тестостерон.
ГЛАВА 4. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ
Известно, что нейропептиды контролируют различные функции организма и участвуют во многих физиологических процессах, в том числе и связанных с размножением [55, 101, 126, 203, 207, 219]. Они регулируют синтез и секрецию половых стероидных гормонов [23, 24, 32, 39]. В то же время половые стероидные гормоны оказывают существенное влияние на функционирование пептидергических систем [2, 277]. Они влияют на уровень синтеза и секреции гонадотропинов [2], гонадотропин рилизинг-фактора [202], пролактина [38], АКТГ [277], рилизинг-фактора АКТГ [64], b-эндорфина [277] и др. С другой стороны, уровень биологически активных пептидов зависит от активности ферментов, участвующих в их обмене [1, 5, 22, 123, 147, 146, 148, 152]. Исходя из этого, очевидно, что изучение активности КП Н и ФМСФ-ингибируемой КП при введении тестостерона и прогестерона представляет значительный интерес, как для понимания роли ферментов, так и для понимания механизмов функционирования нейропептидов.
Приведенные в настоящей работе данные о распределении активности КП Н в ГГНГС самцов и самок мышей хорошо соотносятся с распределением активности фермента у других видов животных [112, 113, 121, 122]: максимальный уровнь обнаружен гипофизе и гипоталамусе, минимальный – в надпочечниках и половых железах. Таким образом, активность КП Н выше в тех отделах ГГНГС, в которых выше концентрация нейропептидов [169]. Это хорошо согласуется с биологической ролью фермента – участием в процессинге предшественников биологически активных пептидов.
В настоящее время имеются сведения о распределении активности ФМСФ-ингибируемой КП в ЦНС и периферических тканях ежа [13], крысы [12, 44, 45] и кошки [8]. Данные о распределении активности исследуемого фермента в ГГНГС мышей согласуются с таковыми у других видов животных [8, 12, 13, 44, 45]. У всех изученных видов млекопитающих наибольшая активность ФМСФ-ингибируемой КП обнаружена в надпочечниках, половых железах и гипофизе, то есть в органах, связанных с образованием нейропептидов, участвующих в нейрогуморальной регуляции функций организма. Установлено, что яичники продуцируют многие нейропептиды, в том числе окситоцин [4], релаксин [43], инсулиноподобные факторы роста [282], эндорфины и энкефалины [80], а функции семенников модулируются опиоидными пептидами [128]. Кроме того, известно, что клетки семенников способны связывать вещество Р [257]. Все это позволяет сделать предположение о возможном участии ФМСФ-ингибируемой КП в процессинге биоактивных пептидов.
Следует отметить, что активность обеих карбоксипептидаз у самок выше, чем у самцов. Активность КП Н во всех отделах ГГНГС самок в 2,5-4 раза выше, чем у самцов. В то же время, активность ФМСФ-ингибируемой КП в гипофизе и надпочечниках самок выше, чем у самцов в 3,6-4,5 раза, а в гипоталамусе и половых железах – в 5,4-12 раз. Полученные результаты согласуются с данными о половых отличиях в активности исследуемых карбоксипептидаз в ГГНГС крыс [44]. Не исключено, что выявленные различия связаны с половыми отличиями в функционировании ГГГС, ГГНС и пептидергических систем [2, 40, 55].
Обнаружено (таблица 3.1.1. и 3.1.2), что в гипофизе мышей, в котором синтезируются пептидные гормоны, активность КП Н примерно в 2 раза выше активности ФМСФ-ингибируемой КП. При этом в надпочечниках, в которых синтезируются преимущественно энкефалины, наоборот, активность ФМСФ-ингибируемой КП приблизительно в 10 раз выше таковой КП Н. Подобное различие может быть обусловлено разным набором и уровнем нейропептидов в гипофизе и надпочечниках [169], а также отличиями в субстратной специфичности КП Н и ФМСФ-ингибируемой КП [11, 12, 44, 45, 118, 147].
Влияние тестостерона и прогестерона на активность как КП Н, так и ФМСФ-ингибируемой КП, у мышей обоего пола всегда было однонаправленным. Обнаружено, что в гипофизе самок активность КП Н при введении тестостерона в дозе 3 мг на кг массы увеличивалась через 0,5 ч после инъекции, а при введении прогестерона в дозе 1 мг на кг массы – через 4 ч. Известно, что прогестерон в организме служит предшественником тестостерона [32, 199]. Вероятно, влияние прогестерона опосредуется превращением в тестостерон. Это предположение подтверждается также отсутствием влияния вида гормона на активность исследуемых карбоксипептидаз (таблица 4.1).
Таблица 4.1. Дисперсионный анализ влияния вида гормона на активность основных карбоксипептидаз в ГГНГС мышей.
| Фермент | Отдел ГГНГС | Критерий Фишера, самцы | Критерий Фишера, самки |
| Карбоксипептидаза Н | Гипоталамус | 0,1 | 1,0 |
| Гипофиз | 0,1 | 0,1 | |
| Надпочечники | 0,9 | 4,1 | |
| Половые железы | 1,3 | 1,9 | |
| ФМСФ-ингибируемая карбоксипептидаза | Гипоталамус | 0,1 | 0,8 |
| Гипофиз | 1,3 | 1,5 | |
| Надпочечники | 1,1 | 0,8 | |
| Половые железы | 4,1 | 4,5* |
Примечание. Звездочкой показана достоверность критерия Фишера: * – p<0,05.
У самцов (таблица 4.1) не обнаружено статистически достоверных отличий между влиянием тестостерона и прогестерона. У самок (таблица 4.1) влияние вида гормона на активность ФМСФ-ингибируемой КП выявлено только в яичниках. Изменения активности КП Н не зависело от вида гормона. Возможно, это связано с тем, что у самцов, по-видимому, большая часть экзогенного прогестерона превращается в тестостерон и таким образом оказывает свое влияние. В то же время, у самок влияние прогестерона, вероятно, в меньшей степени обусловлено превращением в тестостерон. Половые железы, как основные источники половых стероидных гормонов, по-видимому, одними из первых подвержены действию экзогенных стероидов.
Изложенное выше, а также то, что активность ФМСФ-ингибируемой КП в половых железах значительно превосходит активность КП Н, объясняет наличие достоверного влияния вида вводимого стероидного гормона на активность исследуемого фермента только в яичниках.
У самок влияние тестостерона и прогестерона на активность КП Н и ФМСФ-ингибируемой КП более выраженное, чем у самцов. Принимая во внимание факт, что у самок активность обоих ферментов выше, чем у самцов, можно сделать предположение: подобные различия связаны с особенностями функционирования ГГГС и ГГНС у самцов и самок [2, 40, 55].
Pekary A.E. и соавт. обнаружили, что диета, обедненная цинком (6 мкг цинка на 1 г диеты против 36 мкг цинка на 1 г диеты у контрольных крыс) способствует снижению активности КП Н в репродуктивных органах [224]. При этом уменьшается концентрация тиреотропин-рилизинг-фактора (ТРФ) в эпидидимусе и семенниках. Экзогенный тестостерон увеличивает концентрацию ТРФ у животных, в рационе которых был недостаток цинка [224]. В наших исследованиях обнаружено, что через 4 ч после введения тестостерона в семенниках происходило увеличение активности КП Н. Не исключено, что данный эффект тестостерона может опосредоваться ТРФ.
В гипоталамусе самок обнаружено снижение активности ФМСФ-ингибируемой КП через 4 и 24 ч и активности КП Н через 24 ч после введения как тестостерона, так и прогестерона. Известно, что тестостерон в некоторой степени ингибирует секрецию аргинин-вазопрессина из паравентрикулярного и супраоптического ядер гипоталамуса [175]. Имеются сведения о том, что гонадотропин-рилизинг-фактор (ГнРФ) синтезируется в виде высокомолекулярного предшественника – препрогонадотропин-рилизинг-фактора (препроГнРФ) [32]. Последний состоит из сигнального пептида (23 аминокислотных остатка), ГнРФ (10 аминокислотных остатка), остатка глицина, сайта процессинга из двух аминокислотных остатка – Lys-Arg и гонадолиберин-ассоциированного пептида (56 аминокислотных остатка). В ходе посттрансляционной модификации происходит отщепление сигнального пептида, а также разделение ГнРФ и гонадолиберин-ассоциированного пептида в сайте процессинга. Субстратная специфичность обеих исследуемых карбоксипептидаз позволяет предположить их участие в процессинге препроГнРФ. Поскольку эгзогенные тестостерон и прогестерон по механизму отрицательной обратной связи снижают синтез и секрецию ГнРФ [24, 27, 32, 39], то снижение активности КП Н и ФМСФ-ингибируемой КП в гипоталамусе самок может являться одним из способов реализации обратной связи между уровнями половых стероидов и ГнРФ.
Известно, что действие половых стероидов на многие внутриклеточные процессы обусловлены изменением экспрессии генов ключевых белков (ферментов). Поэтому модуляция активности КП Н и ФМСФ-ингибируемой КП, наблюдаемая при введении тестостерона или прогестерона, вероятно, связана с влиянием этих половых стероидов на уровень экспрессии генов исследуемых карбоксипептидаз. Возможно, поэтому влияние тестостерона и прогестерона на активность КП Н и ФМСФ-ингибируемой КП более выражено через 24 ч.
Наиболее сильное влияние обоих половых стероидов на активность КП Н и ФМСФ-ингибируемой КП у животных обоего пола наблюдалось в гипофизе и половых железах. Последние являются местом синтеза и основным объектом воздействия половых гормонов. В гипофизе синтезируются ЛГ и ФСГ – гормоны, ответственные за синтез и секрецию как тестостерона, так и прогестерона. Повышение уровня тестостерона и прогестерона в крови при парентеральном введении, по-видимому, в первую очередь затрагивает гипофиз и половые железы. Есть данные об участии прогестерона в контроле тонической секреции гонадотропинов у самок [40]. Krey L.C. и соавт. обнаружили, что в присутствии прогестерона секреция ФСГ клетками гипофиза in vitro изменялась следующим образом: возрастала до 6 ч, оставалась на этом уровне через 9 ч и снижалась через 24 ч [168]. Таким образом, изменение активности исследуемых карбоксипептидаз у самок мышей согласуется с изменением секреции ФСГ в присутствии прогестерона. Возможно, что изменение активности исследуемых карбоксипептидаз, которые участвуют в процессинге предшественников гонадотропных гормонов гипофиза, является одним из механизмов снижения синтеза и секреции ЛГ и ФСГ половыми стероидами.
Не исключено, что обе основные карбоксипептидазы могут участвовать в ответе гипофиза и гонад на избыток половых стероидов в крови. Исходя из распределения исследуемых ферментов в ГГНГС мышей, можно предположить, что в гипофизе эту функцию преимущественно выполняет КП Н, а в половых железах – ФМСФ-ингибируемая КП. Таким образом, изменение активности исследуемых карбоксипептидаз через пептидергические системы может влиять на уровень стероидных гормонов в плазме крови, а через эти гормоны – на функционирование других систем организма.
Влияние тестостерона и прогестерона на активность КП Н в гипофизе самок отличается от такового у самцов через 0,5 и 4 ч после введения: у самок активность повышалась, у самцов – снижалась. При этом через 24 ч после инъекции тестостерона или прогестерона достоверных отличий в изменении активности КП Н в гипофизе не обнаружено. Активность ФМСФ-ингибируемой КП через 24 ч после введения тестостерона в гипофизе самцов отличалась от такового у самок.
Таким образом можно предположить, что влияние тестостерона и прогестерона на активность исследуемых карбоксипептидаз зависит от пола животного. Это предположение подтверждается результатами дисперсионного анализа влияния пола животного и времени после введения на активность КП Н и ФМСФ-ингибируемой КП (таблица 4.2).
Пол животного и время после введения влияют на активность как КП Н, так и ФМСФ-ингибируемой КП во всех отделах ГГНГС мышей, за исключением активности КП Н в гипоталамусе. Достоверной зависимости активности КП Н в надпочечниках и половых железах от взаимодействия пола животного и времени после введения тестостерона или прогестерона не обнаружено. Активность ФМСФ-ингибируемой КП во всех случаях достоверно зависела от пола и взаимодействия пола и времени после инъекции.
Все вышеизложенное позволяет предположить, что ФМСФ-ингибируемая КП в большей степени, чем КП Н, ответственна за отличия в функционировании ГГНГС и пептидергических систем у самцов и самок.
Известно, что в тканях самцов и самок половые стероиды метаболизируются по-разному [94]. Кроме того, период полураспада экзогенного тестостерона составляет 40-100 мин [42, 192]. Следовательно, к 24 ч различия в действии данного полового стероида на активность ФМСФ-ингибируемой КП у самцов и самок могут быть обусловлены разными продуктами метаболизма тестостерона у животных разного пола.
Известно, что содержание лептина – полипептидного гормона, который экспрессируется в адипоцитах, – у женщин больше, чем у мужчин [226]. Тестостерон in vitro не влияет на секрецию лептина. Но инкубация женской жировой ткани с ДГТ вызывает уменьшение уровня лептина [226]. Возможно, что уменьшение активности ФМСФ-ингибируемой КП во всех отделах ГГНГС самок мышей через 24 ч после введения тестостерона опосредовано ДГТ.
Многие биохимические, физиологические и поведенческие процессы регулируются тестостероном посредством его превращения в эстрогены (через ароматазу) [60, 156, 166, 233]. Тестостерон стимулирует продукцию цАМФ [244]. В ряде исследований показано, что цАМФ увеличивает как активность ароматазы, так и уровень мРНК данного фермента [111]. Подобным образом экзогенный тестостерон способен регулировать уровень эстрогенов в мозге самцов. Не исключено, что во влиянии тестостерона на активность исследуемых карбоксипептидаз могут быть задействованы цАМФ-зависимые механизмы.
Таблица 4.2. Значения критерия Фишера, характеризующие влияние пола животного и взаимодействия пола и времени после введения тестостерона или прогестерона на активность основных карбоксипептидаз в ГГНГС мышей.
| Экзогенный гормон | Фермент | Отдел ГГНГС | Fф1 | Fф2 |
| Тестостерон | Карбоксипеп-тидаза Н | Гипоталамус | 3,1 | 2,3 |
| Гипофиз | 10,5** | 1,8 | ||
| Надпочечники | 11,4** | 2,4 | ||
| Половые железы | 8,8** | 0,3 | ||
| ФМСФ-ингибируемая КП | Гипоталамус | 28,7*** | 17,0*** | |
| Гипофиз | 28,4*** | 6,3** | ||
| Надпочечники | 5,5* | 4,3* | ||
| Половые железы | 71,2*** | 10,6*** | ||
| Прогестерон | Карбоксипеп-тидаза Н | Гипоталамус | 3,8 | 3,9* |
| Гипофиз | 27,3*** | 4,2* | ||
| Надпочечники | 24,0*** | 2,3 | ||
| Половые железы | 12,6** | 2,8 | ||
| ФМСФ-ингибируемая КП | Гипоталамус | 23,7*** | 10,6*** | |
| Гипофиз | 61,6*** | 12,5*** | ||
| Надпочечники | 6,1* | 7,3** | ||
| Половые железы | 183,3*** | 33,3*** |
Примечание. Fф1, Fф2, – значения критерия Фишера характеризующие влияние, соответственно, пола животного и взаимодействия пола и времени после введения половых стероидных гормонов; звездочками показана достоверность критерия Фишера: * – p<0,05, ** – p<0,01, *** – p<0,001.
Интересно, что у самок, в случае наличия достоверных изменений, как тестостерон, так и прогестерон, практически во всех отделах ГГНГС, и во все изученные временные интервалы снижал активность ФМСФ-ингибируемой КП, то у самцов, наоборот, – повышал. Известно, что животные разного пола различаются по содержанию нейропептидов в мозге [2, 38, 40, 54, 82, 96, 138]. Кроме того, активность ферментов, вовлекающихся в обмен нейропептидов и половых стероидных гормонов, различна у самцов и самок [124, 125]. В частности, уровень ароматазной активности в некоторых зонах мозга больше у самцов, чем у самок [233]. Поэтому, возможно, ФМСФ-ингибируемая КП по-разному функционирует у самцов и самок и/или вовлекается в разные процессы, связанные с ответом на избыток половых стероидов в крови. Помимо этого, имеются сведения об активирующем влиянии прогестерона на продукцию цАМФ и цГМФ, а также тестостерона – на продукцию цАМФ в яичниках свиньи [244]. цАМФ способствует высвобождению содержимого секреторных везикул [65]. Поэтому не исключено, что увеличение активности ФМСФ-ингибируемой КП в семенниках через 0,5 и 4 ч и в надпочечниках через 0,5 ч после введения прогестерона обусловлено увеличением секреции цГМФ.
Известно, что активность цистиновой аминопептидазы в плазме модулируется прогестероном как у самок мышей, так и у самцов, а также андрогеном у самцов [191]. Максимальная активность цистиновой аминопептидазы обнаружена на 13 день беременности. Таким образом обнаружено, что андрогены по-разному влияют на активность цистиновой аминопептидазы у самок и самцов. Причем у последних активность фермента минимальна. Это согласуется с нашими результатами по влиянию тестостерона и прогестерона на активность КП Н в гипофизе.
Известно, что прогестерон способствует открытию ионных каналов в плазматической мембране и стимулирует фосфорилирование остатков тирозина в белках [190]. Тестостерон и прогестерон участвуют в регуляции внутриклеточной концентрации Ca2+ [109, 252]. Ионы Ca2+ влияют на выброс секреторных везикул [65, 59]. Несмотря на то, что ионы Ca2+ непосредственно не влияют на активность КП Н [98, 211], в ее составе обнаружен участок связывания данных ионов. Ионы Ca2+ способствуют агрегации КП Н и связыванию ее с мембраной [255]. Возможно, что биологическая роль растворимой и мембраносвязанной КП Н отличается [5, 7, 10]. Предполагают, что обе формы участвуют в процессинге, но мембраносвязанная, наряду с этим, способна принимать участие в сортировке пептидов [83, 84, 159, 216, 217, 240]. Кроме того имеются сведения о том, что активность прогормон-конвертазы – фермента, участвующего в процессинге проКП Н, регулируется ионами Ca2+ [116]. Изложенное выше позволяет предположить, что действие тестостерона и прогестерона на активность КП Н может быть опосредовано изменениями внутриклеточной концентрацией ионов Ca2+. Это может приводить как к изменению уровня активности фермента, так и к изменению соотношения растворимой и мембраносвязанной форм, что в свою очередь влияет на процессинг и сортировку биологически активных пептидов.
Имеются сведения о том, что яичники секретируют пролактин-подобный пептид, при этом прогестерон является возможным ингибитором данного процесса [245]. Снижение активности ФМСФ-ингибируемой КП в яичниках через 24 ч после введения прогестерона, возможно, способствует снижению синтеза и/или секреции пролактин-подобного пептида.
Кроме того известно, что прогестерон может влиять на уровень мРНК окситоцина в паравентрикулярном ядре гипоталамуса (а также на многие другие физиологические процессы) путем модуляции рецепторов ГАМК или путем прямого изменения транскрипции гена через рецепторы прогестерона [171, 267, 280]. ГАМК участвует в регуляции секреции многих аденогипофизарных гормонов. ГАМК и ее рецепторы могут принимать участие в секреции ЛГ. Известно, что увеличение уровня ГАМК в организме сопровождается угнетением, а его снижение – усилением компенсаторного повешения уровня тестостерона в периферической крови после односторонней кастрации. Таким образом ГАМКергические механизмы способны принимать участие в регуляции функции ГГГС механизмом отрицательной обратной связи. Имеются данные об изменении активности КП Н при введении ГОМК [9]. Другими словами, влияние прогестерона на активность КП Н может, вероятно, опосредоваться также и ГАМК-ергической системой.
В опытах in vitro тестостерон и прогестерон не влияли на активность КП Н и ФМСФ-ингибируемой КП. Стероиды, такие как глюкокортикоиды, андрогены и прогестины, влияют на уровень экспрессии генов. Известно, что глюкокортикоиды влияют на уровень экспрессии мРНК КП Н [155, 186, 232]. В частности, дексаметазон снижает уровень мРНК КП Н в клетках AtT-20 [232]. Поэтому можно предположить, что действие тестостерона и прогестерона на активность КП Н и ФМСФ-ингибируемой КП обусловлено изменением уровня экспрессии соответствующих генов. Кроме того, в результате наших исследований обнаружено, что наиболее сильные изменения активности КП Н и ФМСФ-ингибируемой КП в ГГНГС мышей происходили через 24 ч после введения половых стероидов. Это является косвенным подтверждением предполагаемого механизма действия тестостерона и прогестерона на активность исследуемых карбоксипептидаз.
Таким образом, полученные результаты свидетельствуют о том, что активность КП Н и ФМСФ-ингибируемой КП регулируется уровнем половых стероидных гормонов в организме. При этом КП Н и ФМСФ-ингибируемая КП, вероятно, участвуют в регуляции уровня ГнРФ, ЛГ, ФСГ и других биологически активных пептидов, контролирующих уровень стероидных гормонов. В то же время исследуемые карбоксипептидазы, возможно, вовлекаются в регуляцию уровня ГнРФ, ЛГ, ФСГ половыми стероидными гормонами. Можно предположить, что КП Н и ФМСФ-ингибируемая КП, посредством изменения уровня нейропептидов, регулирующих содержание половых стероидных гормонов в организме, участвуют в формировании полового диморфизма, функционирования пептидергических и других нейромедиаторных систем, а также вовлекаются в контроль процессов половой дифференциации и размножения.
ВЫВОДЫ
В гипоталамо-гипофизарно-надпочечниково-гонадной системе мышей наиболее высокая активность карбоксипептидазы Н обнаружена в гипофизе и гипоталамусе, а активность ФМСФ-ингибируемой карбоксипептидазы – в половых железах и надпочечниках. Активность исследуемых ферментов зависела от пола животных: у самок во всех отделах гипоталамо-гипофизарно-надпочечниково-гонадной системе активность карбоксипептидазы Н и ФМСФ-ингибируемой карбоксипептидазы была выше, чем у самцов.
Обнаружено, что в гипоталамо-гипофизарно-надпочечниково-гонадной системе мышей экзогенные тестостерон и прогестерон вызывали, в основном, снижение активности карбоксипептидазы Н и ФМСФ-ингибируемой карбоксипептидазы. Изменение активности исследуемых ферментов при введении половых стероидных гормонов зависели от пола животного и времени после инъекции и, практически, не зависели от дозы вводимого гормона.
Наиболее существенное изменение активности КП Н и ФМСФ-ингибируемой КП при введении тестостерона и прогестерона выявлено в гипофизе и половых железах у животных обоего пола. Минимальное влияние половых стероидных гормонов на активность ферментов обнаружено в гипоталамусе.
Обнаружено, что вид экзогенного полового гормона достоверно влиял только на активность ФМСФ-ингибируемой карбоксипептидазы в яичниках мышей.
Активность исселедуемых карбоксипептидаз не изменялась in vitro при действии тестостерона и прогестерона.
ЛИТЕРАТУРА
1. Ашмарин И.П., Каразеева Е.П. Нейропептиды // в кн. “Нейрохимия” под ред. Ашмарина И.П., Стукалова П.В.- М.: Издательство института биомедицинской химии РАМН.-1996.- С.296-333.
2. Бабичев В.Н. Нейроэндокринный контроль процессов пубертации // Усп. совр. биол. – 1994. – 114, № 3. – С. 330-344.
3. Бабичев В.Н., Миронов С.Ф. Нейропептиды мозга и их нейроэндокринные эффекты // Пробл. эндокринол. – 1981. – № 3. – С. 78-85.
4. Бэйрд Д.Т. Яичник / Гормональная регуляция размножения у млекопитающих. – М.: Мир. – 1987. – С. 118-144.
5. Вернигора А.Н., Генгин М.Т. Механизм регуляции активности и биологическая роль карбоксипептидазы H – фермента процессинга нейропептидов // Биохимия - 1995. - 60, № 12. - С. 1491-1497.
6. Вернигора А.Н., Генгин М.Т. Протеолитические ферменты: субклеточная локализация, свойства и участие в обмене нейропептидов // Биохимия. – 1996. - 61, № 5. - С. 771-785.
7. Вернигора А.Н., Генгин М.Т., Никишин Н.Н. Множественность молекулярных форм растворимых карбоксипептидазо-В-подобных ферментов головного мозга кошки // Укр. биохим. журн. – 1993.– 65, № 4. – С. 17-21.
8. Вернигора А.Н., Генгин М.Т., Салдаев Д.А., Щетинина Н.В. Распределение активности фенилметилсульфонилфторид-ингибируемой карбоксипептидазы в нервной ткани котов // Нейрохимия – 1997. – 14, № 4.
9. Вернигора А.Н., Генгин М.Т., Щетинина Н.В., Спиридонов Д.А. Влияние гидроксибутирата натрия на активность карбоксипептидазы Н и ангиотензинпревращающего фермента в различных отделах мозга крыс // Укр. биохим. журн.– 1999. – 71, № 2.– С. 91-92.
10. Вернигора А.Н., Никишин Н.Н., Генгин М.Т. Влияние глюкортикоидов на активность растворимой и мембраносвязанной форм карбоксипептидазы Н in vivo // Укр. биохим. журн. – 1995. – 67, № 6. – С. 93-98.
11. Вернигора А.Н., Никишин Н.Н., Генгин М.Т. Частичная характеристика фенилметилсульфонилфторид-ингибируемой карбоксипептидазы из головного мозга кошки // Биохимия. – 1995. – 60, № 11. – с. 1860-1866.
12. Вернигора А.Н., Щетинина Н.В., Генгин М.Т. Исследование активности основных (отщепляющих остатки аргинина и лизина) карбоксипептидаз у крыс разного возраста // Биохимия. – 1996.– 61, № 10.– С. 1848-1856.
13. Вернигора А.Н., Щетинина Н.В., Генгин М.Т. Распределение активности ФМСФ-ингибируемой карбоксипептидазы в тканях и отделах головного мозга ежа европейского (Erinaceus europaeus) // Укр. биохим. журн. – 1996. – 68, № 5. – С. 118-121.
14. Генгин М.Т. Новая КП нервной ткани. Региональное распределение и некоторые физико-химические свойства // Нервная система. – Л. – ЛГУ. – 1991.- С. 29-30.
15. Генгин М.Т., Вернигора А.Н. Влияние этанола на активность карбоксипептидазы Н в мозге крыс. // Укр.биохим.журн. – 1993. – т. 65. – №1. – С. 100-103.
16. Генгин М.Т., Вернигора А.Н. Ферменты процессинга опиоидных пептидов и методы определения их активности // Укр. биохим. журн. – 1994. – т.66. - №2. – С.3-17.
17. Генгин М.Т., Вернигора А.Н., Никишин Н.Н. Влияние эмоционально-болевого стресса на активность КПН - фермента процессинга нейропептидов головного мозга крыс // Физиол. ж. – 1994.– 80.-№3.– С.23-27.
18. Генгин М.Т., Вернигора А.Н., Никишин Н.Н., Керимов В.Ю. Эффект эмоционального стресса на активность карбоксипептидазы Н в отделах головного мозга крыс с различной к нему устойчивостью // Вопр. мед. химии.– 1995.– т.41, №4.– С.8-9.
19. Гомазков О.А. Мозг и нейропептиды // Справочно-информационное издание.- М.-1997.
20. Гомазков О.А. Физиологически активные пептиды. – М.: Изд-во Инст. Биомед. Химии РАМН, 1995.– 143 с.
21. Гомазков О.А. Функциональная биохимия регуляторных пептидов.– М.: Наука. 1993, 160 с.
22. Гомазков О.А., Григорьянц О.О. Регуляция биосинтеза энкефалинов: биохимические и физиологические аспекты // Успехи совр. биол. – 1989. – 108, № 1(4). – С. 109-124.
23. Гончаров Н.П., Андрогены (лекция) // Пробл. эндокрин. – 1996. – 42, № 4. – С. 28-31.
24. Гормонотерапия: Пер. с нем. / Под ред. Шамбаха Х., Кнаппе Г., Карола В. – М.: Медицина, 1988, 416 с.
25. Григорьянц О.О., Гомазков О.А. Энкефалинобразующие ферменты // Вопр. мед. химии.– 1986.– 32, № 3.– С. 15-20.
26. Дмитриев А.Д. Биосинтез нейропептидов // Итоги науки и техники ВИНИТИ. Фармакол. химиотерапевт. средства. – 1982. – 43. – С. 7-49.
27. Држевецкая И.А. Основы физиологии обмена веществ и эндокринной системы. – М.: Высш. шк., 1994, 256 с.: ил.
28. Замятнин А.А. Общие функциональные особенности зндогенных регуляторных олигопептидов // Физиол. ж. – 1992. – 78, № 9. – С. 39-49.
29. Зезеров Е.Г., Северин Е.С. “Простатические” калликреины, половые гормоны, инсулиноподобные факторы роста – комплекс регуляторных элементов у мужчин и женщин при физиологческих процессах и канцерогенезе // Вест. Росс. Академ. Мед. Наук. – 1999. – № 3. – С. 49-56.
30. Корнева Е.А. Регуляторные пептиды как модуляторы защитных функций организма // Физиол. ж. – 1985. – 75, № 5. – С. 656-665.
31. Лакин Г.Ф. Биометрия. – М.: Высш. шк., 1990. – 352 с.
32. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: В 2-х томах. Пер. с англ. / Под ред. Гинодмана Л.М. – М.: Мир, 1993.
33. Науменко Е.В., Жукова А.В., Серова Л.И. Участие гамма-аминомасляной кислоты в механизмах обратной связи гипоталамо-гипофизарно-семенникового комплекса // Пробл. эндокрин. – 1995. – 41, № 2. – С. 30-32.
34. Панченко Л.Ф. Возрастные особенности обновления белков различных отделов центральной нервной системы и печени // Физиол. ж. – 1958.– 44, № 3. - С. 243-248.
35. Панченко Л.Ф., Брусов О.С., Беляев Н.А. Исследование механизма действия этанола на активность энкефалиназы A мозга крыс // Бюлл. эксперим. биол. мед.– 1984.– 97, № 6.– С. 691-692.
36. Раевский К.С. Эндогенные опиоидные пептиды как возможные нейропередатчики // Итоги науки и техники ВИНИТИ. Фармакологические и химиотерапевтические средства. - 1982. - 43. - С. 185-200.
37. Степанов М.Г., Секретарева Е.В., Проймина Ф.И., Савченко О.Н. Отрицательная и положительная фазы реакции гипоталамо-гипофизарно-гонадной системы самок крыс на введение половых гормонов // Физиол. ж. – 1991. – 77. – № 3. – С. 108-115.
38. Сухоруков В.С., Тарабрин С.Б. Роль пролактина в регуляции функций мужской гонады // Усп. совр. биол. – 1993. – 113, № 3. – С. 366-376.
39. Теппермен Дж., Теппермен У. Физиология обмена веществ и эндокринной системы. Вводный курс: Пер. с англ. / Под ред. Ажипа Я.И. – М.: Мир, 1989, 656 с.
40. Тинников А.А. Роль гипоталамо-гипофизарно-надпочечниковой системы в регуляции полового развития // Усп. совр. биол. – 1990. – 110, № 3. – С. 419-430.
41. Ткачева Н.Ю. Влияние прогестерона на липидный состав плазмы крови и плазматических мембран клеток матки крыс // Бюлл. эксперим. биол. мед. – 1993. – CXVI, № 11. – С. 518-520.
42. Физиология человека / Под ред. Косицкого Г.И. – М.: Медицина, 1985, 544 с., ил.
43. Хип Р., Флинт А. Беременность / Гормональная регуляция размножения у млекопитающих. – М.: Мир. – 1987. – С. 193-244.
44. Щетинина Н.В., Вернигора А.Н., Генгин М.Т. Активность основных карбоксипептидаз у крыс разного пола // Укр. биохим. журн. – 1997. –70, № 3. - С. 110-113.
45. Щетинина Н.В., Вернигора А.Н., Генгин М.Т., Фирстова Н.В. Тканевое и региональное распределение активности фенилметилсульфонилфторидинигибируемой карбоксипептидазы и других карбоксипептидаз у крыс // Укр. биохим. журн. – 1997. – 70, № 3. – С. 23-28.
46. Ahmad S., Ward P.E. Depressor action of bradykinin agonists relative to metabolism by angiotensin-converting enzyme, carboxypeptidase N, and aminopeptidase P // Proc. Soc. Exp. Biol. Med. – 1992. – 200, N 1. – P. 115-121.
47. Alankari A.R.S. Relationship between gonadal steroids and corticosterone during blood sampling in saker falcons // J. Wildlife Dis. – 1998. – 34, N 3. – P. 653-655.
48. Alcalde L., Tonacchera M., Costagliola S., Jaraquemada D., Pujol Borrell R., Ludgate M. Cloning of candidate autoantigen carboxypeptidase H from a human islet library: sequence identity with human brain CPH // J. Autoimmunity. – 1996. – 9, N 4. – P. 525-528.
49. Alvarez-Bolado G., Fairen A., Douglass J., Naranjo J.R. Expression of the prodynorphin gene in the developing and adult cerebral cortex of the rat: an in situ hybridization study // J. Comp. Neurol. – 1990. – 300, N 3. – P. 287-300.
50. Ambler R.P. Enzymic hydrolysis with carboxypeptidases // Meth. Enzymol. – New York, London: Acad. Press, 1967. – 11. – P. 155-166.
51. Ando Y., Watanabe H., Fujimoto N., Ito A., Toge T. Progesterone enhancement of stomach tumor development in SD rats treated with N methyl N' nitro N nitrosoguanidine // Jap. J. Canc. Res. – 1995. – 86, N 10. – P. 924-928.
52. Angstwurm M.W., Gartner R., Ziegler Heitbrock HW. Cyclic plasma IL 6 levels during normal menstrual cycle // Cytokine. – 1997. – 9, N 5. – P. 370-374.
53. Anic M., Mesaric M. The influence of sex steroid hormones on ganglioside biosynthesis in rat kidney // Biol. Chem. – 1998. – 379, N 6. – P. 693-697.
54. Arai Y., Matsumoto A., Nishizuka M. Synaptogenesis and neural plasticity to gonadal steroids // Cur. Top. Neuroendocrin. – 1986. – 7. – P. 291-307.
55. Arnold A.P., Gorski R.A. Gonadal steroid induction of structural sex differences in the central nervous system // Annu. Rev. Neurosci.– 1984.– 7.– P. 413-442.
56. Arsenijevic Y., Tribollet E. Region specific effect of testosterone on oxytocin receptor binding in the brain of the aged rat // Brain Res. – 1998. – 785, N 1. – P. 167-170.
57. Azaryan A.V., Hook V.Y.H. Distinct properties of prohormone thiol protease (Ptp) compared to cathepsin B, cathepsin L, and cathepsin H - evidence for Ptp as a novel cysteine protease // Arch. Biochem. Biophys. – 1994. – 314, N 1. – P. 171-177.
58. Azaryan A.V., Hook V.Y.H. Unique cleavage specificity of prohormone thiol protease related to proenkephalin processing // FEBS Lett. – 1994. – 341, N 2-3. – P. 197-202.
59. Bader M.F., Simon J.P., Sontag J.M,. Langley K., Aunis D. Role of calcium in secretion and synthesis in bovine adrenal chromaffin cells // Adv. Exp. Med. Biol. – 1990. – 269. – P. 93-97.
60. Balthazart J., Ball G.F. New insights into the regulation and function of brain estrogen synthase (aromatase) // Trends Neurosci. – 1998. – 21, N 6. – P. 243-249.
61. Baumann M.N., Rabii J. Inhibition of suckling-induced prolactin release by mu- and k-opioid antagonists // Brain Res. – 1991. – 567, N 2. – P. 224-230.
62. Bayon A., Shoemaker W.J., Bloom F.E., Mauss A., Guillemin R. Perinatal development of the endorphin and enkephalin-containing systems in the rat brain // Brain Res. – 1979. – 179. – P. 93-101.
63. Belsham D.D., Evangelou A., Roy D., Le D.V., Brown T.J. Regulation of gonadotropin releasing hormone (GnRH) gene expression by 5 alpha dihydrotestosterone in GnRH secreting Gt1 7 hypothalamic neurons // Endocrinology. – 1998. – 139, N 3. – P. 1108-1114.
64. Bingaman E.W., Magnuson D.J., Gray T.S., Handa R.J. Androgen inhibits the increases in hypothalamic corticotropin-releasing hormone (CRH) and CRH-immunoreactivity following gonadoectomy // Neuroendocrinology. – 1994. – 59, N 2. – P. 228—234.
65. Biologically active peptides: design, synthesis and utilization / W.V.Williams, D.B.Weiner, Eds. – Lancaster: Technomic, 1993. – 360 pp.
66. Birch N.P., Rodriguez C., Dixon J.E., Mezey E. Distribution of carboxypeptidase H messenger RNA in rat brain using in situ hybridization histochemistry: implications for neuropeptide biosynthesis // Brain Res. Mol. Brain Res. – 1990. – 7, N 1. – P. 53-59.
67. Bjorntorp P. Growth Hormone, Insulin Like Growth Factor I and Lipid Metabolism Interactions with Sex Steroids // Horm. Res. – 1996. – 46, N 4-5. – P. 188-191.
68. Bloom D.F., Bloch G.J., Gorski R.A. Effects of Thymectomy on Reproductive Function and Behavior // Physiol. Behav. – 1992. – 52, N 2. – P. 291-298.
69. Bokish V.A., Muller-Eberhard H.J. Anaphylotoxin inactivator in human plasma: its isolation and characterisation as a carboxypeptidase // J. Clin. Invest. – 1970. – 49. – P. 2427-2436.
70. Boman K., Strang P., Backstrom T., Stendahl U. The influence of progesterone and androgens on the growth of endometrial carcinoma // Cancer. – 1993. – 71, N 11. – P. 3565-3569.
71. Bommer M, Nikolarakis K, Noble E.P, Herz A. In vivo modulation of rat hypothalamic opioid peptide content by intracerebroventricular injection of guanidinoethylmercaptosuccinic acid (GEMSA) possible physiological role of enkephalin convertase // Brain Res. – 1989. – 492, N 1/2. – P. 305-313.
72. Bondy C.A., Whitnall M.H., Brady L.S. Regulation of carboxypeptidase H gene expression in magnocellular neurons: response to osmotic stimulation // Mol. Endocrinol. – 1989. – 3, N 12. – P. 2086-2092.
73. Bonten E.J, Galjart N.J, Willemsen R, Usmany M, Vlak JM, d'Azzo A. Lysosomal protective protein/cathepsin A. Role of the "linker" domain in catalytic activation // Biol Chem. – 1995. – 270. N 44. – P. 26441-26445.
74. Bradshaw R.A., Neurath H., Walsh K.A. Consideration of the concept of structural homology as applied to bovine carboxypeptidases A and B // Proc. Natl. Acad. Sci. USA. – 1969. – 263, N 2. – P. 406-411.
75. Brown T.J., MacLusky N.J., Shanabrough M., Naftolin F. Comparison of age and sex-related changes in cell nuclear estrogen-binding capasity and progestin receptor induction in the rat brain // Endocrinology. – 1990. – 126. – P. 2965—2972.
76. Campball W., Okada H. An arginine specific carboxypeptidase generated in blood during coagulation or inflamation which is unrelated to carboxypeptidase N or its subunits // Biochem. Biophys. Res. Commun. – 162, N 3. – P. 933-939.
77. Campbell W., Yonezu K., Shinohara T., Okada H. An arginine carboxypeptidase generated during coagulation is diminished or absent in patients with rheumatoid arthritis // J. Lab. Clin. Med. – 1990. – 115, N 5. – P. 610-612.
78. Cardone A., Angelini F., Varriale B. Autoregulation of estrogen and androgen receptor messenger rnas and down regulation of androgen receptor messenger RNA by estrogen in primary cultures of Lizard testis cells // Gen. Comp. Endocrinol. – 1998. – 110, N 3. – P. 227-236.
79. Cassidenti D.L., Paulson R.J., Serafini P., Stanczyk F.Z., Lobo R.A. Effects of sex steroids on skin 5 alpha reductase activity in vitro // Obstetrics and gynecology. – 1991. – 78, N 1. – P. 103-107.
80. Charnning C.P., Andersen L.D., Hoover D.J. Hormonal control of granulosa cell secretion of oocyte maturation inhibitor and inhibin-F activity // Follicular maturation and ovulation: Exp. Med. Intern. Congr. Amsterdam. – 1982. – P. 219-236.
81. Chesselet M.F., Hook V.Y. Carboxypeptidase H-like immunoreactivity in the striatum of cats and monkeys // Regul. Pept. – 1988. – 20, N 2. – P. 151-159.
82. Chisari A., Carino M., Perone M., Gaillard R.C., Spinedi E. Sex and strain variability in the rat hypothalamo-pituitary-adrenal (HPA) axis function // J. Endocrinol. Invest. – 1995. – 18, N 1. – P. 25-33.
83. Cool D.R., Loh Y.P. Carboxypeptidase E is a sorting receptor for prohormones – binding and kinetic studies // Mol. Cell. Endocrinol. – 1998. – 139, N 1-2, P. 7-13.
84. Cool D.R., Normant E., Shen F.S., Chen H.C., Pannell L., Zhang Y., Loh Y.P. Carboxypeptidase E is a regulated secretory pathway sorting receptor: genetic obliteration leads to endocrine disorders in Cpe(Fat) mice // Cell. – 1997. – 88, N 1, P. 73-83.
85. Dakes M.J., Davis T.P. The ontogeny of enzymes involved in posttranslational processing and metabolism of neuropeptides // Dev. Brain Res. – 1994. – 80, N 1-2, P. 127-136.
86. Dar D.E., Zinder O. Short term effect of steroids on catecholamine secretion from bovine adrenal medulla chromaffin cells // Neuropharmacology. – 1997. – 36, N 11-12. – P. 1783-1788.
87. Das B., Sablan E.L., Kilbourne E.J., Fricker L.D. Regulation of carboxypeptidase E by membrane depolarization in PC12 pheochromocythoma cells: comparison with the mRNA’s encording other peptide and catecholamine’s biosynthetic enzymes // Neurochem. – 1992. – 59, N 6. – P. 2263-2270.
88. Dasilva J.A.P Colvillenash P., Spector T.D., Scott D.L., Willoughby D.A. Inflammation induced cartilage degradation in female rodents protective role of sex hormones // Arthritis and Rheumatism. – 1993. – 36, N 7. – P. 1007-1013.
89. Davidson H.W., Hutton J.C. The insulin-secretory-granule carboxypeptidase H: Purification and demonstration of involvement in proinsulin processing // Biochem. J. – 1987. – 245, N 2. – P. 575-582.
90. Dedavid M.L.R., Desterin A.F., Goldraij A. Influence of gonadic hormones on the rat submaxillary gland // Arch. Biochem. Biophys. – 1991. – 99, N 1. – P. 107-109.
91. Deddish P.A., Skidgel R.A., Kriho V.B., Li X.Y., Becker R.P., Erdos E.G. Carboxypeptidase M in Madin-Darby canine kidney cells. Evidence that carboxypeptidase M has a phosphatidylinositol glycan anchor // J. Biol. Chem. – 1990. – 265, N 25. – P. 15083-15089.
92. Delk A.S., Durie P.R., Fletcher T.S., Largman C. Radioimmunoassay of active pancreatic enzymes in sera from patients with acute pancreatitis. I. Active carboxypeptidase B // Clin. Chem. – 1985. – 31, N 8. – P. 1294-1230.
93. Demmer W., Brand K. Carboxypeptidase activity in synaptic vesicles isolated from striatum and cortex of calf brain // Arch. Biochem. Biophys. – 1985. – 239, N 2. – P. 375-378.
94. Denef C., De Moor P. Sexual differentiation of steroid metabolizing enzymes in the rat liver. Further studies on predetermination by testosterone at birth // Endocrinology. – 1972. – 91, N 2. – P. 374—384.
95. Devi L. Tissue distribution of a dynorphin-processing endopeptidase // Endocrinology. – 1993. – 132, N 3. – P. 1139-1144.
96. Dies-Guerra F.J., Bicknell R.J., Mansfield S. et.al. Effect of neonatal testosterone upon opioid receptors and the content of beta-endorphin, neuropeptide Y and neorotensin in the medialbasal areas in the rat brain // Brain Res. – 1987. – 44, N 2. – P. 225-230.
97. Dieudonne M.N., Pecquery R., Boumediene A., Leneveu M.C., Giudicelli Y. Androgen receptors in human preadipocytes and adipocytes regional specificities and regulation by sex steroids // Am. J. Physiol. Cell Physiol. – 1998. – 43, N 6. – P. C1645-C1652.
98. Dochetry K., Hutton J.C. Carboxypeptidase activity in the insulin secretory granule // FEBS Lett. – 1983. – 162, N 1. – P. 137-141.
99. Donesky B.W., Demoura M.D., Tedeschi C., Hurwitz A., Adashi E.Y., Payne D.W. Interleukin 1 beta inhibits steroidogenic bioactivity in cultured rat ovarian granulosa cells by stimulation of progesterone degradation and inhibition of estrogen formation // Biol. Reprod. – 1998. – 58, N 5. – P. 1108-1116.
100. Eipper B.A, Green C.B, Mains R.E. Expression of prohormone processing enzymes in neuroendocrine and non neuroendocrine cells // Monogr. Natl. Cancer. Inst. – 1992. – 13, P. 163-168.
101. Ekman F.W., Eriksson E., Back F.W. Neuropeptide in human CSF // Acta Neurol. Scand. – 1989. – 79, N 3. – P. 261-262.
102. Erdos E.G., Sloane E.M., Wohler I.M. Carboxypeptidase in blood and other fluids // Biochem. Pharmacol. – 1964. – 13. – P. 893-905.
103. Erdos E.G., Sloane S.M. An enzyme in human blood plasma that inactivates bradikinin and kallidin // Biochem. Pharmacol. – 1962. – 11. – P. 585-592.
104. Erdos E.G., Yang H.Y.T., Tagne L.L., Manning N. Carboxypeptidase in blood and other fluids. The esterase activity of the enzyme // Biochem. Pharmacol. – 1967. – 16. – P. 1287-1297.
105. Fan X., Nagle G.T. Molecular cloning of Aplysia neuronal cDNAs that encode carboxypeptidases related to mammalian prohormone processing enzymes // DNA Cell Biol. – 1996. – 15, N 11. – P.937-945.
106. Fenske M. Dissociation of Plasma and Urinary Steroid Values After Application of stressors, insulin, vasopressin, acth, or dexamethasone in the mongolian gerbil // Experim. Clin. Endocrinol. Diabetes. – 1996. – 104, N 6. – P. 441-446
107. Fiedorek F.T Jr, Parkinson D. Carboxypeptidase H processing and secretion in rat clonal beta cell lines // Endocrinology. – 1992. – 131, N 3. – P. 1054-1062
108. Folk J.F., Piez K.A., Carroll W.R., Gladner I.A. Carboxypeptidase B. Purification and characterization of the porcine enzyme // J. Biol. Chem. – 1960. – 235, N 8. – P. 2272-2277.
109. Fomin V.P., Cox B.E., Word R.A. Effect of progesterone on intracellular Ca2+ homeostasis in human myometrial smooth-muscle cells // American J. Phisiol. Cell. Phisiol. – 1999. – 45, N 2, P. C379-C385.
110. Forsberg J.G. Estrogen effects on lymphoid tissue in neonatal and adult female mice // Acta Anat (Basel) – 1995. – 153, N 1. – P. 20-30.
111. Freking F., Ramachandran B., Schlinger B.A. Regulation of aromatase, 5-alpha-reductase and 5-beta-reductase in primary-cell cultures of developing zebra finch telencephalon // J. Neurobiology – 1998. –36, N 1. – P. 30-40.
112. Fricker L.D. Activation and membrane binding of carboxypeptidase E // J. Cell. Biochem. – 1988. – 38. – P. 279-289.
113. Fricker L.D. Carboxypeptidase E // Ann. Rev. Physiol. – 1988. – 50. – P. 309-321.
114. Fricker L.D., Adelman J.P., Douglass J., Thompson R.C, von Strandmann R.P, Hutton J AD. Isolation and sequence analysis of cDNA for rat carboxypeptidase E [EC 3.4.17.10], a neuropeptide processing enzyme // Mol. Endocrinol. – 1989. – 3, N 4. – P. 666-673.
115. Fricker L.D., Das B., Angeletti R.H. Identification of the pH dependent membrane anchor of carboxypeptidase E (EC 3.4.17.10) // J. Biol. Chem. – 1990. – 265, N 5. – P. 2476-2282.
116. Fricker L.D., Devi L. Posttranslational processing of carboxypeptidase E, a neuropeptide processing enzyme, in AtT 20 cells and bovine pituitary secretory granules // J. Neurochem. – 1993. – 61, N 4. – P. 1404-1415.
117. Fricker L.D., Herbert E. Comparison of a carboxypeptidase E-like enzyme in human, bovine, mouse, Xenopus, shark and Aplysia neural tissue // Brain Res. – 1988. – 453, N 1-2. – P. 281-286.
118. Fricker L.D., Plummer T.H., Snyder S.H. Enkephalin convertase: potent, selective and irreversible inhibitors // Biochem. and Biophys. Res. Commun. – 1983. – 11, N 3. – P. 994-1000.
119. Fricker L.D., Reaves B.J., Das B., Dannies P.S. Comparison of the regulation of carboxypeptidase E and prolactin in GH4C1 cells, a rat pituitary cell line. // Neuroendocrinology. – 1990. – 51, N 6. – P. 658-663.
120. Fricker L.D., Snyder S.H. Enkephalin convertase: purification and charasterization of a specific enkephalin-synthesizing carboxypeptidase localized to adrenall chromaffin granules // Proc. Natl. Acad. Sci. USA. – 1982. – 79. – P. 3886-3890.
121. Fricker L.D., Snyder S.H. Purification and characterization of enkephalin convertase, an enkephaline-synthesizing carboxypeptidase // J. Biol. Chem. – 1983. – 258, N 18. – P. 10950-10955.
122. Fricker L.D., Supattapone S., Snyder S.H. Enkephalin convertase: a specific enkephalin synthesing carboxypeptidase in adrenal chromaffin granules, brain and pituitary gland // Life Sci. – 1982. – 31. – P. 1841-1844.
123. Gainer H., Russel J.T., Loh Y.P. The enzymology and intracellular organization of peptide precursor processing: the secretory vesicle hypothesis // Neuroendocrinology. - 1985. – 40, N 1. – P. 171-184.1992. – 131, N 3. – P. 1054-1062.
124. Gandarias J.M., Irazusta J., Fernandez D., Silio M., Casis L. Membrane-bound pyroglutamyl-arylamidase activity during the first postnatal month in several rat brain areas // Int. J. Dev. Biol. – 1994. – 38, N 1. – P. 127-129.
125. Gandarias J.M., Ramirez M., Zulaica J., Casis L. Aminopeptidase (arylamidase) activity in discrete areas of the rat brain: sex differences // Horm. Metab. Res. – 1989. – 5, N 21. – P. 285-286.
126. Gareth W.R., Ferrier J.N., Yinglee T.J. et al. Peptides the limbic lobe and schisophrenia // Brain Res. – 1983. – 288. N 1. – P. 199-211.
127. Gerdin E., Rane A. N-Demethylation of ethylmorphine in pregnant and nonpregnant women and in men an evaluation of the effects of sex steroids // Brit. J. Clin. Pharmacol. – 1992. – 34, N 3. – P. 250-255.
128. Gerendai I. Modulation of testicular functions by testicular opioid peptides // J. Physiol. Pharmacol. – 1991. – 42, N 4. – P.427-437.
129. Giltay E.J., Hoogeveen E.K., Elbers J.M.H., Gooren L.J.G., Asscheman H., Stehouwer C.D.A. Effects of sex steroids on plasma total homocysteine levels a study in transsexual males and females // J. Clin. Endocrinol. Met. – 1998. – 83, N 2. – P. 550-553.
130. Greco L., Daly L., Kim S., Devi L. Dynorphin-processing endopeptidase in the rat anteriorpituitary lactotrophic cell-line, Gh4C1 // Neuroendocrinology. – 1992. – 55, N 3. – P. 351-356.
131. Grigoriants O., Devi L., Fricker L.D. Dopamine antagonist haloperidol increases carboxypeptidase E mRNA in rat neurointermediate pituitary but not in various other rat tissues // Mol. Brain Res. – 1993. – 19. – P. 161-164.
132. Grimwood B.G., Plummer T.H. Jr., Tarentino A.L. Carboxypeptidase H. A regulatory peptide-processing enzyme produced by human hepatoma Hep G2 cells // J. Tiolog. Chem. – 1989. – 264, N 26. – P. 15662-15667.
133. Guest P.C., Arden S.D., Rutherford N.G., Hutton J.C. The posttranslational processing and intracellular sorting of carboxypeptidase H in the islets of Langerhans // Mol. Cell. Endocrinol. – 1995. – 113, N 1, P. 99-108.
134. Guest P.C., Ravazzola M., Davidson H.W., Orci L., Hutton J.C. Molecular heterogeneity and cellular localization of carboxypeptidase H in the islets of Langerhans // Endocrinology. – 1991. – 129, N 2. – P. 734-740.
135. Guest P.C., Rhodes C.J., Hutton J.C. Regulation of the biosynthesis of insulin secretory granule proteins. Coordinate translational control is exerted on some, but not all, granule К. matrix constituents // Biochem. J. – 1989. – 257, N 2. – P. 431-437.
136. Guest P.C., Pipeleers D., Rossier J., Rhodes C.J., Hutton, J.C. Co-secretion of carboxypeptidase H and insulin from isolated rat islets of Langerhans // Biochem. J. – 1989. – 264, N 2. – P. 503-508.
137. Hamamdzic D., Duzic E., Sherlock J.D., Lanier S.M. Regulation of alpha (2) adrenergic receptor expression and signaling in pancreatic beta cells // Am. J. Physiol. Endocrinol. Met. – 1995. – 32, N 1. – P. E162-E171.
138. Hammer R.P.Jr. Mu-opiate receptor binding in the medial preoptic area is cyclical and sexually dimorphic // Brain Res. – 1990. – 515, N 1-2. – P.187-192.
139. Hanna W.L., Turbov J.M., Jackman H.L., Tan Fulong, Froelich C.J. Dominant chymotrypsin-like esterase activity in human lymphocyte granules is mediated by the serine carboxypeptidase called cathepsin A-like protective protein // Immunol. – 1994. – 153, N 10, P. 4663-4672.
140. Harmar A.J. Neuropeptides // Transmitter Mol. Brain. – 1987. – 1. – P. 17-26.
141. Hendriks D., Scharpe S., van Sande M., Lommaert M.P. A labile enzyme in fresh human serum interferes with the assay of carboxypeptidase N // Clin. Chem. – 1989. – 35, N 1. – P. 177.
142. Hendriks D., Scharpe S., van Sande M., Lommaert M.P. Characterisation of a carboxypeptidase in human serum distinct from carboxypeptidase N // J. Clin. Chem. Clin. Biochem. – 1989. – 27. – P. 277-285.
143. Hendriks D., Soons J., Scharpe S., Wevers R., van Sande M., Holmquist B. Identification of the carboxypeptidase responsible for the post-synthetic modification of creatine kinase in human serum // Clin. Chim. Acta. – 1988. – 172, N 2-3. – P. 253-260.
144. Hendriks D., Wang W., Scharpe S., Lommaert M.P., van Sande M. Purification and characterization of a new arginine carboxypeptidase in human serum // Biochim. Biophys. Acta. – 1990. – 23, N 1034(1). – P. 86-92.
145. Herfeld S., Moller P. Effects of 17-alpha-methyltestosterone on sexually dimorphic characters in the weakly discharging electric fish, brienomyrus-niger (Gunther, 1866) (Mormyridae) – electric organ discharge, ventral body-wall indentation, and anal-fin ray bone expansion // Horm. Behav. – 1998. – 34, N 3. – P. 303-319.
146. Hook V.Y. Arginine and lysine product inhibition of bovine adrenomedullary carboxypeptidase H, a prohormone processing enzyme // Life Sci. – 1990. – 47, N 13. – P. 1135-1139.
147. Hook V.Y. Carboxypeptidase B-like activity for the processing of enkephalin precursors in the membrane component of bovine adrenomedullary chromaffin granules // Neuropeptides. – 1984. – 4, N 2. – P. 117-126.
148. Hook V.Y. Regulation of carboxypeptidase H by inhibitory and stimulatory mechanisms during neuropeptide precursor processing. [Review] // Cell. Mol. Neurobiol. – 1988. – 8, N 1. – P. 49-55.
149. Hook V.Y., Affolter H.U., Palkovits M. Carboxypeptidase H in the hypothalamo neurohypophysial system: evidence for processing and activation of a prohormone processing enzyme during axonal transport // J. Neurosci. – 1990. – 10, N 10. – P. 3219-3226.
150. Hook V.Y., LaGamma E.F. Product inhibition of carboxypeptidase H // J. Biol. Chem. – 1987. – 262, N 26. – P. 12583-12588.
151. Hook V.Y., Lee E.E. Two peptidases that convert 125J-Lys-Arg-(Met)-enkephalin and 125J-enkephalin-Arg6, respectively, to 125J-(Met)-enkephalin in bovine adrenal medullary chromaffin granules // FEBS Lett. – 1984. – 172, N 2. – P. 212-218.
152. Hook V.Y., Loh Y.P. Carboxypeptidase B-like convertasing enzyme activity in secretory granules of rat pituitary // Cell Biol. – 1984. – 81. – P. 2776-2780.
153. Hook V.Y., Mezey E., Fricker L.D., Pruss R.M., Siegel R.E., Brownstein M.J. Immunochemical characterization of carboxypeptidase B-like peptide-hormone-processing enzymes // Proc. Natl. Acad. Sci. USA. – 1982. – 82. – P. 4745-4749.
154. Hook V.Y.H., Affolter H.U. Identification of zymogen and mature forms of human carboxypeptidase H. A processing enzyme for the synthesis of peptide hormones // FEBS Lett. – 1988. – 238, N 2. – P. 338-342.
155. Hook V.Y.H., Eiden L.E. (Met)enkephalin and carboxypeptidase processing enzyme are co-released from chromaffin cells by cholinergic stimulation // Biochem. Biophys. Res. Commun. - 1985. –128. – P. 563-567.
156. Hutchison J.B. Gender-specific steroid metabolism in neural differentiation // Cell. Mole. Neurobiol. – 1997. – 17, N 6. – P. 603-626.
157. Hyder S.M., Murthy L., Stancel G.M. Progestin regulation of vascular endothelial growth factor in human breast cancer cells // Canc. Res. – 1998. – 58, N 3. – P. 392-395.
158. Irminger J.C., Verchere C.B., Halban P.A. Carboxypeptidase E is not a sorting receptor for proinsulin // Mol. Biol. Cell. – 1997. – 8, N S, P. 1786-1786.
159. Irminger J.C., Verchere C.B., Meyer K., Halban P.A. Proinsulin targeting to the regulated pathway is not impaired in carboxypeptidase E deficient Cpe(Fat)/Cpe(Fat) mice // J. Biol. Chem. – 1997. – 272, N 44, P. 27532-27534.
160. Ishida H., Scicli A.G., Carretero O.A. Contributions of various rat plasma peptidases to kinin hydrolysis // J. Pharmacol. Exp. Ther. – 1989. – 251, N 3. – P. 817-820.
161. Ito Y., Misutani S., Kurauchi O., Kasugai M., Narita O., Tomoda Y. Purification and properties of microsomal carboxypeptidase N (kininase I) in human placenta // Enzyme. – 1989. – 42. – P. 8-14.
162. Iwai M., Kanzaki H., Fujimoto M., Kojima K., Hatayama H., Inoue T., Higuchi T., Nakayama H., Mori T., Fujita J. Regulation of sex steroid receptor gene expression by progesterone and testosterone in cultured human endometrial stromal cells // J. Clin. Endocrinol. Met. – 1995. – 80, N 2. – P. 450-454.
163. Jung Y.K., Kunczt C.J., Pearson R.K., Fricker L.D., Dixon J.E. Expression of the rat carboxypeptidase-E gene in neuroendocrine and nonneuroendocrine cell lines // Mol. Endocrinol. – 1992. – 6, N 12. – P. 2027-2037.
164. Jungtestas I., Baulieu E.E. Steroid hormone receptors and steroid action in rat glial cells of the central and peripheral nervous system // J. Steroid Biochem. Mol. Biol. – 1998. – 65, N 1 6. – P. 243-251.
165. Juvvadi S., Fan X.M., Nagle G.T., Fricker L.D. Characterization of aplysia carboxypeptidase E // FEBS Lett. – 1997. – 408, N 2, P. 195-200.
166. Karolczak M., Kupers E., Beyer C. Developmental expression and regulation of aromatase reductase and 5 alpha reductase type I messenger RNA in the male and female mouse hypothalamus // J. Neuroendocrinol. – 1998. – 10, N 4. – P. 267-274.
167. Krakower G.R., Meier D.A., Kissebah A.H. Female sex hormones, perinatal, and peripubertal androgenization on hepatocyte insulin dynamics in rats // Am. J. Physiol. – 1993. – 264, N 3. – P. E342-E347.
168. Krey L.C., Padmanabhan V., Beitins I.Z. Progesterone modulation of gonadotropin secretion by dispersed rat pituitary cells in culture follicle stimulating hormone synthesis and release // Mol. Cell. Endocrinol. – 1993. – 91, N 1 2. – P. 13-20.
169. Krieger D.T. Brain peptides: what, where and why? // Science. – 1983. – 222, N 4627. – P. 975-985.
170. Lacourse K.A., Friishansen L., Rehfeld J.F., Samuelson L.C. Disturbed progastrin processing in carboxypeptidase E deficient fat mice // FEBS Lett. – 1997. – 416, N 1. – P. 45-50.
171. Lancel M., Faulhaber J., Holsboer F., Rupprecht R. The GABA (A) receptor antagonist picrotoxin attenuates most sleep changes induced by progesterone. // Psychopharmacology. – 1999. – 141, N 2, P. 213-219.
172. Laslop A., Tschernitz C. Effects of nerve growth factor on the biosynthesis of chromogranin A and B, secretogranin II and carboxypeptidase H in rat PC12 cells // Neuroscience. -1992. – 49, N 2. – P. 443-450.
173. Levin Y., Skidgel R., Erdos E. Isolation and characterization of the subunits of human plasma carboxypeptidase N (kininase I) // Proc. Natl. Acad. Sci. USA. – 1982. – 79. – P. 4618-4622.
174. Li Z.G., Danis V.A., Brooks P.M. Effect of gonadal steroids on the production of IL 1 and IL 6 by blood mononuclear cells in vitro // Clin. Experim. Rheumatol. – 1993. – 11, N 2. – P. 157-162.
175. Liu X., Wang C.A., Chen Y.Z. Nongenomic effect of glucocorticoid on the release of arginine vasopressin from hypothalamic slices in rats // Neuroendocrinology. – 1995. – 62, N 6. – P. 628-633.
176. Loh Y.P., Parish D.C., Tuteja R. Purification and charasterization of a paired basic residue-specific pro-opiomelanocortin converting enzyme from bovine pituitary intermediate lobe secretory vesicles // J. Biol. Chem. – 1985. – 260, N 12. – P. 7194-7205.
177. Loh Y.P., Birch N.P., Castro M.G. Pro-opiomelanocortin and pro-vasopressin converting enzyme in pituitary secretory vesicles // Biochimie. – 1988. – 70, N 1. – P. 11-16.
178. Loh Y.P., Snell C.R., Cool D.R. Receptor mediated targeting of hormones to secretory granules, role of carboxypeptidase E // Trends Endocrinol. Met. – 1997. – 8, N 4, P. 130-137.
179. Lowry O.H., Rosebrought N.J., Farr A.G., Randall R.J. Protein measurement with Folin phenol reagent // J. Biol. Chem. – 1951. – 193, N 1. – P. 265-275.
180. Lynch D.R., Braas K.M., Hutton J.C., Snyder S.H. Carboxypeptidase E (CPE) immunocytochemical localization in the rat central nervous system and pituitary gland // J. Neurosci. – 1990. – 10. – N 5. – P. 1592-1599.
181. Lynch D.R., Venable J.C., Snyder S.H. Enkephalin convertase in the heart: similar disposition to atrial natriuretic factor // Endocrinology. – 1988. – 122, N 6. – P. 2683-2691.
182. Lynch D.R., Venable J.C., Strittmatter S.M., Snyder S.H. Enkephalin convertase: charasterization and localization using [3H]guanidinoethylmercaptosuccinic acid // Biochimie. – 1988. – 70, N 1. – P. 57-64.
183. MacCumber M.W., Snyder S.H., Ross C.A. Carboxypeptidase E (enkephalin convertase): mRNA distribution in rat brain by in situ hybridization // J. Neurosci. – 1990. – 10, N 8. – P. 2850-2860.
184. Mackin R.B., Spiess J., Goodman R.H, Noe B.D. Primary structure and tissue distribution of anglerfish carboxypeptidase H. // Mol. Cell Endocrinol. – 1991. – 78, N 3. – P. 171-178.
185. Mackin, R.B., Noe, B.D. Charasterization of an islet carboxypeptidase B involved in prohormone processing // Endocrinology. – 1987. – 120, N 2. – P. 457-468.
186. Mains R.E., Eipper B.A. Secretion and regulation of two biosyntetic enzyme activities, peptidyl-glycine a-amidating monooxygenase and a carboxypeptidase, by mouse pituitary corticotropic tumor cells // Endocrinology. – 1984. – 115, N 5. – P. 1683-1690.
187. Manser E., Fernandez D., Loo L., Goh P.Y., Monfries C., Hall C., Lim L. Human carboxypeptidase E., Isolation and characterization of the cDNA, sequence conservation, expression and processing in vitro // Biochem. J. 1990. – 267, N 2. – P. 517-525.
188. Marks N., Berg N., Benuck M., Lo E. –S., Novachenko H., Seyfried C. Prodynorphin processing by rat CNS fractions and purified enzyme: formation of dynorphin A 1-8 by sulfhydryl activated carboxypeptidase and peptidyl dipeptidase // Neurochem. Intern. – 1987. – 10, N 4. – P. 413-422.
189. Marks N., Grynbaum A., Benuck M. On the sequential cleavage of myelin basic protein by cathepsin A and D // J. Neurochem. – 1976. – 27. – P. 765-768.
190. Martinez F., Tesarik J., Martin C.M., Soler A., Mendoza C. Stimulation of tyrosine phosphorylation by progesterone and its 11-oh derivatives - dissection of a Ca2+-dependent and a Ca2+-independent mechanism // Biochem. Biophis. Res. Comm. – 1999. – 255, N 1. – P. 23-27.
191. Matsumoto H., Mori T. Changes in cystine aminopeptidase (oxytocinase) activity in mouse serum, placenta, uterus and liver duringpregnancy or after steroid hormone treatments // Zool. Sci. – 1998. – 15, N 1. – P. 111-115.
192. Mazer N.A. Mimicking the circadian pattern of testosterone and metabolite levels with an enhanced transdermal delivery system // Gurney, Junjinger, Peppas, eds. Pulsatile Drug Delivery: Current Applications and Future Trends. Stuttgart: Wiss. Veri. –Ges. – 1993. – P. 73-97.
193. Mcabee M.D., Doncarlos L.L. Ontogeny of region specific sex differences in androgen receptor messenger ribonucleic acid expression in the rat forebrain // Endocrinology. – 1998. – 139, N 4. – P. 1738-1745.
194. McDonald J.K., Schwabe C. Intracellular exopeptidase // Proteinases in mammalian cells and tissues / Barrett A.J. (ed.). Amsterdam: Elsevier/North Holland Biomedical Press, 1977. – p. 311-391.
195. McKay T.Y., Phelan A.W., Plummer T.H.Jr. Comparative studies on human carboxypeptidases B and N // Arch. Biochem. Biophys. –1979. – 197. – P. 487-492.
196. McKay T.Y., Plummer T.H.Jr. By product-analogues for bovine carboxypeptidase B // Biochemistry. – 1978. – 17. – P. 401-405.
197. McMillian M.K., Hudson P.M., Lee D.Y., Thai L., Hung G.H., Hong J.S. Developmental changes in rat adrenal enkephalin precursor: peptide ratio // Brain Res. Dev. Brain. Res. – 1993. – 71, N 1. – P. 75-80.
198. Melcangi R.C., Froelichsthal P., Martini L., Vescovi A.L. Steroid metabolizing enzymes in pluripotential progenitor central nervous system cells effect of differentiation and maturation // Neuroscience. – 1996. – 72, N 2. – P. 467-475.
199. Melcangi R.C., Maggi R., Martini L. Testosterone and progesterone metabolism in the human neuroblastoma cell-line SH-SY5Y // J. Steroid Biochem.Mol. Biol. – 1993. – 46, N 6. – P. 811—818.
200. Melcangi R.C., Magnaghi V., Cavarretta I., Riva M.A., Martini L. Corticosteroid effects on gene expression of myelin basic protein in oligodendrocytes and of glial fibrillary acidic protein in type 1 astrocytes // J. Neuroendocrinol. – 1997. – 9, N 10. – P. 729-733.
201. Melcangi R.C., Poletti A., Cavarretta I., Celotti F., Colciago A., Magnaghi V., Motta M., Negricesi P., Martini L. The 5 alpha reductase in the central nervous system expression and modes of control // J.Steroid Biochem.Mol. Biol. – 1998. – 65, N 1 6. – P. 295-299.
202. Melrose P., Gross L. Steroid effects on the secretory modalities of gonadotropin-releasing hormone release // Endocrinology. 1987. – 121, N 1. – P. 190—199.
203. Meunier J.C. The opioid peptides and their receptors // Biochem. – 1986. – 68, N 10-11. – P. 1153-1158.
204. Miller L., Hunt J.S. Sex steroid hormones and macrophage function // Life Sciences. – 1996. – 59, N 1. – P. 1-14.
205. Misao R., Itoh N., Mori H., Fujimoto J., Tamaya T. Sex hormone binding globulin mRNA levels in human uterine endometrium // Europ. J. Endocrinol. – 1994. – 131, N 6. – P. 623-629.
206. Mitra A., Song L.X., Fricker L.D. The C-terminal region of carboxypeptidase E is involved in membrane-binding and intracellular routing in AtT-20 cells // J. Biol. Chem. – 1994. – 269, N 31. – P. 19876-19881.
207. Morley J.E. Neuropipdes, behavior and aging // J. Amer. Geriatr. Soc. – 1986. – 34, N 1. – P. 52-62.
208. Moussaoui S., Duval P., Lenoir V., Garret C., Kerdelhue B . CGRP in the trigeminal nucleus, spinal cord and hypothalamus – effect of gonadal steroids // Neuropeptides. – 1996. – 30, N 6. – P. 546-550.
209. Nagae A., Deddish P.A., Becker R.P., Anderson C.H., Abe M., Tan F., Skidgel R.A., Erdos E.G. Carboxypeptidase M in brain and peripheral nerves // J. Neurochem. – 1992. – 59, N 6. – P. 2201-2212.
210. Naggert J.K., Fricker L.D., Varlamov O., Nishina P.M., Rouille Y., Steiner D.F., Carroll R.J., Paigen B.J., Leiter E.H. Hyperproinsulinaemia in obese fat/fat mice associated with a carboxypeptidase E mutation which reduces enzyme activity // Nature Genetics. – 1995. – 10, N 2. – P. 135-42.
211. Nalamachu S.R., Song L.X., Fricker L.D. Regulation of carboxypeptidase E – effect of Ca2+ on enzyme-activity and stability // J. Biol. Chem. – 1994. – 269, N 15. – P. 11192-11195.
212. Neurath H. Carboxypeptidases A and B // Enzymes. – New York, London: Acad Press, 1960. – N 4. – P. 11-36.
213. Nevalainen M.T., Valve E.M., Ahonen T., Yagi A., Paranko J., Harkonen P.L. Androgen dependent expression of prolactin in rat prostate epithelium in vivo and in organ culture // FASEB Journal. – 1997. – 11, N 14. – P. 1297-1307.
214. Nitray J., Sirotkin A., Poltarsky J. Progesterone and testosterone production in granulosa cells of sow ovaries after invitro nonapeptide hormone administration // Veterinarni Medicina. – 1992. – 37, N 7. – P. 371-377.
215. Norenberg U., Richter D. Processing of the oxytocin precursor: isolation of an exopeptidase from neurosecretory granules of bovine pituitaries // Biochem. Biophys. Res. Commun. – 1988. – 156, N 2. – P. 898-904.
216. Normant E., Loh Y.P. Carboxypeptidase E acts as a sorting receptor for routing proinsulin and proenkephalin but not chromogranin A to the regulated secretory pathway // FASEB Journal. – 1997. – 11, N 9, P. 431-431.
217. Normant E., Loh Y.P. Depletion of Carboxypeptidase E, a regulated secretory pathway sorting receptor, causes misrouting and constitutive secretion of proinsulin and proenkephalin, but not chromogranin A // Endocrinology. – 1998. – 139, N 4, P. 2137-2145
218. Nwe K.H.H., Morat P.B., Khalid B.A.K. Opposite effects of sex steroids on 11 beta hydroxysteroid dehydrogenase activity in the normal and adrenalectomized rat testis // Gen. Pharmacol. – 1997. – 28, N 5. – P. 661-664.
219. Olson G.A., Olson R.D., Kastin A.J. Endogenous opiates: 1985 // Peptides. – 1986. – 7, N 5. – P. 907-933.
220. Ortego J., Escribano J., Crabb J., Coca Prados M. Identification of a neuropeptide and neuropeptide processing enzymes in aqueous humor confers neuroendocrine features to the human ocular ciliary epithelium // J. Neurochem. – 1996. – 66, N 2. – P. 787-796.
221. Oyarce A.M., Hand T.A., Mains R.E., Eipper B.A. Dopaminergic regulation of secretory granule associated proteins in rat intermediate pituitary // J. Neurochem. – 1996. – 67, N 1. – P. 229-241.
222. Parkinson D. Carboxypeptidase H in bovine pituitary gland: soluble forms are not processed at the C-terminus // Mol. Cell. Endocrinol. – 1992. – 86, N 3. – P. 221-233.
223. Parkinson D. Two soluble forms of bovine carboxypeptidase H have different NH2-terminal sequences // J. Biol. Chem. – 1990. – 265, N 28. – P. 17101-17105.
224. Pekary A.E., Lukaski H.C., Mena I., Smith S.M., Bhasin S., Hershman J.M. Testosterone increases TRH biosynthesis in epididymis but not heart of zinc deficient rats // Peptides. – 1993. – 14, N 2. – P. 315-324.
225. Perloff M.D., Kream RM., Beinfeld M.C. Reduced levels of substance P in the brains of Cpe(Fat)/Cpe(Fat) Mice // Peptides. – 1998. – 19, N 6, P. 1115-1117.
226. Pineiro V., Casabiell X., Peino R., Lage M., Camina J.P., Menendez C., Baltar J., Dieguez C., Casanueva F.F. Dihydrotestosterone, stanozolol, androstenedione and dehydroepiandrosterone-sulfate inhibit leptin secretion in female but not in male samples of omental adipose tissue in vitro - lack of effect of testosterone // J. Endocrinology. –1999. – 160, N 3. – P. 425-432.
227. Plummer T.H., Hurwitz M.J. Human plasma carboxypeptidase N. Isolation and characterization // J. Biol. Chem. – 1978. – 253. –P. 3907-3912.
228. Pointis G, Latreille M.T, Richard M.O, D'Athis P., Cedard L. Effect of natural progesterone treatment during pregnancy on fetal testosterone and sexual behavior of the male offspring in the mouse // Dev. Pharmacol. Ther. – 1987. –10, N 5. – P. 385-392.
229. Porcelli G., Raffaelli R., Sacchi A., Volpe A.R., Miani C. Localization and characterization of human salivary kininases // Agents Actions Suppl. – 1992. – 38, N 1. – P. 401-406.
230. Pshezhetsky A.V., Potier M. Direct affinity purification and supramolecular organization of human lysosomal cathepsin A // Arch. Biochem. Biophys. – 1994. – 313, N 1. – P. 64-70.
231. Richer J.K., Lange C.A., Wierman A.M., Brooks K.M., Tung L., Takimoto G.S., Horwitz K.B. Progesterone Receptor Variants Found in Breast Cells Repress Transcription by Wild Type Receptors // Breast Canc. Res. Treat. – 1998. – 48, N 3. – P. 231-241.
232. Rodriguez C., Brayton K.A., Brownstein M., Dixon J.E. Rat preprocarboxypeptidase H. Cloning, characterization, and sequence of the cDNA and regulation of the mRNA by corticotropin releasing factor // J. Biol. Chem. – 1989. – 264, N 10. – P. 5988-5995.
233. Roselli C.E., Klosterman S.A. Sexual differentiation of aromatase activity in the rat brain effects of perinatal steroid exposure // Endocrinology. – 1998. – 139, N 7. – P. 3193-3201.
234. Rossier, J., Barres, E., Hutton, J.C., Ricknell, R.J. Radiometric assay for carboxypeptidase H (EC 3.4.17.10) and other carboxypeptidase B-like enzymes // Anal. Biochem. – 1989. – 178, N 1. – P. 27-31.
235. Rouille Y., Chauvet J., Acher R. Partial conversion of vasopressinyl-Gly-Lys-Arg into pharmacologically active vasopressin through secretory granule carboxypeptidase E and alpha-amidating processing enzymes // Biochem. Int. – 1992. – 26, N 4. – P.739-746.
236. Rovere C., Viale A., Nahon J., Kitabgi P. Impaired processing of brain proneurotensin and promelanin concentrating hormone in obese fat/fat mice // Endocrinology. – 1996. – 137, N 7. – P. 2954-2958.
237. Schlamp C.L., Nickells R.W. Light and dark cause a shift in the spatial expression of a neuropeptide processing enzyme in the rat retina // J. Neurosci. – 1996. – 16, N 7. – P. 2164-2171.
238. Seidah N.G., Chretien M. Proprotein and prohormone convertases of the subtilisin family - recent developments and future perspectives // Trends Endocrinol. Met. – 1992. – 3, N 4. – P. 133-140.
239. Sheikh I.A., Kaplan A.P. Mechanism of digestion of bradykinin and lysylbradykinin (kallidin) in human serum. Role of carboxypeptidase, angiotensin-converting enzyme and determination of final degradation products // Biochem. Pharmacol. – 1989. – 38, N 6. – P. 993-1000.
240. Shen F.S., Loh Y.P. Intracellular Misrouting and Abnormal Secretion of Adrenocorticotropin and Growth Hormone in Cpe (Fat) Mice Associated with a Carboxypeptidase E Mutation // Proc. Nat. Acad. Sci. USA. – 1997. – 94, N 10. – P. 5314-5319.
241. Shinohara T., Sakurada C., Suzuki T., Takeuchi O., Campbell W., Ikeda S., Okada N., Okada H. Pro-carboxypeptidase R cleaves bradykinin following activation // Int. Arch. Allergy Immunol. – 1994. – 103, N 4. – P. 400-404.
242. Silva W.I., Benitez K., Ocasio J., Martinez L., Rosario N. Neuropeptide like immunoreactivities and carboxypeptide H activity associated with bovine brain clathrin coated vesicles // Neuropeptides. –1995. – 28, N 6, P. 341-349.
243. Sirotkin A.V. Involvement of steroid hormones in bovine oocytes maturation invitro // J. Steroid Biochem. Mol. Biol. – 1992. – 41, N 38. – P. 855-858.
244. Sirotkin A.V., Nitray J. Steroid hormones regulate cAMP and cGMP production by porcine granulosa cells in vitro // J. Steroid Biochem. Mol. Biol. – 1993. – 46, N 5. – P. 573-577.
245. Sirotkin A.V., Nitray J., Skokanova A., Politov V.P., Jurcovicova J. Marinchenko G.V. Release of a prolactin like substance by bovine granulosa cells in vitro: effects of ovarian steroids // Annales de Endocrinologie. – 1994. – 55, N 6. – P. 279-282.
246. Skidgel R.A., Bennett C.D., Schilling J.W., Tan F.L., Weerasinghe D.K., Erdos E.G. Amino acid sequence of the N-terminus and selected tryptic peptides of the active subunit of human plasma carboxypeptidase N: comparison with other carboxypeptidases // Biochem. Biophys. Res. Commun // 1988. – 15, N 154 (3). – P. 1323-1329.
247. Skidgel R.A., Davis R.M., Tan F. Human carboxypeptidase M. Purification and characterization of a membrane-bound carboxypeptidase that cleaves peptide hormones // J. Biol. Chem. – 1989. – 264, N 4. – P. 2236-2241.
248. Skidgel R.A., Johnson A.R., Erdos E.G. Hydrolisys of opioid hexapeptides by carboxypeptidase N. Presence of carboxypeptidase in cell membranes // Biochem. Pharmacol. – 1984. – 33, N 21. – P. 3471-3478.
249. Skidgel R.A., Tan F. Structural features of two kininase I-type enzymes revealed by molecular cloning // Agents Actions Suppl. – 1992. – 38, N 1. – P. 359-367.
250. Smith D.R., Pallen C.J., Murphy D., Lim L. Pituitary-specific transcriptional initiation sites of the rat carboxypeptidase-H gene and the influence of thyroid hormone status // Mol. Endocrinol. – 1992. – 6, N 5. – P. 713-722.
251. Smyth D.G., Maruthainar K., Darby N.J., Fricker L.D. Catalysis of slow C terminal processing reactions by carboxypeptidase H // J. Neurochem. – 1989. – 53, N 2. – P. 489-493.
252. Sochorova R., Mosnarova A., Huzulakova I. The possible influence of testosterone on calcium ion transport (investigated) in guinea pig uterus // Acta Phisiologica Hungarica. – 1991. – 77, N 1. – P. 19-24.
253. Song L.X., Fricker L. Processing of procarboxypeptidase E into carboxypeptidase E occurs in secretory vesicles // J. Neurochem. – 1995. – 65, N 1, P. 444-453.
254. Song L.X., Fricker L.D. The pro region is not required for the expression or intracellular routeing of carboxypeptidase E // Biochemical Journal. – 1997. – 323, N 4. – P. 265-271.
255. Song Lixin, Fricker L.D. Calcium and pH dependent aggregation of carboxypeptidase E // J. Biol. Chem. – 1995. – 270, N 14. – P. 7963-7967.
256. Stack G., Fricker L.D., Snyder S.H. A sensitive radiometric assay for enkephalin convertase and for carboxypeptidase B-like enzymes // Life Sci. – 1984. – 34. – P. 113-121.
257. Stanisz A.M., Scicchitano R., Payan D., Bienestock J. In vitro studies of immunoregulation by substance P and somatostatin // Second Intern. Workshop on NIM: Scientific Programme and Abstracts. – Dubrovnik, 1986. – P.37.
258. Steiner D.F. The biosynthesis of biologically active peptides: a perspective // Peptide Biosynthesis and Processing (Fricker L.D., ed.).– CRC Press, Boca Raton, Florida, 1991.– P. 1-16.
259. Stone T.E., Li J.P., Bernasconi P. Purification and Characterization of the Manduca Sexta Neuropeptide Processing Enzyme Carboxypeptidase E // Arch. Insect Biochem. Phisiol. – 1994. – 27, N 3, P. 193-203.
260. Strittmatter S.M., Lynch D.R., Snyder S.H. (3H)guanidinoethyl-mercaptosuccinic acid binding to tissue homogenates. Selective labeling of enkephalin convertase // J. Biol. Chem. – 1984. – 259, N 19. – P. 11812-11817.
261. Sullivan D.A., Kelleher R.S., Vaerman J.P., Hann L.E. Androgen Regulation of Secretory Component Synthesis by Lacrimal Gland Acinar Cells Invitro // J. Immunol. – 1990. – 145, N 12. – P. 4238-4244.
262. Supattapone S., Fricker L.D., Snyder S.H. Purification and characterization of a membrane-bound enkephalin-forming carboxypeptidase, “enkephalin convertase” // Neurochem. – 1984. – 42, N 4. – P. 1017-1023.
263. Tan F., Chan S.J., Steiner D.F., Schilling J.W., Skidgel R.A. Molecular cloning and sequencing of the cDNA for human membrane-bound carboxypeptidase M. Comparison with carboxypeptidases A, B, H, and N // J. Biol. Chem. – 1989. – 264, N 22. – P. 13165-13170.
264. Tanabe K., Tamura T., Saijo A., Kikuchi M., Sho R., Mashu A., Kobayashi T., Nozawa S. Modulation of progesterone secretion by androgens in porcine granulosa cell cultures // Horm. Res. – 1992. – 37, N S1. – P. 25-31.
265. Thiele E.A, Eipper B.A. Effect of secretagogues on components of the secretory system in AtT 20 cells // Endocrinology. – 1990. – 126, N 2. – P. 809-817.
266. Thomas A., Kim N.B., Amico J.A. Sequential exposure to estrogen and testosterone (T) and subsequent withdrawal of T increases the level of arginine vasopressin messenger ribonucleic acid in the hypothalamic paraventricular nucleus of the female rat // J. Neuroendocrinol. – 1996. – 8, N 10. – P. 793-800.
267. Thomas A., Shughrue P.J., Merchenthaler I., Amico J.A. The effects of progesterone on oxytocin messenger-RNA levels in the paraventricular nucleus of the female rat can be altered by the administration of diazepam or RU486 // J. Neuroendocrinol. – 1999. – 11, N 2, P. 137-144.
268. Tschernitz C, Laslop A, Eiter C, Kroesen S, Winkler H. Biosynthesis of large dense core vesicles in PC12 cells: effects of depolarization and second messengers on the mRNA levels of their constituets // Brain. Res. Mol. Brain Res. – 1995. – 31, N 1-2. – P. 131-140.
269. Udupi V., Gomez P., Song L.X., Varlamov O., Reed J.T., Leiter E.H., Fricker L.D., Greeley G.H. Effect of carboxypeptidase E deficiency on progastrin processing and gastrin messenger ribonucleic acid expression in mice with the fat mutation // Endocrinology. – 1997. – 138, N 5, P. 1959-1963.
270. Van Sande M., Hendriks D., Soons J., Scharpe S., Wevers R., Holmquist B. Post synthetic modificati-on of CK-MM by kininase I // Adv. Exp. Med. Biol // 1989. – 247A. – P. 319-324.
271. Varlamov O., Fricker L.D. The C terminal region of carboxypeptidase E involved in membrane binding is distinct from the region involved with intracellular routing // J. Biol. Chem. – 1996. – 271, N 11. – P. 6077-6083.
272. Varlamov O., Fricker L.D., Furukawa H., Steiner D.F., Langley S.H., Leiter E.H. Beta cell lines derived from trans genic Cpe(Fat)/Cpe(Fat) mice are defective in carboxypeptidase E and proinsulin processing // Endocrinology. – 1997. – 138, N 11, P. 4883-4892.
273. Varlamov O., Leiter E.H., Fricker L. Induced and spontaneous mutations at Ser202 of carboxypeptidase E. Effect on enzyme expression, activity, and intracellular routing // J. Biol. Chem. – 1996. – 271, N 24. – P. 13981-13986.
274. Voss A.K., Fortune J.E. Estradiol 17 beta has a biphasic effect on oxytocin secretion by bovine granulosa cells // Biol. Reprod. – 1993. – 48, N 6. – P. 1404-1409.
275. Wallace E.F., Evans C.J., Jurik, S.M., Mettord I.N., Barchas J.D. Carboxypeptidase B activity from adrenal medulla - is it involved in the processing of proenkephalin? // Life Sci. – 1982. – 31, N 16-17. – P. 1793-1796.
276. Wang W., Hendriks D.F., Scharpe S.S. Carboxypeptidase U, a plasma carboxypeptidase with highaffinity for plasminogen // J. Biol. Chem. – 1994. – 269, N 22. – P. 15937-15944.
277. Wardlow S.L. Regulation of b-endorphin, corticotropin-like intermediate lobe peptide, and a-melanotropin-simulating hormone in the hypothalamus by testosterone // Endocrinology. – 1986. – 119, N 1. – P. 19—24.
278. Weil S.J., Vendola K., Zhou J., Adesanya O.O., Wang J., Okafor J., Bondy C.A. Androgen receptor gene expression in the primate ovary cellular localization, regulation, and functional correlations // J. Clin. Endocrinol. Met. – 1998. – 83, N 7. – P. 2479-2485.
279. Wevers R.A., Boegheim J.P., Hommes O.R., Van Landeghem A.A., Mul-Steinbusch M.W., Van der Stappen J.W., Soon J.B. A study on post-synthetic modification in alpha-alpha enolase brought about by a human serum prtotein // Clin. Chem. Acta. – 1984. – 139. – P. 127-135.
280. Wilson M.A., Biscardi R. Influence of gender and brain region on neurosteroid modulation of GABA responses in rats // Life Sci. – 1997. – 60, N 19. – P. 1679-1691.
281. Yajima R., Chikuma T., Kato T. A rapid anterograde axonal transport of carboxypeptidase H in rat sciatic nerves // J. Neurochem. – 1994. – 63, N 3, P. 997-1002
282. Yamamoto T., Nishiyama M., Naka A. et.al. Role of epidermal grouwth factor in reproduction // Acta Obstetr. Gynaecol. Jap. – 1988. – 40, N 5. – P. 649-654.
283. Zheng M., Streck R.D., Scott R.E.M., Seidah N.G., Pintar J.E. The developmental expression in rat of proteases furin, Pc1, Pc2, and carboxypeptidase E - implications for early maturation of proteolytic processing capacity // J. Neurosci. – 1994. – 14, N 8. – P. 4656-4673.
284. Zisapels N., Sokolowsky M. Metallocarboxypeptidases: a cadmium carboxypeptidase B with peptidase activity // Biochem. Biophys. Res. Commun. – 1973. – 53, N 8. – P. 722.
Похожие работы
... нервной и эндокринной регуляции в организме // Усп. совр. биол. – 1981. – 19, № 3. – С. 380-382. 23. Вернигора А.Н., Бардинова Ж.С., Сметанин В.А., Генгин М.Т. Активность основных карбоксипептидаз в тканях самок крыс на разных стадиях эстрального цикла // Укр. биохим. журн. – 2003. – 75, № 5. – С. 99-102 24. Вернигора А.Н. Карбоксипептидаза Н мозга животных в норме и при действии стресс- ...
... о динамике изменения активности ферментов. ГЛАВА 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 3.1. Исследование активности основных карбоксипептидаз в тканях крыс разного возраста, испытавших пренатальное воздействие этанола 3.1.1. Исследование активности карбоксипептидазы Н в тканях пренатально алкоголизированных крыс разного возраста Согласно данным дисперсионного анализа пренатальное воздействие ...
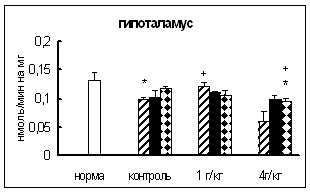
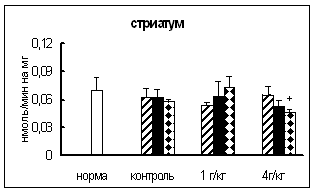
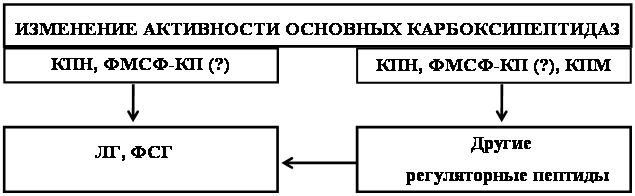

0 комментариев