Навигация
Полимеразная цепная реакция и электрофорез
Реферат на тему:
ПЦР-реакция и электрофорез
2009
ПЦР-реакция
Может возникнуть необходимость увеличить количество индивидуальной кДНК до ее введения в плазмиду с помощью какого-то процесса ее воспроизводства. Такой процесс разработан и широко применяется не только для решения этой частной задачи, но и во всех случаях, когда необходимо умножить количество определенных фрагментов ДНК. Например, фрагментов, содержащих изучаемый ген и его регуляторное окружение.
Процесс этот получил название ПЦР-реакция, что расшифровывается как полимеразная цепная реакция. (В английском названии PCR — polymerase chain reaction.) Невольно напрашивается сопоставление с реакцией атомного взрыва. И, пожалуй, оно не лишено смысла — нарастание количества нужной ДНК происходит чрезвычайно быстро, даже бурно.
Рассмотрим эту реакцию для общего случая — наработки множества копий некоего фрагмента ДНК, содержащего в какой-то своей части интересующую нас последовательность пар оснований. Итак, допустим, что нам известна последовательность нуклеотидов на достаточно большом протяжении некой ДНК и есть основания предполагать, что внутри этой последовательности лежит интересующий нас участок. Рассмотрим серию операций, ведущих к его выделению и умножению.
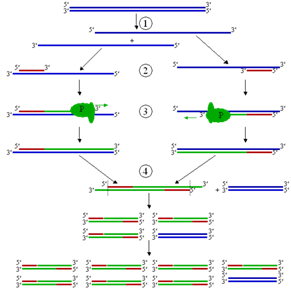
Сначала в местах, лежащих близко, но заведомо за пределами интересующего нас участка ДНК, выберем две последовательности — по 20 пар нуклеотидов, лежащих по обе стороны от этого участка. Исходя из этих последовательностей синтезируем химически два однонитевых праймера на основе дезоксирибонуклеотидов. Первый — комплементарно к условно «первой» нити ДНК с ее Законна, второй — комплементарно ко «второй» нити с ее Законна. Очевидно, что праймеры будут разные.
Теперь добавим в буфер, где растворено малое количество исходной ДНК оба праймера в большом избытке, нагреем смесь до температуры 94°, а потом быстро охладим до 50°. ДНК денатурируется при 94°, ее нити расходятся. При 50° оба праймера гиб-ридизируются с выбранными для них участками однонитевых ДНК. Это произойдет быстро, так как праймеры имеются в избытке и, кроме того, вследствие своей малости они подвижны и легко «найдут» свои посадочные места. Ренатурация ДНК происходит медленно. За те 2 минуты, что будет продолжаться этот этап, ДНК практически не ренатурируется, а праймеры успеют надежно гибридизоваться с комплементарными для них участками обеих нитей. Такая ситуация отражена на рисунке 35 (1). Праймеры, как обычно, садятся с 3"-конца матричной нити ДНК и направляют движение будущей ДНК-полимеразы к ее 5'-концу. Это направление указано стрелками. Для удобства описания дальнейших событий, присвоим праймерам названия «левый» (стрелка зачернена) и «правый» (стрелка не зачернена).
Теперь быстро поднимем температуру смеси до 72 °С. при этой температуре нити ДНК заведомо не сойдутся, а праймеры еще удержатся на своих местах. Внесем в раствор ДНК-полимеразу. Вообще-то говоря, она там была с самого начала!
Но что это за фермент, который не денатурируется при 94°, а при 72° сейчас начнет вести комплементарный синтез ДНК? К счастью, такая ДНК-полимераза существует. Ее называют «Taq ДНК-полимераза» и выделяют из очень термофильных бактерий «Thermus aquaticus», прекрасно размножающихся при температуре 85 °С.
Итак, переходим к этапу 2, где изображен процесс матричного синтеза комплементарной нити ДНК, начинающийся от праймера и продолжающийся без других ограничений (что отмечено стрелой), кроме ограничения длительности этого этапа (3 минуты). Мы будем для простоты рисунка рассматривать события, начинающиеся с копирования только одной нити, хотя, конечно, будут копироваться обе. Они совершенно равноправны, и в заключение нашего анализа надо будет просто удвоить полученный результат. Через 3 минуты оканчивается 2-й этап и температура снова скачком поднимается до 94°, а еще через одну минуту быстро снижается до 50°. Эта ситуация отражена на этапе 3. При 94° новосинтезированная нить ДНК отделилась от материнской нити. (Последнюю, для ясности, я здесь и всюду далее изображаю жирной линией.) В составе новосинтезированной копии я больше не изображаю «левый» праймер, поскольку он был комплементарен материнской нити ДНК и потому вместе с участком, синтезированным ДНК-полимеразой, вошел в состав копии. Зато на эту копию с ее 3'-конца при 50° на предназначенный для него участок (ведь копия тождественна «второй» материнской нити) уже сел «правый» праймер. На освободившуюся материнскую нить с ее З*-конца тоже сел праймер — «левый», но, конечно, не тот, что ушел с копией, а другой, точно такой же. Благо праймеры имеются в избытке.
На этапе 4 (при 72°) показаны два новых комплементарных синтеза. Тот, что идет по материнской нити, по-прежнему, пространственно не ограничен. А вот тот синтез, что начинается от правого праймера, сидящего на новосинтезированной копии окончится там, где в этой копии «спрятан» весь бывший «левый» праймер — ведь с него эта копия начиналась. В результате здесь впервые появляется выбранный для умножения участок ДНК, ограниченный двумя праймерами, включая и их самих. Это хорошо видно на этапе 5, когда после нагрева до 94° все двойные нити разошлись и на рисунке оказываются уже 4 одинарных нити, на которые, туда «где им положено» село 4 праймера (два «левых» и два «правых»). Этап 6 — синтез 4-х копий, начинающихся от этих праймеров. В трех случаях из четырех он ограничен длиной нужного отрезка ДНК. (Материнская нить здесь, как и всюду дальше копируется без ограничения справа.) Вместе с образованным на 4-м этапе и уже обрезанным с обеих сторон участком мы получаем 4 фрагмента исходной ДНК нужного размера. Это хорошо видно на этапе 7, где все четыре пары нитей ДНК разошлись и на них уже сидят 8 праймеров...
Если у читателя хватило терпения разобраться во всей этой «механике», то он согласится, что после синтеза на этапе 8 получится уже 11 отрезков ДНК нужной длины. Заметим попутно, что хотя мы рассматриваем «потомство» одной только «первой» материнской нити, среди полученных отрезков будут копии участков как «первой», так и «второй» материнской нити, поскольку мы уже не один раз вели комплементарный матричный синтез.
Проследим теперь закономерность, отраженную в цифрах, стоящих справа от рисунка, около изображений 3-го, 5-го, 7-го и 8-го этапов. Перед скобкой каждый раз стоит число одиночных нитей ДНК после нагревания до 94°. Легко заметить, что оно неизменно удваивается. Что и следовало ожидать, поскольку на каждом из предыдущих четных этапов все имеющиеся в наличии нити ДНК так или иначе копируются.
Но вот что может показаться неожиданным, и в чем состоит вся суть ПЦР-реакции. Число фрагментов нужного размера, указанное в скобках, нарастает несравненно быстрее: 0-1-4—11 штук. Так будет и далее. Каждый укороченный отрезок будет копироваться в том же размере. И число их будет непрерывно пополняться за счет не сразу укороченных отрезков ДНК. Через 30 циклов, подобных рассмотренным (а каждый цикл — это два этапа) количество нитей ДНК достигнет огромной цифры. Притом практически все они уже будут нужной длины — и выделение фрагмента, и его умножение состоялось! Вспомним, что у нас исходно было две нити. Таким образом написанное число надо удвоить.
Что это означает не в штуках, а в весовых единицах? Можно подсчитать, что если имелось изначально всего 10 молекул ДНК, длиной в 1000 пар оснований каждая, то в результате 30-ти циклов ПЦР-реакции должно получиться около 2-х микрограммов необходимого генетического материала. Для современных методов исследования это весьма значительное количество.
На самом деле в таких подсчетах конечный выход ДНК получится значительно завышенным, потому что Taq ДНК-полимера-за изнашивается, а после 30 циклов и вовсе перестает «работать». Но ведь можно внести новую порцию фермента и запустить еще 30 циклов. (Замечу попутно, что Taq ДНК-полимераза не очень «строга». После 30 циклов в среднем 1 нуклеотид из 400 оказывается включенным ошибочно.)
Разумеется, все эти циклы осуществляются не вручную, а в специальном приборе, от которого, впрочем, требуется не многое. Только очень быстро по обозначенной выше программе менять температуру весьма малого объема жидкости (защищенной от испарения тонким слоем минерального масла). Что же касается продолжительности 30-ти циклов, то даже, если учесть, что длительность синтеза приходится по указанной выше причине постепенно увеличивать от 3-х до 10-ти минут, то на один цикл прибор будет затрачивать в среднем 12 минут. А на 30 циклов — 6 часов.
От экспериментатора требуется только правильно составить рабочую смесь. Разумеется, если праймеры уже выбраны и синтезированы в достаточном количестве. Taq ДНК-полимераза и нуклеозидтрифосфаты имеются в продаже. Наработку большого количества определенного гена при помощи ПЦР-реакции часто называют «клонированном» этого гена. Описанную здесь ПЦР-реакцию с двумя праймерами иногда именуют «симметричной», в отличие от другой тоже ПЦР-реакции, но с одним начальным праймером, которую называют «ассиметричной».
ПЦР-реакцию надо включить в описанную там последовательность операций между получением кДНК и включением ДНК в плазмиду. В этом случае последовательность 21-го нуклео-тида для праймеров придется выбирать не свободно, а точно по концам гена, кодирующего наш белок. Эти оба конца можно установить, как это было описано с помощью ЧИП-метода. Для этого даже не надо знать всю аминокислотную последовательность белка, а только концевые участки — по 7 аминокислот с каждого конца. (Благо, как упоминалось, секвенирование белка теперь можно начинать с любого конца.) При синтезе концевого праймера надо только добавить концевой кодон УГА, который не транскрибируется в иРНК. Кроме того к «наружным» концам обоих праймеров имеет смысл уже на этом этапе добавить небольшие последовательности нуклеотидов, которые, не будучи комплементарны ни к какому участку гена, не будут и гибридизоваться. Но могут образовать два «липких» конца для последующего включения размноженной кДНК в разрезанные плазмиды. На рис. 35 эти дополнительные последовательности изображены в виде «хвостиков» у праймеров. Напомню, что эта размноженная кДНК нам потребовалась для того, чтобы добиться достаточно эффективного включения содержащих ее плазмид в бактерию, которая, размножаясь, будет нарабатывать в большом количестве нужный нам белок.
Весь полный комплекс мер по умножению количества индивидуального белка иной раз оказывается столь эффективным, что чужеродный белок в цитоплазме бактерий-рециплиентов появляется в ходе их размножения в виде гранул. Он ведь чужой — и потому не расходуется в самой бактерии. После лизиса клеток гранулы можно собрать простым центрифугированием. Для их диссоциации приходится использовать обработку осадка щелочью, детергентами и мочевиной. Белок денатурируется. Для его ренатурации приходится прибегать к разбавлению, диализу от денатурирующих добавок, изменению рН и ионной силы среды.
Подлинность наработанного белка проверяют по ферментативной активности, если он должен таковой обладать. Или же по электрофорезу — сравнением с контрольным препаратом. Но надежнее — одним из иммунологических методов контроля, с которыми мы познакомимся в свое время.
Похожие работы
... . Тем не менее, при условии решения проблемы конкуренции за праймеры, этот способ контроля эффективности амплификации безусловно будет весьма полезен. 4. Методы, основанные на полимеразной цепной реакции 4.1 Качественный анализ Классический способ постановки ПЦР, принципы которого были изложены выше, нашел свое развитие в некоторых модификациях, направленных на преодоление ограничений ...
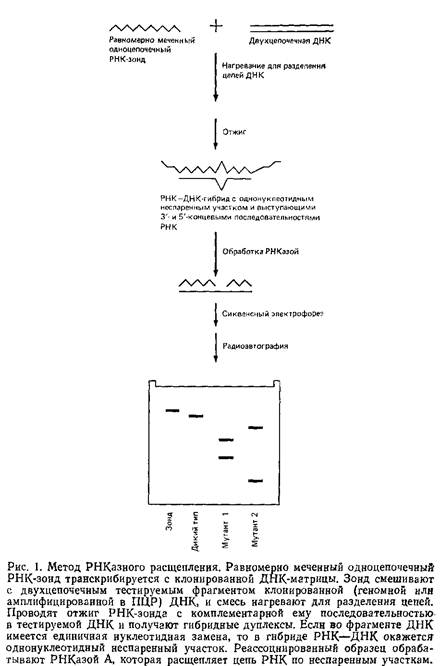
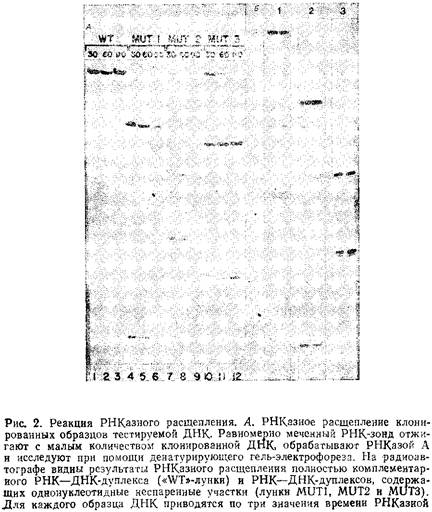
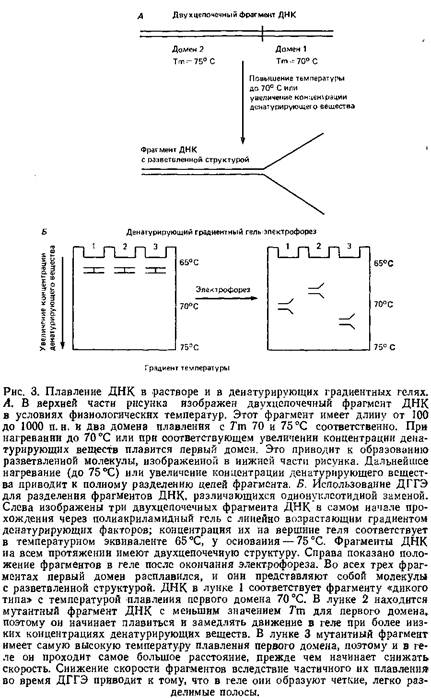
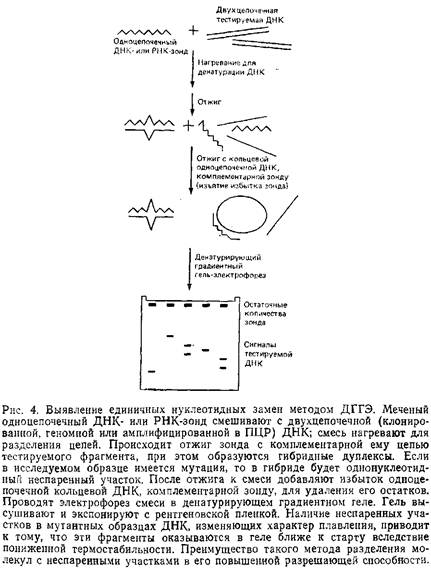
... геле. Поэтому приведенные ниже методики для исследования образцов ДНК с равным успехом могут использоваться и при работе с РНК. 1.2 Денатурирующий градиентный гель-электрофорез Два фрагмента ДНК, различающиеся лишь делецией, инсерцией или заменой одного нуклеотида, или единственным неспаренным нуклеотидом, можно легко разделить при помощи денатурирующего градиентного гель-электрофореза, ДГГЭ ...
... использования; - лаборант во время выделения должен быть одет в специальный халат, шапочку и очки. Все манипуляции с исследуемым материалом проводят при соблюдении правил работы с вирусами III и IV группы. Постановку ПЦР осуществляют как минимум в 3 рабочих зонах: Зона 1 (ламинарный бокс, бокс с УФ-лампой): подготовка ПЦР-реагентов. Зона 2 (ламинарный бокс, бокс с УФ-лампой): подготовка проб ...
... , вызванные динамическими му-тациями.-----------------------T-----------T-------T-----T------T------T----------------------¬ Болезнь, номер по ¦ Ген, лока-¦Триплет¦Норма¦Прему-¦Мута- ¦Литература ¦ МакКьюсику (MIM) ¦ лизация ¦ ¦ ¦тация ¦ция ¦ ¦ -----------------------+-----------+-------+-----+------+------+----------------------+ Синдром ломкой X-хро- ¦FMR1, FRAXA¦(CGG)n ...
0 комментариев