Навигация
Обнаружение единичных нуклеотидных замен в ДНК: расщепление РНКазой и денатурирующий градиентный гель-электрофорез
Обнаружение единичных нуклеотидных замен в ДНК: расщепление РНКазой и денатурирующий градиентный гель-электрофорез
Введение
Методы обнаружения нуклеотидных замен в геномной ДНК позволили исследователям разобраться в природе многих наследственных болезней человека. Эти методы дают возможность идентифицировать специфические мутации, приводящие к заболеванию, а также полиморфные участки ДНК, используемые в качестве маркеров в генетическом анализе. Благодаря развитию методов выявления нуклеотидных замен стала реальностью пренатальная диагностика многих наследственных болезней человека. Если ген, отвечающий за заболевание, известен, соответствующую мутацию можно обнаружить в геномной ДНК или в РНК при помощи блот-гибридизации с использованием меченых олигонуклеотидов в качестве гибридизационных зондов. В том случае, когда мутировавшая нуклеотидная последовательность неизвестна, замены нуклеотидов можно определить по полиморфизму длины рестрикционных фрагментов. ПДРФ обнаруживается по наличию или отсутствию сайта рестрикции во фрагменте геномной ДНК при гибридизации меченого ДНК-зонда с обработанной рестриктазами геномной ДНК, расфракционированной по размеру в агарозном геле и перенесенной на мембранный фильтр. Этот метод оказался очень эффективным для выявления как значимых мутаций, так и нейтрального полиморфизма в геноме человека и других организмов. Однако большую часть мутаций и полиморфных участков генома не удается обнаружить с помощью анализа ПДРФ, поскольку вероятность того, что замена нуклеотида изменит именно сайт рестрикции, низка. Так, например, многие точковые мутации гена р-глобина человека, вызывающие талассемию, не изменяют сайтов рестрикции, а потому не могут быть непосредственно определены прн анализе ПДРФ. Кроме того, оказалось, что в некоторых участках генома млекопитающих полиморфизм незначителен, что крайне затрудняет выявление в них ПДРФ даже при использовании большого числа различных рестриктаз. Каждый из них позволяет идентифицировать по крайней мере 50% всех возможных замен нуклеотидов на участке ДНК Длиной до 1000 п.н.
Задача настоящей работы – подробно изложить суть новых методов, обсудить их преимущества и недостатки, рассмотреть некоторые модификации. Кроме того, мы на примерах покажем, как можно использовать предложенные нами методы для исследования фрагментов ДНК, полученных при амплификации специфических последовательностей в ходе полимеразной цепной реакции.
1. Общее описание методов
1.1 РНКазное расщепление
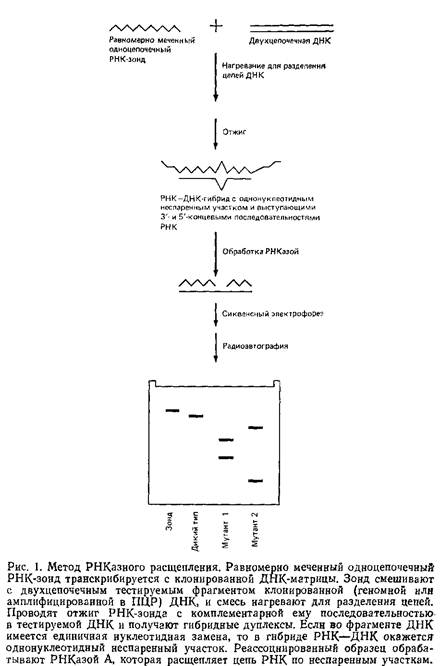
Единичные нуклеотндные замены во фрагментах геномной ДНК можно обнаружить при расщеплении неспаренных участков в РНК-ДНК-дуплексах, обрабатывая эти дуплексы РНКазой А. Рис. 1 иллюстрирует последовательные этапы процедуры.
1. Синтез равномерно меченного одноцепочечного РНК-зонда с использованием транскрипции in vitro клонированного фрагмента ДНК.
2. Гибридизация зонда с комплементарными последовательностями геномных ДНК – Если в гибриднзуемой ДНК имеется замена нуклеотида, образующие РНК–ДНК-дуплексы содержат однонуклеотндные неспаренные участки.
3. Обработка дуплекса РНКазой А, приводящая к расщеплению цепи РНК по многим, хотя и не по всем, неспаренным нуклеотидам.
4. Анализ меченых фрагментов РНК при помощи денатурирующего гель-электрофореза с последующей радиоавтографией. В этом случае эффективное расщепление по неспаренным основаниям приводит к появлению на радиоавтографах двух меченых фрагментов РНК, размеры которых указывают на положение нуклеотидной замены относительно концов фрагмента ДНК. Одиночный меченый фрагмент РНК, равный по длине фрагменту ДНК, наблюдается в том случае, если в последнем нет нуклеотидных замен или если существующие замены препятствуют расщеплению РНК–ДНК-Дуплекса РНКазой.
На рис. 2 в качестве примера представлены результаты реакций РНКазного расщепления. При такой обработке расщепляется примерно 30–40% от общего числа неспаренных участков в РНК–ДНК-дуплексе. Тестирование фрагмента ДНК в двух независимых реакциях РНКазного расщепления с двумя зондами, комплементарными каждой из его цепей, позволяет выявить в нем 60–70%: всех возможных замен нуклеотидов, так как в этом случае обнаруживаются даже комплементарные замены в обеих цепях.
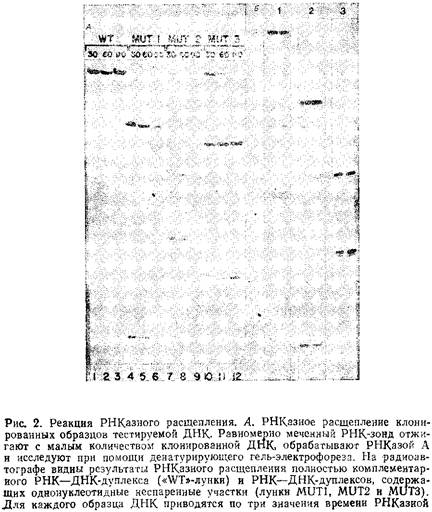
Оптимальными, на наш взгляд, являются РНК-зонды и соответственно исследуемые на однонуклеотидные замены участки ДНК длиной от 100 до 1000 нуклеотидов. В этом случае и сам зонд, и продукты его расщепления легко выявляются при помощи денатурирующего гель-электрофореза в полиакриламидном геле, аналогичном используемому при секвенировании ДНК. При этом отношение сигнала к фону достаточно высоко для получения четких результатов. Совсем нетрудно наработать меченые одноцепочечные РНК-зонды гораздо большей длины, но результаты обработки таких длинных цепей РНКазой неоднозначны. Еще одна проблема, которая возникает при использовании зондов с длиной цепи более 1000 п.и., заключается в том, что под действием РНКазы наряду с расщеплением РНК–ДНК-дуплексов по неспаренным участкам может происходить расщепление цепи РНК по комплементарно спаренным участкам дуплекса. Кроме того, анализ продуктов расщепления длинных РНК-зондов требует проведения денатурирующего электрофореза в агарозном геле. При этом в ряде случаев не удается полностью разделить гибриды РШ–ДШ и результаты получаются противоречивыми, так как фрагменты РНК, полученные при расщеплении ее по неспаренным участкам, но оставшиеся связанными с ДНК, обнаруживаются в геле в зонах, соответствующих длине всего зонда. Для более эффективного выявления единичных нуклеотидных замен путем РНКазного расщепления мы использовали по несколько зондов в каждой реакции отжига / расщепления. Однако полученные таким способом результаты зачастую очень неоднозначны и с трудом поддаются интерпретации. В силу перечисленных причин при исследовании фрагментов ДНК на единичные замены мы бы рекомендовали использовать в реакциях РНКазного расщепления РНК-зонды длиной от 100 до 1000 нуклеотидов.
Показано, что рибонуклеаза может расщеплять неспаренные участки и в дуплексах РНК–РНК. По данным Перучо, единичные мутации в H-ras-гене выявляются при расщеплении неспаренных участков дуплекса РНК–РНК, образованного мРНК гена H-ras и его «антисмысловой» мРНК. Наши исследования показали, что естественные мутации в гене р-глобина и искусственные мутации в промоторном участке гена р-интерферона можно обнаружить при РНКазном расщеплении как РНК – ДНК-, так и РНК–РНК-дуплексов. На клонированной ДНК-матрице мы получали равномерно меченные одноцепочечные зонды «антисмысловой РНК», ренатурировали их с комплементарной мРНК, обрабатывали образовавшиеся дуплексы РНКазой, а затем идентифицировали продукты расщепления денатурирующим электрофорезом в полиакриламидном геле. Поэтому приведенные ниже методики для исследования образцов ДНК с равным успехом могут использоваться и при работе с РНК.
Похожие работы
... , вызванные динамическими му-тациями.-----------------------T-----------T-------T-----T------T------T----------------------¬ Болезнь, номер по ¦ Ген, лока-¦Триплет¦Норма¦Прему-¦Мута- ¦Литература ¦ МакКьюсику (MIM) ¦ лизация ¦ ¦ ¦тация ¦ция ¦ ¦ -----------------------+-----------+-------+-----+------+------+----------------------+ Синдром ломкой X-хро- ¦FMR1, FRAXA¦(CGG)n ...
0 комментариев