Навигация
Маркировка и оформление лекарственных средств должны соответствовать требованиям настоящего Федерального закона;
1. маркировка и оформление лекарственных средств должны соответствовать требованиям настоящего Федерального закона;
2. лекарственные средства поступают в обращение, если на внутренней и внешней упаковках хорошо читаемым шрифтом на русском языке указаны:
а) название лекарственного средства и международное непатентованное название;
б) название предприятия – производителя лекарственных средств;
в) номер серии и дата изготовления;
г) способ применения;
д) доза и количество доз в упаковке;
е) срок годности;
ж) условия отпуска;
з) условия хранения;
и) меры предосторожности при применении лекарственных средств.
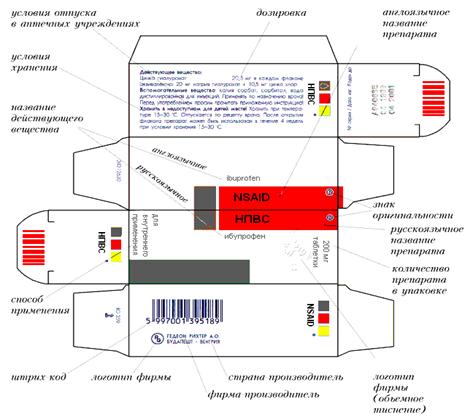
На основе опыта международных коммерческих операций, торговых соглашений выработалось более менее единое представление о маркировке и оформлении ЛС. Маркировка ЛС должна соответствовать следующим требованиям. На внутренней и внешней упаковках на каждой единице потребительской тары с лекарственным средством (банке, флаконе, тубе, пачке, коробке, пачке с ампулами и т.д.) на этикетку или непосредственно на поверхность тары любым способом должна быть нанесена чёткая и легкочитаемая следующая маркировка на национальном языке:
– торговое название лекарственного средства и (если оно имеется и не совпадает с названием лекарственного средства) и международное непатентованное название ЛС, название препарата на латинском и русском или национальном языке, латинское название должно иметь более мелкий шрифт, чем название на национальном языке;
– состав препарата (указывается концентрация или содержание в весовых, объёмных или относительных величинах действующих компонентов) и перечисляются все вспомогательные вещества;
– лекарственная форма;
– название предприятия-производителя, его товарный знак, юридический адрес, страна-производитель, разработчик лекарственного средства (если он не совпадает с производителем);
– товарный знак организации-производителя (при наличии);
– номер серии и дата изготовления, состоящие из цифр, где четыре последних означают месяц и год выпуска данной продукции, а предшествующие – производственный номер;
– срок годности, в сведения о сроках годности римскими цифрами обозначается месяц, арабскими – год;
– номер регистрационного удостоверения – цифры указывающие год утверждения лекарственного средства приказом Министерства здравоохранения страны и номер этого приказа или пункта, к которому относится данное лекарственное средство, и другая информация о подтверждении соответствия;
– штрих-код;
– способ применения, назначение препарата (для инъекций, наружное и т.д.);
– количество лекарственного средства в единице упаковки (в весовых, объёмных или количественных единицах), доза и количество доз в упаковке, активность, [(для биопрепаратов, антибиотиков (в единицах действия)];
– условия отпуска, цена;
– условия хранения;
– меры предосторожности при применении ЛС, предохраняющие надписи («Стерильно», «Применять по назначению врача» и т.д.).
Если ЛС контролируется ежегодно, должна быть соответствующая надпись.
Оформление всех элементов упаковки одного ЛС должно иметь единое шрифтовое, композиционное и цветовое решение. Все тексты, помещаемые на этикетке должны быть чёткими, контрастными, легкочитаемыми. При наличии свободного места на потребительской упаковке возможно нанесение краткого содержания способа применения.
Для инъекционных лекарственных средств, где нельзя всю информацию разместить на ампулах, на них должна быть минимальная информация о названии препарата на латинском и русском или национальном языке о составе препарата, активности, количестве лекарственного препарата, номер серии данной продукции. Допускается на ампулах, а также тюбиках-капельницах, флаконах вместимостью не более 5 мл указывать только:
– наименование организации-производителя;
– торговое название лекарственного средства, его концентрацию или активность;
– объём или массу лекарственного средства;
– срок годности;
– номер серии.
Для стерильных ЛС указывается слово «Стерильно». Для инъекционных ЛС должен быть указан способ введения на русском языке: 1) внутривенно; 2) внутримышечно; 3) подкожно. Если инъекционное ЛС вводится всеми способами, то указывается «Для инъекций».
В маркировке комплекта антибиотика с растворителем на пачке, коробке следует указывать номер серии антибиотика и номер серии растворителя, а также срок годности лекарственного средства, входящего в комплект с наименьшим сроком годности.
В маркировке многодозовых стерильных лекарственных средств дополнительно указывают срок годности лекарственного средства после первого вскрытия упаковки. Если это оговорено в документе на лекарственное средство конкретного вида, в маркировке лекарственного средства необходимо указывать предупредительные надписи («Капельно», «Перед употреблением взбалтывать» и т.д.).
Для ядовитых и сильнодействующих ЛС (список А и Б) должно быть указано «Применять по назначению врача».
При изготовлении лекарственных средств на заказ дополнительно указывают наименование, адрес и товарный знак организации, по заказу которой произведено лекарственное средство.
Если организация-производитель изготовляет лекарственное средство предназначенное для последующего фасования или изготовления лекарственных форм, в маркировке потребительской тары дополнительно указывают:
– наименование, адрес и товарный знак (при наличии) организации-производителя лекарственного средства;
– надпись «Упаковано»;
– номер серии упакованного в потребительскую тару лекарственного средства присваивает организация-производитель, осуществившая фасование в потребительскую тару;
– если организация-производитель осуществляет только упаковку лекарственных средств, на упаковке дополнительно указывают наименование и адрес организации-производителя, осуществившей упаковку.
Лекарственные средства, предназначенные для клинических исследований, имеют надпись: «Для клинических исследований». Маркировка ЛС для клинических исследований, как правило, является более сложной операцией в связи с большей опасностью возникновения ошибок (которые труднее выявить), чем маркировка зарегистрированных ЛС, так как при этом используются слепые этикетки. Этикетки ЛС для клинических исследований должны содержать следующую информацию:
– наименование спонсора;
– дозированную лекарственную форму, способ введения, количество доз, а также название / шифр ЛС и активность / дозировку в случае открытого исследования;
– номер серии и / или код, позволяющий идентифицировать содержимое и операцию по упаковке;
– идентификационный (рандомизационный) номер испытуемого лица;
– указания по применению;
– надпись «Только для клинических исследований»;
– фамилию и инициалы исследователя (если они не включены в код исследований);
– код клинического исследования, позволяющий идентифицировать исследовательский центр и исследователя;
– условия хранения;
– срок использования в месяцах / годах (дата истечения срока годности, срок годности или дата повторного контроля при необходимости);
– надпись «Хранить в недоступном для детей месте», за исключением тех случаев, когда продукт предназначен только для использования в условиях стационара.
Внешняя упаковка может содержать символы или пиктограммы с требованием «Возвратить пустую упаковку и неиспользованное лекарственное средство». Копии каждого типа этикеток должны храниться в протоколе серии. При продлении срока годности ЛС для клинических исследований к нему должна быть прикреплена дополнительная этикетка, на которой должен быть указан новый срок годности и повторён номер серии.
Для маркировки лекарственного растительного сырья применяют следующие правила. Транспортную тару для растительного сырья маркируют в соответствии с ГОСТ 14192–96 [1] с указанием:
– наименования министерства здравоохранения;
– наименования предприятия-изготовителя;
– наименования сырья;
– массы нетто, брутто;
– года и месяца заготовки;
– номера партии;
– обозначения НТД на конкретное сырьё.
В каждую упаковку должен быть вложен упаковочный лист. На упаковочном листе должны быть указаны:
– наименование предприятия-отправителя;
– наименование сырья;
– номер партии;
– фамилия или номер упаковщика [7].
ЛС поступают в обращение только с инструкцией по применению ЛС, содержащей следующие данные на русском или другом национальном языке:
1) название и юридический адрес предприятия-производителя;
2) название ЛС и МНН;
3) сведения о компонентах, входящих в состав ЛС;
4) область применения;
5) противопоказания к применению;
6) побочные действия;
7) взаимодействие с другими ЛС;
8) дозировки и способ применения;
9) срок годности;
10) указание, что ЛС по истечении срока годности не должно применяться;
11) указание, что ЛС следует хранить в местах, не доступных для детей;
12) условия отпуска.
Инструкции по применению ЛС подразделяются на следующие категории:
– инструкция по применению ЛС для специалистов;
– инструкция по применению ЛС для потребителей (листок-владыш).
Инструкция по применению ЛС для специалистов – это официальный документ, содержащий информацию о ЛП, необходимую для его эффективного и безопасного медицинского применения. Инструкция по применению ЛС для потребителей (листок-вкладыш) – это официальный документ, предназначенный для пациента и содержащий информацию, необходимую для правильного самостоятельного применения ЛП.
Содержание маркировки и оформление надписей потребительской и групповой тары должно быть указано в НТД на конкретные виды лекарственных средств, или соответствовать образцам, утверждённым в установленном порядке. Каждая единица потребительской тары (банка, флакон, туба, пачка, коробка, пачка с ампулами и т.д.) должна быть снабжена этикеткой, листком-вкладышем или инструкцией по применению, содержание которых должно быть указано в НТД. Если размеры пачки допускают, то содержание листка-вкладыша или инструкции по применению наносится на пачку. Для лекарственных средств, поставляемых на экспорт, подписи на этикетке должны быть выполнены на языке, указанном в договоре поставщика с внешнеторговой организацией или в НТД на лекарственные средства. Этикетки изготовляют из этикеточной бумаги марки А или Б по ГОСТ 7625–86 [8] или мелованной бумаги марки О по ГОСТ 21444–75 [8], или офсетной бумаги №1 и №2 марки А, Б, В по ГОСТ 9094–89 [8], или другой бумаги по качеству не ниже указанной. Маркировка и оформление упаковки должны быть едиными для каждой серии упакованных лекарственных средств [9].
Все лекарственные средства, имеющие внешнюю (вторичную) упаковку, должны быть маркированы шрифтом Брайля – надписи рельефно-точечным шрифтом. На внешней упаковке лекарственных средств также шрифтом Брайля обозначаются название лекарственного средства, дозировка действующего вещества и лекарственная форма. Министерство Здравоохранения конкретной страны определяет лекарственные средства, упаковка которых не маркируется шрифтом Брайля, либо шрифтом Брайля обозначается только название лекарственного средства. Обязательство по маркировке шрифтом Брайля в ЕС было утверждено 30.04.2004, а конец подготовительного периода определен как 30 Октября 2005 года. Длительность переходного периода составляет 5 лет, и абсолютно все лекарственные средства в ЕС должны соответствовать требованиям к маркировке шрифтом Брайля до 30.10.2010 года. При этом логично предположить, что инъекционные и инфузионные формы не имеет смысла маркировать шрифтом Брайля, т.к. человек с ограниченным зрением не сможет сделать себе инъекцию без посторонней помощи. Хотя инсулины и ряд других средств, которые применяются пациентом самостоятельно, являются объектом маркировки Брайлем. Данная логика распространяется и на все госпитальные лекарственные средства (включая клинические испытания), которые применяются только под наблюдением врача. Комментарии к обязательству исключают лекарства, которые применяются только врачами: инъекционные и инфузионные формы, вакцины, радиофармацевтические средства, средства для анестезии. Если упаковка представлена на нескольких языках, Законодательство Евросоюза решает данный вопрос следующим образом – шрифт Брайля должен повторять каждый из присутствующих на упаковке языков. Если же название продукта отображается одинаково для нескольких языков-то в этом случае нет необходимости повторять каждый язык. Указание Брайлем лекарственной формы, которая чаще всего занимает наибольший объём информации, в Евросоюзе не требуется.
Маркировка лекарств в ЕС, которые не имеют вторичной упаковки, часть лекарств «первой необходимости», таких как йод, перекись водорода, спирт осуществляется нанесением шрифта Брайля на клеящуюся лейбу, которая, например, крепится вокруг бутылочки.
Нанесенный шрифт Брайля не должен мешать восприятию другой информации на упаковке.
Руководство по маркировке шрифтом Брайля особо уделяет внимание вопросу нанесения информации на упаковки малого размера: для нанесения на такие упаковки разрешено использовать альтернативные методы представления информации шрифтом Брайля: использование «сокращенной» системы Брайля или определенных общепринятых сокращений, либо добавление специального ярлыка, на котором будет указана необходимая информация методом Брайля. Сокращенная система Брайля (contracted system, так же известная как Grade II system) означает, что вместо обычной системы интерпретации, в которой одна шеститочечная ячейка означает одну букву или символ, применяются утвержденные сокращения-то есть, одна ячейка может означать несколько символов, или слово, а две-четыре ячейки могут означать слово или даже словесный оборот.
В практике зарубежных стран, для информации потребителя о качестве товара используют знаки соответствия стандарту. Например, изделия из каучука и резины реализуются в странах Евросоюза и в России маркированными знаками соответствия Системы сертификации ГОСТ. Контроль за реализацией товаров, подлежащих обязательному маркированию знаками соответствия, в России осуществляют МВД РФ, Министерство торговли РФ, Министерство РФ по налогам и сборам. Знак соответствия – зарегистрированный в установленном порядке знак, которым подтверждается соответствие маркированной им продукции установленным требованиям. Продажа товаров из каучука и резины без наличия знаков соответствия, защищённых от подделок, запрещена. Эти же требования распространяются на медицинские изделия и инструменты из полимерных материалов и на электрические медицинские инструменты. На поверхность резиновых изделий маркировку наносят водостойкой краской или давлением, на изделие наносят маркировку со следующими данными:
– товарный знак и наименование предприятия-изготовителя;
– обозначение изделия;
– номер партии;
– штамп технического контроля;
– год выпуска;
– шифр композиции (при необходимости);
– букву «Т» для изделий экспортируемых в страны с тропическим климатом.
При попадании на отверстие под заклёпки допускается пропуск букв или цифр, кроме номера партии и даты изготовления. По согласованию изготовителя с потребителем допускается изделия шириной не более 40 мм не маркировать или наносить на них маркировку неполного содержания. На каждую упаковочную единицу резиновых медицинских изделий (пакет, пачку более 20 изделий) прикрепляют или вкладывают ярлык или ставят штамп с указанием:
– товарного знака и наименования предприятия-изготовителя или товарного знака;
– наименования и обозначения изделия;
– номера партии;
– штампа технического контроля;
– номера или подписи упаковщика (комплектовщика);
– даты выпуска (месяц, год);
– обозначения НТД, по которому изготовляется изделие [10].
Основные, дополнительные, информационные надписи и знак «Боится сырости» наносят на бумажные, картонные, фанерные и другие ярлыки или тару. Дополнительные требования к маркировке изделий устанавливают в НТД на изделия конкретных видов. Маркировка медицинских инструментов, изделий медицинских из резины и запасных частей к ним, предназначенных для профилактики, диагностики и лечения заболеваний, реабилитации и ухода за больными должна содержать:
– наименование товара;
– фирменное наименование и место нахождения (юридический адрес) изготовителя товара, место нахождения организации, уполномоченной изготовителем (продавцом) на принятие претензий от покупателя и производящей ремонт и техническое обслуживание товара;
– обозначение стандартов, требованиям которых должен соответствовать товар;
– сведения об основных потребительских свойствах товара;
– гарантийный срок, если он установлен для конкретного товара;
– срок службы или срок годности, если они установлены для конкретного товара;
– цену и условия приобретения товара.
Также должны быть предоставлены сведения о номере и дате регистрационного удостоверения на применение таких изделий в медицинских целях, выданных Министерством здравоохранения в установленном порядке, а также, с учётом особенностей конкретного товара, сведения о его назначении, способе и условиях применения, действии и оказываемом эффекте, ограничениях (противопоказаниях) для применения. Медицинские инструменты должны иметь чёткую маркировку, содержащую следующие сведения:
– номер инструмента или его обозначение;
– товарный знак предприятия-изготовителя;
– год выпуска;
– условное обозначение «Н» для инструментов из корррозионно-стойкой стали или «Тi» (для инструментов из титановых сплавов).
Маркировка металлических инструментов должна содержать условный знак «Н» (нержавеющая сталь) для инструментов, предназначенных для экспорта, должно быть указано обозначение экспортёра, надпись: «Сделано в… стране изготовителе», например, «Made in Russia», товарный знак экспортёра, наименование инструмента, дополнительно должны быть нанесены следующие надписи: «Stainless Steel» или «Stainless» (на инструментах, изготовленных из нержавеющей стали), на инструментах, изготовленных из титановых сплавов, допускается нанесение надписи «Titanium».
Сталь, применяемая для производства медицинских металлических инструментов маркируется следующим образом. Для изготовления хирургических пинцетов, ретракторов, зондов применяется сталь марки А, это указывается на инструменте. Для изготовления костных кусачек, костных кюреток, долот, ножниц, зажимов, стоматологических щипцов для удаления зубов применяется сталь марки В, это указывается на инструменте. Для изготовления инструментов для снятия зубного камня, стоматологических кюреток, лабораторных щипцов. стоматологических пинцетов применяется сталь марки С, R, это указывается на инструменте. Для изготовления конхотомов. скальпелей, ножей, корневых элеваторов, каналонапонителей, инструментов для снятия зубного камня применяется сталь марки D, это указывается на инструменте. Из сталей марок E, F, G изготовляют скальпели, большие ножницы, инструменты соответственно маркируются. Стали марок H, I используют для изготовления ножниц, костных кюреток, кусачек для проволоки – инструменты соответственно маркируются. Для изготовления долот и костных кюреток, зондов используется сталь марок K, N – инструменты соответственно маркируются. Для изготовления ручек, штифтов используют стали марок L, M – инструменты соответственно маркируются. Для изготовления долот, зондов, гаек, заклёпок используют стали марок N, O, P – инструменты соответственно маркируются. Маркировка металлических инструментов должна содержать ссылку на международный стандарт ИСО 7153/1 – 88.
Маркировку наносят на нерабочую часть инструмента механическим, электрокоррозионным способом, маркировкой термопечатью, вычерчиванием, лазерным, ударно-точечным или другим способом, обеспечивающим чёткость изображения. Маркировка должна сохраняться (и быть разборчивой) при эксплуатации, стерилизации и транспортировании инструментов. Допускается нанесение маркировки не на каждый инструмент, а на потребительскую тару или ярлык или на групповую тару при отсутствии индивидуальной тары [11].
Стоматологические наконечики маркируют с обозначением знака, указывающего на возможность автоклавирования (если необходимо).
Для деталей наконечников одноразового использования, если они продаются в качестве стерильного продукта, на упаковку наносят надпись «Использовать до…» с указанием конкретной даты [12].
На медицинские металлические инструменты наносят несмываемую маркировку с обозначением стандарта, определяющего типовые требования к конкретному виду медицинского изделия [13].
В обязанность продавца, поставляющего оборудование, включается условие представить при отгрузке товара комплект технической документации. В этот комплект входит этикетка. На такие товары длительного пользования, как инструменты, приборы и аппараты медицинские изготовитель обязан устанавливать срок службы. За качество этих товаров изготовитель отвечает в течение всего срока службы или годности.
С 01.02.2008 года на территории Украины вводится обязательная маркировка изделий медицинского назначения при помощи графических символов. Обязательное нанесение маркировки регламентируется приказом Государственного комитета Украины по вопросам технического регулирования и потребительской политики №294 от 01.11.2007. Маркировка изделий медицинского назначения должна осуществляться в соответствии с национальным стандартом ДСТУ EN 980:2007 «Символы графические для маркировки медицинских изделий (EN 980:2003, IDT)» («Символи графічні для маркування медичних виробів (EN 980:2003, IDT)»). Данный стандарт разработан с целью гармонизации регуляторных требований и в соответствии со стандартом ЕС EN 980:2003. Обязательное нанесение маркировки распространяется как на отечественные, так и на импортируемые изделия медицинского назначения.
Потребительская и внешняя упаковка стерильных медицинских изделий должна содержать надпись «Стерильно», слова «Для однократного применения» или их заменяющие. Кроме того на внешней упаковке должно быть указание о проверке целостности каждой упаковки, должна быть нанесена маркировка партии и дата (месяц, год) стерилизации [9].
Литература
1. ГОСТ 19433–88. Грузы опасные. Классификация и маркировка. Межгосударственный стандарт ГОСТ 14192–96 Маркировка грузов.
2. Товароведение. Жиряева Е.В. – СПб: Питер, 2002. – 416 с.: ил. – (Серия «Маркетинг для профессионалов»).
3. Маркировка фармацевтических товаров: учебно-методическое пособие по специальности – Фармация / сост. к.ф.н. Афанасьева Т.Г., Акиньшина Н.И., Махинова Е.Н. – Воронеж, Воронежский государственный университет, 2006. – 72 с. с. 15.
4. ГОСТ 24861–91 «Шприцы инъекционные однократного применения».
5. Национальный стандарт РФ ГОСТ Р 52938–2008 «Кровь донорская и её компоненты. Контейнеры с консервированной кровью или её компонентами. Маркировка». ГОСТ 30743–2001 Автоматическая идентификация. Кодирование штриховое. Спецификация символики Code 128 (Код 128).
6. Федеральный закон РФ №86-ФЗ от 22.06.98 «О лекарственных средствах» (в ред. ФЗ №5 – ФЗ от 2.01.2000).
7. Межгосударственный стандарт ГОСТ 17768–90 «Средства лекарственные. Упаковка, маркировка, транспортирование и хранение».
8. ГОСТ 7625–86 Бумага этикеточная. Технические условия. ГОСТ 21444–75 Бумага мелованная. Технические условия. ГОСТ 9094–89 Бумага для печати офсетная. Технические условия.
9. Международный стандарт ИСО 15233:2000 «Медицинские изделия. Символы, применяемые при маркировании на медицинских изделиях, этикетках и в сопроводительной документации».
10. ГОСТ 3399–76 «Трубки медицинские резиновые. Технические условия».
11. Международный стандарт ИСО 7153/1–88 «Инструменты хирургические. Металлические материалы».
Похожие работы
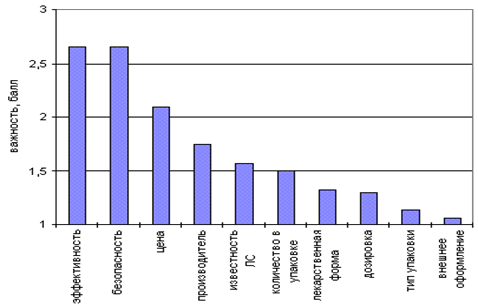
... . Товароведческим анализом приходится заниматься фармацевту при выборе оптимального ассортимента товара для аптечных учреждений, ЛПУ, а также при приёмке товара по количеству и качеству. Стандартизация играет большую роль в товароведческом анализе. Так как стандарты устанавливают характеристики продукции, правила осуществления и характеристики эксплуатации, хранения, перевозки, реализации и ...
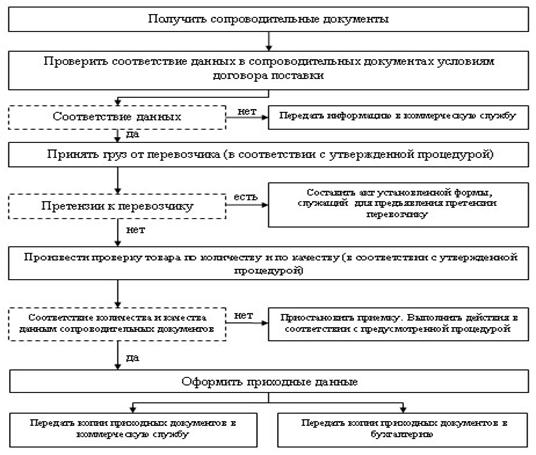
... средства проходят приемочный контроль, который заключается в проверке поступающих лекарственных средств на соответствие требованиям по показателям: «Описание»; «Упаковка»; «Маркировка». В случае необходимости проводится полный физико-химический анализ лекарственных форм в лаборатории. Сопроводительные документы на лекарственные препараты группы НПВС должны содержать информацию: - о поставщике; ...
... являются: - минеральные соединения; - ткани и органы животных; - растения; - микроорганизмы; - продукты химического синтеза.[6] С точки зрения потребительных свойств лекарственных препаратов представляет интерес влияние факторов внешней среды, воздействующих на них в процессе производства, транспортирования и хранения. Существуют основные три группы факторов внешней среды, которые влияют ...
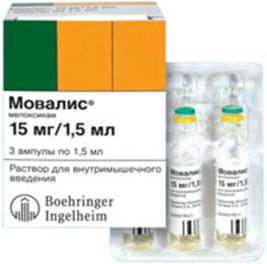
... сконто, дилерские. Заключение В ходе написания курсовой работы было проведено маркетинговое исследование группы нестероидных противовоспалительных средств с углублённым товароведческим анализом лекарственного препарата Мовалис, Определение положения препарата и фирмы-производителя на отечественном рынке. Данный препарат является высокоэффективным оригинальным продуктом немецкой фирмы Берингер ...



0 комментариев