Навигация
CD1d и NКТ-клетки при инфекциях
4.5 CD1d и NКТ-клетки при инфекциях
Знания о роли второй группы CD1 молекул и NКТ-клеток в антибактериальном ответе хозяина ещё ограничены. NКТ-клетки находятся первоначально в печени, где они продуцируют IL4 в ответ на лиганд ТКR. Стимуляция NКТ-клеток αGalCer индуцирует синтез ИЛ4 и ИФНγ, в результате иммунный ответ склоняется в сторону Тх2-типа. При инфекции, вызванной Mycobacteriym bovis, Bacille-Calmette Guerrin начальный интерлейкиновый взрыв NКТ-клеток модулирует продукцию ИФНγ. Это, возможно, достигается за счет индуцированного ВСG выделения ИЛ12. В самом деле, при выделении обоих цитокинов происходит сдвиг в сторону продукции ИФНγ. Введение анти-CD1 моноклональных антител приводит к незначительному улучшению течения листериоза. Параллельно увеличивается секреция ИФНγ, ИЛ17 и ТНФ, а секреция ТНФβ сильно снижается. Позже показана практическая роль ТНФβ в иммунной регуляции NКТ-клетками. Такое же анти-CD1 введение слегка усиливает туберкулез у мышей и снижает продукцию ИФНγ, ИЛ12 и ТНФ. Согласуется с этим то, что NКТ-клетки, контролируемые CD1, принимают участие в формировании гранулемы, индуцируемой микобактериальными гликолипидами, в частности РIМ. CD1 Knock out мыши, зараженные M. tuberculosis, не страдают от развивающегося туберкулеза по сравнению с диким типом мышей. Это различие может быть объяснено чрезмерностью иммунной системы, что способствует компенсации функций NKТ-клеток другими клетками у CD1 КО мышей. Или, возможно, что введение анти-СD1d АТ не только блокирует узнавание СD1 клетками NK, но также и заражение АПК. Интересен тот факт, что реагирующие клетки через CD1d и CD1c могут влиять на кальциевый наплыв в Т-клеточную линию, экспрессирующую СD1.
Регуляторную роль NКТ-клеток лучше всего демонстрируется на их роли в ЛПС-индуцированной реакции. Считается, что данная продукция ИФНγ является движущей силой ЛПС-индуцированного летального шока.
Хотя считалось, что быстрая продукция ИФНγ происходит NКT-клетками, но, возможно, что резидентные печеночные NКТ-клетки являются источником ИФНγ при ЛПС-индуцированной печеночной патологии. Было показано, что резидентные печеночные NКТ-клетки, ответственные за гепатотоксичность, активируются ИЛ-12, которая выделяется ЛПС-стимулированными Купферовскими клетками. Истощение NКТ-клеток возрастает при сопротивлении накоплению ИЛ-12 (ЛПС-индуцированная генерализованная реакция Шварумана). CD7 КО мыши с дефектом в продукции ИФНγ и сокращением числа резидентных печеночных NКТ-клеток устойчивы к ЛПС-индуцированному шоку. Порог активации NКТ-клеток бактериальными продуктами низок, поэтому возникает риск острой и тяжелой патологии, которая требует контррегуляции игибиторными цитокинами, такими как ИЛ-10 или ТФРβ. Такая чувствительность позволяет NКТ-клеткам быстро отвечать на проникновение микроорганизма, но несет риск возникновения чрезмерной реакции, приносящей вред хозяину. Интересно, что активация и экспансия NКТ-клеток не вызвана легким попаданием бактериальной флоры. Незараженные мыши содержат то же число NКТ-клеток, что их обычно выведенные сородичи.CD1а-, CD1b- и CD1с-зависимые Т-клетки убивают зараженные клетки – мишени перфорин-зависимым способом.
Они выделяют микробицидную молекулу, вместе с NKT-клетками гранулизин, которая способна убивать микобактерии также хорошо, как и другие патогенные бактерии, грибы и паразиты. Гранулизин не может добраться до патогенна, расположенного в фагосомах, поэтому зависит от кооперации с перфорином.
Открытие, что Т-клетки распознают липиды и гликолипиды, презентуемые CD1 белками, сильно расширило число потенциальных микробных антигенов, преследуемых иммунной системой во время инфекции. Способность CD1d и NКТ-клеток активировать врожденный и адаптированный иммунные ответы привела к идее, что эти клетки могут модулировать устойчивость к инфекционным агентам. В добавок, CD1d NКТ-клетки могут непосредственно внести вклад в резистентность хозяина, так как они выделяют множество эффекторных молекул, которые могут воздействовать на антимикробный эффект. Хотя многое было изучено о CD1d NКТ-клетках при использовании синтетического АГ α-галактозинцерамида (αGalCer), остается область, недостаточно изученная, о физиологии собственных и микробных антигенов, которые могут быть презентованы с помощью CD1d [24].
4.6 αGalCer специфически активирует CD1d iNКТ-клетками
Сложный αGalCer – синтетический гликолипид, основанный на связанных липидах, очищенных из морской губки, которой индуцировали регрессию опухоли. Танигичи и др. показали, что антиопухолевый эффект αGalCer зависит от iNКТ-клеток, что α-гликозилцерамид презентуется CD1d. Узнавание αGalCer - общая черта для мышиных и человеческих iNКТ-клеток. αGalCer связывается с очищенным CD1d белком в бесклеточных системах, в результате αGalCer/CD1d комплекс может активировать iNКТ клеточные гибридомы. Хотя их структура напоминает таковую из других CD1-презентуемых антигенов, α-гликозилцерамид не продуцируется клетками млекопитающих или патогенных микробов. Несмотря на это возможность активировать iNКТ-клетки сделала αGalCer необходимым реагентом для изучения iNКТ.
In vivo прием αGalCer имеет глубокие иммунологические последствия, которые опосредованы CD1d iNКТ-клетками; αGalCer-зависимая модуляция иммунного ответа не происходит у мышей, которые испытывают недостаток CD1d или iNКТ-клеток. Этот эффект включает активацию NК, В-клеток и Т-клеток в пределах 3-24 часов, которые детерминируются индукцией ранних маркерных клеток активации, таких как CD69 (В, Т и NК), CD80 и CD86 (В-клеток). Например, после введения αGalCer iNКТ-клетки активируют NК к продукции ИФНγ. αGalCer активированные iNКТ-клетки ингибируют дифференцировку Тх2. Распознавание iNКТ-клетками αGalCer, презентуемого ДК, ведет к CD40/CD40L-зависимой продукции ИЛ12 дендритными клетками. Таким образом, под влиянием iNКТ-клеток ДК созревают. Напротив, продукция ИЛ4 iNКТ-клетками зависит от ИЛ12. Таким образом, сложные взаимодействия и регулирующие сети обратной связи между АПК и iNКТ-клетками могут определять развитие иммунного ответа по Тх1 или Тх2-типу.
Вдобавок к этому эффекту на иммунный ответ, αGalCer оказывает влияние iNКТ-клетки непосредственно. В противоположность обычным Т-клеткам, распространения iNКТ-клеток были обнаружены после активации. Фактически после стимуляции анти-CD3 моноклональными антителами или αGalCer тяжело обнаружить iNКТ-клетки, потому что они подвергаются апоптозу [25].
Глава 5. Отличительные частоты генотипа цитокинов среди канадских аборигенов и кавказских популяций
Генетическое разнообразие, связанное с человеческим иммунным ответом, - ключевой фактор выживания индивидуумов и популяций в истории человечества. Разнообразие популяций в восприимчивости к болезням и сопротивлении было идентифицировано и связано с различиями в цитокине mRNA и уровнях экспрессии белков. Полиморфизмы в регуляторных областях генов цитокинов могут влиять на уровни транскрипции генов. Они были ассоциированы с восприимчивостью к аутоиммунным заболеваниям, таким как ревматоидный артрит, менингит и сепсис. Канадские аборигены имеют более высокую частоту полиморфизма цитокинов, что благоприятствуют низкой продукции TNFα, ИФНγ и ИЛ10 и высокой продукции ИЛ6 по сравнению с кавказским населением. Эволюция этого уникального генотипа цитокинового профиля может быть связана с адаптацией аборигенов к давлению отбора окружающей среды, в которой преобладают гельминты, паразиты и грибковые инфекции [22].
Инфекционные патогенны, такие как M. tuberculosis и RSV продолжают иметь разрушительный эффект в некоторых североамериканских популяциях. Например, в Канаде 43% из всех новых активных и рецидивных случаев туберкулеза происходят среди аборигенов, 37% случаев – среди индивидуумов иностранного происхождения и 20% - среди рожденных в Канаде, но не аборигенов. В то время как большинство изучений сфокусировано на социоэкономических различиях, небольшое внимание тратится на генетические различия, которые могут существовать среди человеческих популяций и регулировать качество иммунного ответа на данный патоген. Изучения инбредных мышей ясно демонстрируют, что генетический фон играет ключевую роль в определении качества цитокинового ответа (Тх1 против Тх2), который в свою очередь затрагивает способность хозяина уничтожать инфекционного агента.
С завершением проекта расшифровки генома человека стало очевидно, что полиморфизмы одного нуклеотида (SNPs) являются обычными и в зависимости от локализации могут затрагивать уровни транскрипции генов. В контексте иммунного ответа хозяина на инфекционного агента идентификация различий в цитокиновых SNPs профилях может иметь важные значения для сопротивления организма хозяина или восприимчивости к данному специфическому агенту. Текущее изучение описывает частоту SNPs, которая, как известно, коррелирует с дифференциальной экспрессией генов ИЛ6, ИЛ10, ТНФα, ИФНγ и ТФРβ в кавказской, канадских аборигенов и филиппинской когортах и постулирует, почему определенные цитокиновые SNPs профили могут развиваться на популяционном уровне.
В двух независимых опытах было найдено, что этнические популяции имеют статистическое различие в цитокиновых SNPs профилях. Вначале было замечено, что цитокиновые генотипы у североамериканских аборигенов и филиппинцев с ESRD имеют значительные различия по сравнению с кавказцами с конечной стадией данной почечной болезни. Во втором опыте, в который были вовлечены нормальные контрольные популяции кавказских индивидуумов и аборигенов, были подтверждены первоначальные наблюдения.
По сравнению с когортами аборигенов и филиппинцев, кавказцы поддерживают высокую частоту ТНФα и ИФНγ аллелей SNPs, чья фенотипическая экспрессия ассоциирована с увеличением продукции этих цитокинов. Противоположность кавказской когорте индивидуумы филиппинского происхождения имеют высокую частоту ИЛ6 аллели, ассоциированную с высокой продукцией данного цитокина. Аборигены поддерживают статистически высокую частоту аллеля "G" в ТНФα и поэтому имеют низкую продукцию этого цитокина по сравнению с кавказской когортой. Точно также аборигены поддерживают статистически высокую частоту аллеля "А" в ИФНγ, которая ассоциирована с низкой продукцией этого цитокина.
Кавказцы могут поддерживать Тх1 иммунный ответ, в то время как SNPs частоты в регионах промотеров цитокинов аборигенов и филиппинцев имеют тенденцию к поддержанию Тх2 иммунного ответа. Для объяснения данных генетических различий нужно учесть исторический контекст, в котором развивались популяции с их микробной средой [22].
Старая мировая кавказская популяция в течение последних 11 тысяч лет занималась охотой и собирательством. Для одних это включало одомашнивание растений и животных, оседание и последующая урбанизация. Эти изменения в пропитании и образцах поселения закончились глубокими изменениями в микробной среде Старого Света. С появлением сельского хозяйства и урбанизации так называемые "инфекции толпы" стали превалирующими, и эпидемии оспы, кори, чумы и туберкулеза распространялись по Европе [21]. С данными патогенами был связан высокий уровень смертности, что оказывало интенсивное селективное давление на популяцию. Например, учитывая высокую распространенность туберкулезной инфекции, ведущей к преждевременной смерти в Европе (примерно 18 столетие), выживали те индивидуумы, которые могли эффективно воздействовать на патоген с помощью гиперчувствительности замедленного типа. Этот тип ответа характеризовался высоким уровнем экспрессии цитокинов ТНФα и ИФНγ. Действительно, когда анти-ТНФα вводился пациентам с воспалением кишечника, то это ассоциировалось с возникновением или реактивацией туберкулеза, что подтверждает важную роль ТНФα как иммунного модулятора или нейтрализатора туберкулеза. Определенные SNPs в регионе промотера ТНФα были вовлечены в инфекционные болезни, такие как малярия.
Схожим образом ИФНγ имеет важную роль в защите организма хозяина от микобактерий, хотя продукция ИФНγ не может адекватно контролировать инфекцию без присутствия других цитокинов. До настоящего времени нет свидетельства от изучения популяций, что общие варианты в генах рецепторов к ИФНγ влияют на восприимчивость к туберкулезу. Были случаи инактивации мутаций в рецепторе к ИФНγ, которые были ассоциированы с чувствительностью к обычным непатогенным микобактериям. В пределах других цитокинов у животных моделей недавно было найдено, что экспрессия ИЛ6 макрофагами может препятствовать эффективному сдерживанию туберкулезной инфекции. При изучении кавказской популяции было замечено, что она поддерживает относительно высокую частоту SNPs цитокинов, что приводит к гиперчувствительности замедленного типа и низкому уровню экспрессии ИЛ6 по сравнению с другими когортами. Учитывая вышеупомянутую высокую распространенность туберкулеза в Европе с 1700 года до ранних 1900-х, когда была развита эффективная антимикробная терапия, можно объяснить цитокиновый SNPs профиль, наблюдаемый сегодня в кавказской популяции.
Популяции аборигенов Северной Америки испытали уникальный набор эволюционных давлений из-за их миграции через Берингов "Земной мост" (приблизительно 15-20 тысяч лет назад) и их изоляции от популяций Старого Света приблизительно с 1400 года нашей эры. Аборигены вели охотничий и собирательский образ жизни (это существовало и в Старом Свете), это способствовало диффузному расселению с низкой плотностью населения. Анализ патологий в человеческих скелетных останках древних аборигенов указывает, что паразитические грибковые инфекции и недоедания присутствовали у древних людей. Употребление сырого или недостаточно приготовленного мяса, условия жизни в зимнее время и определенные образцы поедаемых диких растений привели к тесному контакту этих людей с грибковыми инфекциями и паразитами и сделали их уязвимыми к сезонным авитаминозам. Микробная среда способствовала позитивной селекции Тх2 типа адаптивного иммунного ответа для выживания. Действительно, изучение семейств аборигенов Южной Америки во время инфекции Shistosoma mansoni подтвердили защитную роль Тх2 типа цитокинов: ИЛ4, ИЛ6, ИЛ13, - в защите против паразитической инфекции. Чрезмерная экспрессия Тх2 типа цитокинов (ИЛ6, ИЛ10) индуцирует гиперактивность В-клеток, которая характерна для системной красной волчанки. Полиморфизмы в промотерах регионов ТНФα, ИФНγ, ИЛ10 и ИЛ6 ассоциированы с дифференциальными уровнями экспрессии данных цитокинов. Сохранение данных полиморфизов популяции может привести к селективному преимуществу. В контексте существующих исследовании факт, что цитокиновый SNPs профиль у канадских аборигенов искажен в сторону высокой продукции ИЛ6 и относительно низкой ТНФα, ИФНγ, поддерживая концепцию низкой распространенности M. tuberculosis в данных популяциях до контакта с европейцами.
SNP частоты цитокинов филиппинцев похожи с аборигенами Северной Америки. Общее азиатское наследие популяции аборигенов и филиппинцев и их параллельные миграции из европейского континента более 12 тысяч лет назад могли привести к данному сходству.
Изучения инфекционных болезней среди популяции аборигенов сосредотачивались на социоэкономических факторах, способствующих устойчивости к заболеваниям или восприимчивости. В большинстве данных исследований генетические различия между популяциями признаны способствующими факторами в восприимчивости к болезням или в устойчивости. Хотя основания для данного генетического неравенства остаются в значительной степени неизведанными. Чувствительность к туберкулезу, например, в относительно изолированной Южной Америке высока. Хотя индивиды с высоким уровнем питания и социоэкономическим статусом одинаково подвержены опасностям заболевания, как индивиды с низким уровнем питания и социоэкономическим статусом. Предполагается, что высокий уровень продукции антител и Тх2-опосредованной активации у южноамериканцев конкурирует с Тх1-опосредованной защиты, необходимой для эффективной борьбы против инфекционных болезней, таких как туберкулез. Популяции североамериканских аборигенов в Манитобе имеют самую высокую сферу действия туберкулеза относительно других местных популяций. Неравный риск заболевания между этническими популяциями может быть частично объяснен окружающими условиями и социоэкономическими различиями. SNPs цитокинов могут также играть роль в данной изменчивости.
В итоговом этническом кладе вероятен фактор наблюдаемых различий частот SNPs цитокинов. Данные различия между кавказской, популяцией аборигенов и филиппинцев могут частично отразить тот факт, что данные популяции развивались в ответ на селективное давление их микробных сред [22].
Глава 6. Ассоциация туберкулёза со специфичностями гена HLA-DR-B1 в различных регионах Тувы
Генетические факторы в значительной мере определяют восприимчивость к различным заболеваниям, в том числе и инфекционной природы. Туберкулез в этом отношении не является исключением. Определенный вклад в восприимчивость к туберкулезу вносят гены системы HLA, которые детерминируют различные иммунологические феномены. Имеются многочисленные работы, в которых обнаружена положительная ассоциация антигенов HLA с заболеванием туберкулезом. Считается, что наиболее значимыми являются ассоциации туберкулеза с генетическими маркерами локуса HLA-DR, поскольку в этом локусе располагаются гены иммунного ответа. Этот факт можно использовать для формирования по генетическим маркерам системы HLA групп риска в отношении заболевания туберкулезом. В то же время показано, что в различных популяциях с заболеванием туберкулезом ассоциируются разные антигены HLA.
В ряде работ не было обнаружено значительных различий во встречаемости антигенов HLA у больных туберкулезом и здоровых лиц. Возможно, это связано или с малочисленностью материала, или с неправильно подобранными сравниваемыми группами, поскольку в подавляющем большинстве работ обнаружена положительная ассоциация антигенов HLA с туберкулезом. В то же время исследования в разных регионах Республики Тува выявили положительную ассоциацию туберкулеза со специфичностями HLA-DR-B1 13(6) и HLA-DR-B1 14(6). Возможно, высокая заболеваемость коренного населения Тувы ассоциирована с названными специфичностями гена HLA-DR-B1, что связано с национальными особенностями коренного населения Республики Тува [9].
Глава 7. Распределение антигенов комплекса HLA у больных туберкулёзом и здоровых лиц в татарской популяции
Результаты изучения распределения антигенов HLA у здорового населения обследованных популяций (русской, молдавской, узбекской, туркменской и тувинской) вошли в сборник исследований по генофонду населения России и сопредельных стран, проводимых Российской академией наук.
Первая работа в этом по распределению антигенов HLA населения республики Татарстан была выполнена в 2003 г. в 4 районах Северо-Западной и Прикамской частей Татарстана (Арский, Балтасинский, Высокогорский и Атнинский). Татарское население этих районов проживает в указанной местности на протяжении жизни не менее 4 поколений, что установлено методом опроса.
Иммуногенетическому исследованию предшествовало изучение эпидемиологической ситуации по туберкулезу - заболеваемости, болезненности, смертности.
Изучено распределение антигенов HLA первого класса у здоровых лиц и больных активным туберкулезом органов дыхания, выявленных в 2002 г.
Статистически достоверная разница между частотами встречаемости антигенов трех исследованных локусов системы HLA обнаружена только для антигена HLA-B22. Это указывает на то, что по крайней мере в этой части Татарстана у больных активным туберкулезом легких существует ассоциация с антигеном В22 [2].
Таким образом, в результате исследования распределения антигенов комплекса HLA первого класса в татарской этнической группе (4 района Татарстана) установлено, что у больных активным туберкулезом легких существует ассоциация с антигеном HLA-B22.
ЗАКЛЮЧЕНИЕ
![]() Открытие антигенов тканевой совместимости у человека HLA (Human Leucocyte Antigens) положило начало успешному развитию кооперативных интернациональных исследований, в которых участвуют все лаборатории мира, занимающиеся тканевой совместимостью. Проведено исследование распределения компонентов комплекса HLA в большинстве популяций мира.
Открытие антигенов тканевой совместимости у человека HLA (Human Leucocyte Antigens) положило начало успешному развитию кооперативных интернациональных исследований, в которых участвуют все лаборатории мира, занимающиеся тканевой совместимостью. Проведено исследование распределения компонентов комплекса HLA в большинстве популяций мира.
Успехи трансплантологии, с одной стороны, и достижения клинической генетики и иммуногенегики — с другой, диктуют необходимость продолжать исследования в нашей стране.
Подобные исследования были начаты в 80-е годы XX столетия в Центральном НИИ туберкулеза РАМН под руководством акад. РАМН А. Г. Хоменко и проф. В. И. Литвинова и получили развитие в последние годы [16].
В условиях экспедиций в ряде регионов России и стран СНГ проведены комплексные клинические, генетико-эпидемиологические и иммунологические исследования групп коренного населения с различной этнической принадлежностью и эпидемической ситуацией по туберкулезу. Изучение распределения компонентов комплекса HLA среди здорового населения и у больных туберкулезом легких проведено в русской, узбекской, туркменской, молдавской, тувинской популяциях. Для каждой популяции были обнаружены свои особенности в частотах встречаемости антигенов HLA и характерные для данной популяции ассоциации с восприимчивостью (или резистентностью) к туберкулезу легких.
В проведенных исследованиях в русской популяции Москвы и Московской области найдена ассоциация туберкулеза легких с антигенами В5 и В17, в молдавской — с антигенами В5 и В38, в узбекской — с антигеном В12, в армянской - с В12 и В35, в тувинской — с В15. Отличие в этом отношении татарской популяции от других (ассоциация с антигеном В22) может быть объяснено либо особенностями этногенеза всего татарского населения республики, либо генетическими особенностями татарского населения этих районов Татарстана, обособленного в генетическом плане в субизолят. Это может подтвердиться после иммуногенетического обследования большей части районов республики.
В ряде работ не было обнаружено значительных различий во встречаемости антигенов HLA у больных туберкулезом и здоровых лиц. В подавляющем большинстве работ обнаружена положительная ассоциация антигенов HLA с туберкулезом. В то же время исследования в разных регионах Республики Тыва выявили положительную ассоциацию туберкулеза со специфичностями HLA-DR-B1 13(6) и HLA-DR-B1 14(6). Возможно, высокая заболеваемость коренного населения Тувы ассоциирована с названными специфичностями гена HLA-DR-B1, что связано с национальными особенностями коренного населения Республики Тува.
СПИСОК ЛИТЕРАТУРЫ
1. Баранов В.С., Баранова Е.В., Иващенко Т.Э., Асеев М.В. Геном человека и гены "предрасположенности". Введение в предиктивную медицину. - 2000. - 271 с.
2. Гергерт В.Я., Валиев Р.Ш., Чуканова В.П. Распределение антигенов комплекса HLA у больных туберкулёзом и здоровых лиц в татарской популяции. // Проблемы туберкулёза и болезни лёгких. – 2004. - №2. – с. 45-46.
3. Гриппи М.А. Патофизиология легких. - 1997. - 344 с.
4. Иващенко Т.Э., Сиделева О.Г., Петрова М.А. и др. Генетические факторы предрасположенности к бронхиальной астме // Генетика. - 2001. - Т.37. - №1. - с.107-111.
5. Комогорова Е.Э., Костенко Е.В., Стаханов А.Н. Особенности иммунологических показателей у больных с различными формами туберкулёза лёгких. // Клиническая иммунология. – 2005. - №1 – с. 45-50.
6. Ляхович В.В., Вавилин В.А., Макарова С.И. и др. Роль ферментов биотрансформации ксенобиотиков в предрасположенности к бронхиальной астме и формировании особенностей её клинического фенотипа // Вестн. РАМН. - 2000. - №12. - С.36-41.
7. Макарова С.И., Вавилин В.А., Ляхович В.В., Гавалов С.М. Аллель NAT285 – фактор устойчивости к заболеванию бронхиальной астмой у детей // Бюллетень экспериментальной биологии и медицины. - 2000. - Т.129. - №6. - с.677-679.
8. Маянский А.Н. Туберкулёз (иммунологические и иммунопатогенетические аспекты). // Клиническая иммунология. – 2001. - №2. – с. 53-65.
9. Поспелов Л.Е., Матракшин А.Г., Ларионова Е.Е. Ассоциация туберкулёза со специфичностями гена HLA-DR-B1 в различных регионах Тувы. // Проблемы туберкулёза и болезни лёгких. – 2005. - №2. – с.23-24.
10. Поспелов Л.Е., Серова Л.Д., Калинина Н.М. HLA-DR-антигены у больных туберкулёзом и здоровых ревакцинированных БЦЖ лиц. // Проблемы туберкулёза и болезни лёгких. – 2003. - №2. – с.82-83.
11. Пузырев В.П. Медико-генетическое исследование населения приполярных регионов. - 1991. - 200 с.
12. Пузырев В.П. Состояние и перспективы геномных исследований генетической кардиологии // Вестн. РАМН. - 2000. - №7. - с.28-33.
13. Пузырев В.П. Генетика артериальной гипертензии (современные исследовательские парадигмы) // Клиническая медицина. - 2003. - №1. - с.12-18.
14. Пузырев В.П., Огородова Л.М. Геномная медицина в решении проблем пульмонологии // Вестн. РАМН. - 2000. - №12. - с.45-48.
15. Пузырев В.П., Огородова Л.М., Салюкова О.А. Генетические основы этиопатогенеза бронхиальной астмы // Сиб. мед. журнал. - 1998. - №3. - с.82-85.
16. Соафер В.Н. Международный проект "Геном человека" // Соросовск. образ. Журнал. - 1998. - №12. - С.4-11.
17. Степанов В.А., Пузырев К.В., Спиридонова М.Г. и др. Полиморфизм генов ангиотензин-превращающего фермента и эндотелиальной синтазы окиси азота у лиц с артериальной гипертензией, гипертрофией левого желудочка и гипертрофической кардиомиопатией // Генетика. - 1999. - Т.34. - №11. - с.1578-1581.
18. Суздальцева Т.В. Иммунопатологические аспекты аспирин-индуцированной бронхиальной астмы // Аллергология. - 1999. - №4. - с.16-18.
19. Хаитов Р.М., Алексеев Л.П. Физиологическая роль главного комплекса гистосовместимости. // Клиническая иммунология. – 2001. - №3. – с. 4-12.
20. Хаитов Р.М., Богова А.В., Ильина Н.И. Эпидемиология аллергических заболеваний в России // Иммунология. - 1998. - №3. - С.4-9.
21. Шевченко Ю.Л. Значение социальных факторов во взаимодействии человека и микроорганизмов. Роль здравоохранения в профилактике и лечении инфекционных заболеваний // Вестн. РАМН. - 2000. - №11. - с.7-11.
22. Larcombe L., Rempel J.D., Dembinski I. Differential cytocine genotipe frequencies. // Genes and Immunity. - 2005. - №6. – p.140-144.
23. Markus S., Samuel M. Behar. Role of CD1d-Restricted NKT Cells in Microbal Immunity. // Infection and Immunity. - 2003. - №10. – p.5447-5455.
24. Natural reviews / Microbiologi. - 2004. - №2. - p. 747-754.
25. Trends in Microbiologi. - 2000. - №9. - p.419-425.
ПРИЛОЖЕНИЯ
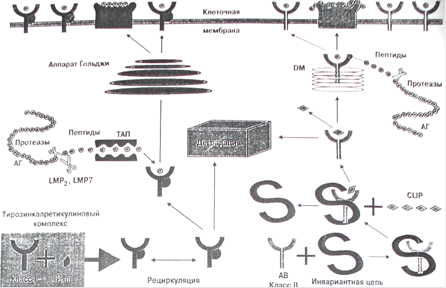
Рисунок 1. Процессинг и экспрессия HLA-пептида.
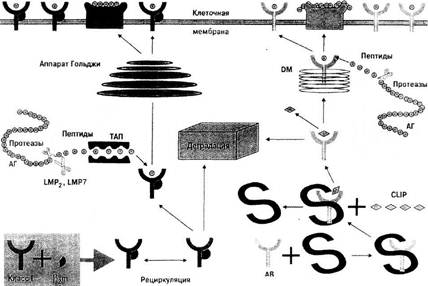
Рисунок 2. Персистентные микобактериальные инфекции и иммунный ответ хозяина.

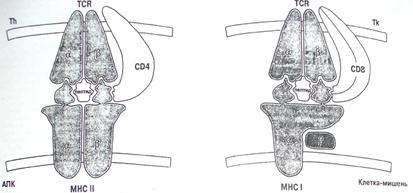
Рисунок 3. Т-клеточные популяции, вовлечённые в антимикробную защиту.
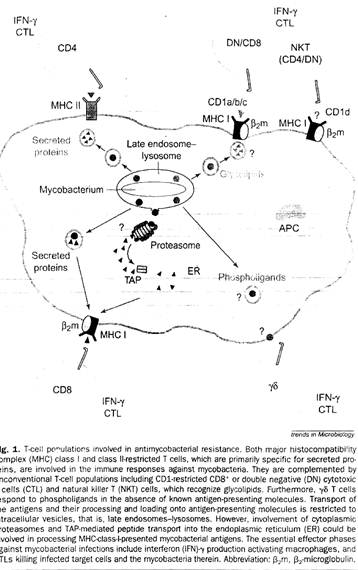
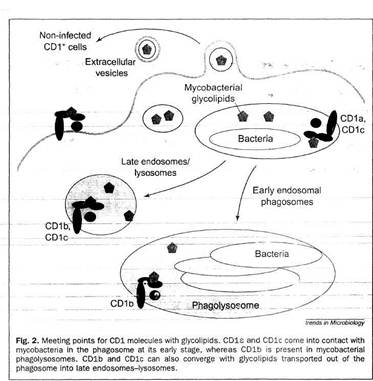
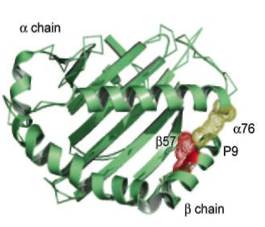
Рисунок 4. Встреча CD1 молекул с гликолипидами.
Похожие работы
... их гаплотических сочетаний у больных туберкулезом представителей русской этнической группы Челябинской области При сравнительном анализе особенностей распределения специфичностей генов HLA II класса у больных туберкулезом и здоровых представителей русской этнической группы Челябинской области были установлены следующие факты: у больных туберкулезом и здоровых пациентов были выявлены различия в ...
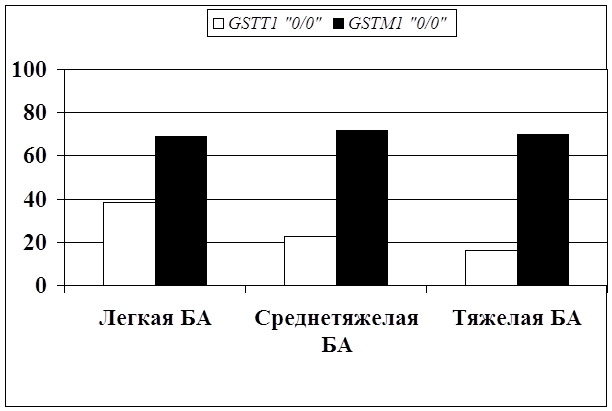
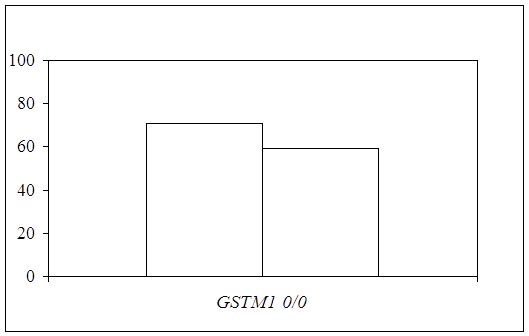
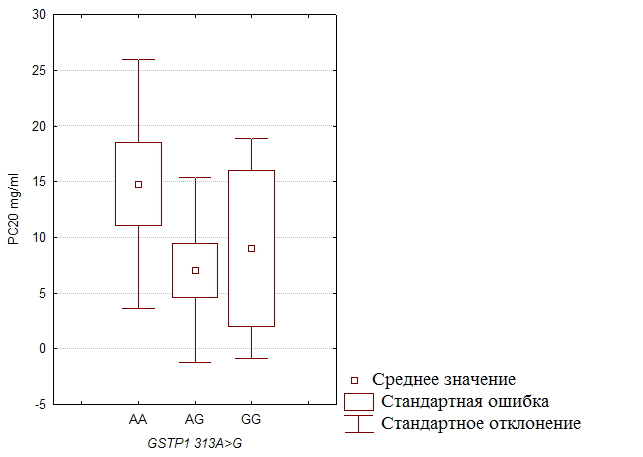
... препаратов. Установлена связь полиморфизма 313A>G гена GSTP1 с изменчивостью уровня аланинаминотрансферазы (р=0,021). 7. Выявлены различия в структуре генетической подверженности к бронхиальной астме и туберкулезу по генам ферментативной системы метаболизма ксенобиотиков: гены GSTM1, CYP2E1 и CYP2C19 связаны с бронхиальной астмой и значимыми для заболевания качественными и ...
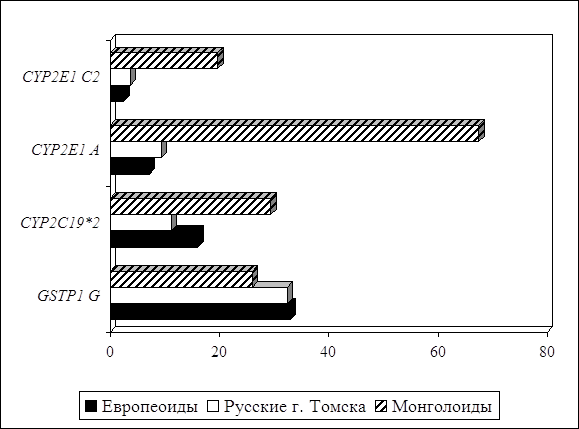
... о связи между частотой аллелей генов-кандидатов ТБ и особенностями распространения этого инфекционного заболевания. Выводы Выявлены особенности в распределении частот аллелей, изученных генов–кандидатов подвержености к туберкулезу, у русских жителей г. Томска по сравнению с другими популяциями мира. При сравнении с тувинцами показаны отличия в распределении генотипов и частот аллелей по всем ...
... фиброза и деформации лёгочной ткани. Фиброзно-кавернозный туберкулёз значительно хуже подвергается заживлению, чем кавернозный. Цирротический туберкулёз. Цирротический туберкулез лёгких характеризуется развитием в лёгочной ткани грубого, деформирующего орган склероза (цирроза), бронхоэктатических, посткавернозных типа кист полостей, эмзифематонных булл или каверн без признаков прогрессирования. ...

0 комментариев