Навигация
Анализ ассоциаций исследованных генов с количественными признаками туберкулеза
3.4.2 Анализ ассоциаций исследованных генов с количественными признаками туберкулеза
Туберкулез характеризуется специфическими проявлениями признаков, многие из которых имеют не качественную, а количественную природу. В связи с этим, одним из важных аспектов изучения генетических основ туберкулеза представляется анализ наследственной составляющей количественных признаков, существенных в патогенезе заболевания. С целью оценки влияния полиморфизма генов NRAMP1, VDR, IL1B, IL12B, IL1RN на течение туберкулезного процесса проведен поиск ассоциаций изучаемых маркеров с количественными, патогенетически важными признаками туберкулеза.
В эту часть исследования включили группу больных вторичным туберкулезом легких (181 человек), которую на 91% (165 человек) составили пациенты с распространенным туберкулезом, остальным был выставлен диагноз очагового туберкулеза легких и туберкулемы. Для остальных пациентов с вторичным ТБ показатели общего анализа крови на момент начала заболевания оказались недоступны.
Оценивали влияние изученных полиморфизмов на показатели крови при туберкулезе легких: гемоглобин, эритроциты, лейкоциты, скорость оседания эритроцитов (СОЭ), уровень палочкоядерных и сегментоядерных нейтрофилов, эозинофилов, лимфоцитов и моноцитов. Известно, что некоторые параметры крови зависят от пола и возраста индивида. Так, у русских г. Томска, больных туберкулезом показана зависимость от пола и возраста для лейкоцитов, СОЭ и моноцитов. В связи с этим перечисленные показатели анализировали отдельно в группе мужчин и женщин, к тому же вводилась поправка на возраст. Учитывая статистически значимые отклонения распределений большинства исследованных признаков от закона Гаусса по данным теста Колмогорова–Смирнова, сравнение проводилось с помощью непараметрических критериев Краскела–Уоллиса и Манна-Уитни [Гланц С., 1998].
Обнаружены ассоциации исследованных генов с рядом количественных показателей (табл. 23). Для полиморфизма 1188А/С гена IL12B показана связь с уровнем СОЭ и выраженностью палочкоядерного сдвига влево лейкоцитарной формулы, при этом генотип 1188А/С ассоциирован с повышением уровня палочкоядерных нейтрофилов независимо от пола больного и со значительным повышением уровня СОЭ у женщин при туберкулезе. В норме у женщин скорость оседания эритроцитов состаляет от 4 до 15 мм в час [Гольдберг Е.Д., 1989]. Так, полиморфизм 1188А/С гена IL12B проявил дифференциальное влияние на уровень СОЭ у представителей разного пола.
Полиморфизм F/f гена VDR проявил ассоциацию с уровнем сегментоядерных нейтрофилов. Среднее количество сегментоядерных нейтрофилов для обладателей генотипа ff составило 54%, в то время как для носителей других генотипов этот показатель равнялся 59%. В норме у здоровых уровень сегментоядерных нейтрофилов составляет 42,9% – 59,3% [Гольдберг Е.Д., 1989]. Таким образом, выявленная ассоциация прогностически нейтральна для туберкулеза, поскольку средний уровень сегментоядерных нейтрофилов при любом варианте гена оставался в пределах нормы. Для полиморфизмов генов NRAMP1, IL1B, IL1RN и варианта B/b гена VDR не показано связи с количественными признаками туберкулеза.
Таким образом, с помощью дисперсионного анализа удалось установить ассоциацию гена IL12B с количественными патогенетически важными признаками туберкулеза: палочкоядерным сдвигом лейкоцитарной формулы влево и с уровнем СОЭ у женщин. Известно, что степень ядерного сдвига нейтрофилов влево и уровень повышения СОЭ совпадают с активностью и тяжестью туберкулезного процесса [Шмелев Н.А., 1959; Кан Е.Л., 1972].
Таблица 23 Средние значения количественных признаков у носителей разных генотипов исследованных полиморфизмов
| Ген/ Поли-морфизм | Гено-типы | N | Признак | Среднее значение признака | S.D. | р для теста Краскела - Уоллиса | р для LSD теста |
| IL12B 1188A/C | AA | 97 | Палочко-ядерные нейтрофи-лы (%) | 5,206 | 4,943 | 0,031 | АА-АС* 0,007 |
| AC | 60 | 7,567 | 5,782 | АС-СС* 0,907 | |||
| CC | 11 | 7,364 | 5,372 | СС-АА* 0,201 | |||
| AA | 34 | СОЭ у женщин (мм/ч) | 24,765 | 19,285 | 0,010 | АА-АС* 0,006 | |
| AC | 24 | 39,833 | 20,466 | АС-СС* 0,044 | |||
| CC | 4 | 17,750 | 21,608 | СС-АА* 0,507 | |||
| VDR F/f | FF | 73 | Сегменто-ядерные нейтрофи-лы (%) | 59,890 | 9,389 | 0,039 | FF-Ff* 0,552 |
| Ff | 75 | 59,000 | 9,063 | Ff-ff* 0,034 | |||
| ff | 20 | 54,100 | 8,012 | ff-FF* 0,006 |
Примечание. N - численность генотипов; S.D. - стандартное отклонение; р - достигнутый уровень значимости; * - указаны генотипы, для которых сравнивали среднее значение признака
Важным обстоятельством является то, что ген IL12B проявил связь, как с туберкулезом, так и с качественными и количественными признаками заболевания. Кроме того показана ассоциация IL12B с туберкулезом, выявленная при помощи TDT – теста, анализирующего семейные данные. Это свидетельствует о неслучайном характере полученных ассоциаций и о том, что изученный ген играет важную роль в формировании подверженности к туберкулезу у русского населения г. Томска. Однако в исследовании тувинцев не показано ассоциаций с этим геном [Рудко А.А., 2004].
Интересным представляется то, что у жителей Тувы при поиске ассоциаций с количественными признаками туберкулеза найдена связь полиморфизма B/b гена VDR с количеством палочкоядерных нейтрофилов и полиморфизма VNTR гена IL1RN с уровнем СОЭ. Аллель b гена VDR оказался ассоциирован с нормальным количеством палочкоядерных нейтрофилов при туберкулезе, а аллель В – с палочкоядерным сдвигом влево лейкоцитарной формулы. Аллель А2 гена IL1RN проявил связь со значительным повышением СОЭ при ТБ у тувинцев [Рудко А.А., 2004]. В целом можно отметить, что при сравнении полученных ассоциаций полиморфизмов с качественными и количественными параметрами туберкулеза у русских г. Томска и у жителей Тувы найдены отличия по всем исследованным признакам, что говорит об этнической зависимости генетических основ подверженности к туберкулезу.
Заключение
При изучении роли генов–кандидатов подверженности туберкулезу в этиологии и клинических проявлениях заболевания использован следующий алгоритм работы. На первом этапе проведен анализ популяционной распространенности исследуемых полиморфизмов. Второй этап заключался в определении ассоциаций генетических маркеров с туберкулезом. Третий этап включал поиск связи аллельных вариантов генов с качественными и количественными патогенетически значимыми параметрами заболевания. Кроме того, проведен сравнительный анализ полученных результатов с исследованием тувинской популяции, выполненным ранее по той же методологии [Рудко А.А., 2004].
Изучена популяционная распространенность полиморфных вариантов генов NRAMP1, VDR, IL1B, IL1RN, IL12B у русских г. Томска. Это дало возможность провести сравнение между характерными особенностями распространения аллелей генов–кандидатов туберкулеза в различных популяциях мира. При этом выявлена специфичность их распространения у жителей г. Томска. Результаты сравнительного анализа представляются важными с точки зрения обнаружения связи между особенностями распределения частот аллелей генов–кандидатов туберкулеза и заболеваемостью этой инфекционной патологией в различных популяциях.
При сравнении частот аллелей и генотипов у русских и тувинцев показаны отличия практически по всем исследованным полиморфизмам, кроме варианта 274С/Т гена NRAMP1, однако статистические показатели сравнения генотипов для этого полиморфизма были пограничными (р=0,064). Структура неравновесия по сцеплению между парами полиморфных вариантов гена NRAMP1 оказалась идентичной у русских и тувинцев. Неравновесие между другими исследованными генетическими маркерами отличалось в изученных этнических группах. При сравнении частот аллелей и генотипов у больных туберкулезом русских и тувинцев выявлены отличия по всем полиморфизмам. В целом при межпопуляционном сравнении особенностий распределения аллелей генов-кандидатов ТБ и складывающихся межлокусных взаимодействиях у русских и тувинцев выявлены значительные отличия, что представляется важным с точки зрения генетической эпидемиологии.
Первостепенное внимание было уделено поиску ассоциаций полиморфизма генов NRAMP1, VDR, IL1B, IL1RN, IL12B с туберкулезом. Основой в проведенном исследовании вклада генов–кандидатов туберкулеза в формирование подверженности к заболеванию служил комплексный подход, заключающийся в характеристике полиморфизма этих генов, как на популяционном уровне, так и на семейном. При сравнении частот аллелей и генотипов у больных и здоровых установлена связь полиморфизма 1188А/С IL12B с туберкулезом (р=0,044 и р=0,035 соответственно), причем у носителей генотипа 1188С/С риск заболеть первичным туберкулезом возрастал в 13 раз, а вторичными формами инфекции – в 8 раз. Полученная связь генетического маркера с патологией методом случай–контроль подтверждена на семейной выборке больных. Дети с туберкулезом лишь в 13% случаев наследовали от родителей аллель 1188А, тогда как аллель 1188С - в 87% (TDT=8,07, р=0,005). С другими исследованными генами–кандидатами туберкулеза ассоциаций по данным теста TDT не получено. Также показано, что полиморфизм 1188А/С гена IL12B ассоциирован не с любым клиническим вариантом вторичного туберкулеза легких, а лишь с распространенным (объем поражения – более одной доли) (р=0,022), деструктивным ТБ (р=0,012).
Выявлено наличие ассоциации с заболеванием полиморфизма 1465-85G/A гена NRAMP1. У заболевших первичным туберкулезом чаще, чем в контрольной группе встречался гетерозиготный генотип 1465-85G/A (р=0,004), риск заболевания у этих индивидов был в 3 раза выше, чем у обладателей других генотипов этого полиморфизма. К тому же показана протективная роль в отношении первичного туберкулеза для генотипа 1465-85G/G NRAMP1.
Показана связь полиморфизма 274С/Т гена NRAMP1 с вторичным туберкулезом легких, причем с деструктивными (р=0,005) и распространенными (р=0,002) формами. Индивиды с генотипом 274С/Т преобладали в 1,66 раза в группе больных по сравнению с контролем. Лица, обладающие генотипом 274С/C, статистически значимо чаще встречались среди здоровых (OR=0,54).
В результате проведенного анализа установлена значимость VNTR полиморфизма гена IL1RN при туберкулезе. Частота аллеля А2 была выше в группе больных по сравнению с контролем (р=0,023). При сравнении частот генотипов выявлена предрасполагающая к ТБ роль гетерозигот А1/А2 (OR=2,10, р=0,030). Установлено, что выявленная ассоциация VNTR гена IL1RN c патологией обусловлена связью этого полиморфизма с вторичными формами туберкулеза легких, так как распределение генотипов различалось в группах лиц с вторичным генезом заболевания и здоровых (р=0,025), а в выборках с первичным туберкулезом и контрольной отличий не показано. Кроме того выявлена связь этого маркера с распространенным (р=0,018) и деструктивным (р=0,017) вторичным туберкулезом легких.
Ген IL1B, продукт экспрессии которого является провоспалительным цитокином, проявил статистически значимую связь с вторичным деструктивным туберкулезом легких. Аллель А2 полиморфизма +3953 этого гена чаще определяли у больных, чем у здоровых (р=0,008). Распределение генотипов в группе больных деструктивными формами заболевания и здоровых также различалось (р=0,022). Кроме того аллель А2 оказался ассоциирован с небольшим объемом туберкулезного поражения в легком (1-2 сегмента) (р=0,015) (рис. 6)
При определении неравновесия между полиморфизмами генов IL1B и IL1RN показано, что аллель +3953А1 и аллель А1 полиморфизма VNTR находятся в фазе отталкивания, мера неравновесия для них составила –0,033 (р=0,009). При сравнении частоты гаплотипа IL1RN*A1A1/IL1B*A1A1 в группах больных туберкулезом и здоровых индивидов найдено, что статистически чаще это сочетание встречается в контрольной выборке (р=0,003). При этом риск заболеть туберкулезом у носителей этого гаплотипа был равен 0,50. Таким образом, гаплотип IL1RN*A1A1/IL1B*A1A1 имеет протективный эффект и защищает его обладателя от заболевания туберкулезом.
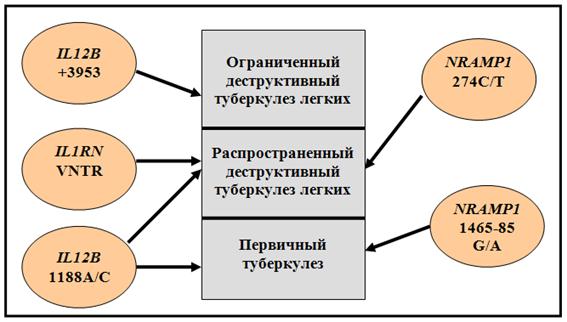
Рис. 6. Ассоциации исследованных генов с туберкулезом
При анализировании анамнестических данных показано, что родственники индивидов больных туберкулезом, не имеющие контакта с пробандами, страдают от этого заболевания чаще, чем родственники здоровых людей (OR=3,63, p<0,000). Это свидетельствует о наследственной предрасположенности к туберкулезу.
При сравнении выявленных ассоциаций исследованных генов с ТБ у русских г. Томска и коренных жителей Тувы показаны значительные отличия. Результаты, полученные при изучении тувинского этноса, свидетельствуют о незначительном вкладе исследованных полиморфизмов в формирование подверженности к туберкулезу [Рудко А.А., 2004]. У жителей г. Томска, напротив, получены ассоциации для 5 из 9 исследованных полиморфизмов генов-кандидатов предрасположенности к ТБ. Такие отличия в проявлении эффекта изученных генов, вероятно, обусловлены разным генетическим фоном у русских и тувинцев. Известно, что каждый ген действует не самостоятельно, а во взаимодействии со множеством других генов, следовательно, эффекты генов проявляют зависимость от того генетического фона, на котором действует ген.
Установлено, что полиморфизмы 469+14G/C гена NRAMP1 и B/b гена VDR не предрасполагают к туберкулезу, однако они оказывают влияние на течение возникшего заболевания. При сравнении распределений генотипов и частот аллелей 469+14G/C гена NRAMP1 в группах больных туберкулезом с деструкцией легочной ткани и больных туберкулезом без деструкции выявлены статистически значимые отличия. Так, частота аллеля 469+14С этого гена в выборке больных с экссудативно-некротическим и пролиферативно-некротическим типом воспалительной реакции была выше, чем в группе больных с пролиферативными и экссудативным типом воспалительной реакции (р=0,027). Кроме того, этот полиморфизм оказался значимым в определении обьема поражения при туберкулезе легких. Частота аллеля 469+14С в группе больных распространенным туберкулезом превышала таковую в группе больных с ограниченной формой заболевания (р=0,016).
Таким образом, можно говорить о вкладе 469+14С аллеля гена NRAMP1 не только в формирование деструкции при туберкулезе, но и в увеличение зоны поражения. Показано влияние полиморфизма B/b гена VDR на распространенность зоны туберкулезного поражения, поскольку аллель b статистически значимо чаще выявляли у больных с легочным поражением в пределах 1-2 сегментов (р= 0,011).
Обнаружены ассоциации исследованных генов с рядом количественных показателей. Для полиморфизма 1188А/С гена IL12B показана связь с уровнем СОЭ и выраженностью палочкоядерного сдвига влево лейкоцитарной формулы, при этом аллель 1188С ассоциирован с повышением палочкоядерных нейтрофилов независимо от пола больного (р=0,031), а генотип 1188АС – с значительной степенью повышения СОЭ у женщин (р=0,010) (рис. 7).

Рис. 7. Ассоциации исследованных генов с качественными и количественными, патогенетически значимыми параметрами туберкулеза
При сравнении показанных ассоциаций исследованных полиморфизмов генов с патогенетически важными параметрами ТБ у русских и тувинцев выявлены различия. У коренных жителей Тувы максимально значимыми с точки зрения прогнозирования клинического течения туберкулезного процесса оказались полиморфизм B/b гена VDR и полиморфизм VNTR гена IL1RN. Для этих генетических маркеров выявлены ассоциации с деструкцией при ТБ, повышением СОЭ и со сдвигом лейкоцитарной формулы влево [Рудко А.А.,2004]. У жителей г. Томска ассоциированными с перечисленными параметрами туберкулеза оказались другие полиморфизмы. Таким образом, при межпопуляционном сравнении генов-кандидатов подверженности к ТБ у русских и тувинцев выявлены отличия, как по генетической структуре популяций, так и по вовлеченности в формирование генетической основы предрасположенности к туберкулезу и его особенностей клинического течения.
Функциональные механизмы, определяющие полученные ассоциации, возможно, связаны с действием продуктов экспрессии этих генов на патогенез заболевания. В случае подтверждения этой гипотезы, аллели 1465-85А гена NRAMP1, 1188С гена IL12B могут стать маркерами предрасположенности к первичному туберкулезу, а аллели 274Т гена NRAMP1, A2 VNTR полиморфизма гена IL1RN, +3953A2 гена IL1B, 1188С гена IL12B – маркерами подверженности к вторичному туберкулезу с деструкцией легочной ткани (рис. 6). Кроме того, зная генотип больного по полиморфизмам 469+14G/С гена NRAMP1 и B/b гена VDR, вероятно можно будет прогнозировать течение туберкулезного процесса (рис. 7). В целом, полученные данные позволят глубже проникнуть в патогенез туберкулеза, его отдельных клинических форм, также они представляются важными для формирования представления о связи между частотой аллелей генов-кандидатов ТБ и особенностями распространения этого инфекционного заболевания.
Выводы
Выявлены особенности в распределении частот аллелей, изученных генов–кандидатов подвержености к туберкулезу, у русских жителей г. Томска по сравнению с другими популяциями мира. При сравнении с тувинцами показаны отличия в распределении генотипов и частот аллелей по всем рассматриваемым генам, как у здоровых индивидов, так и у больных туберкулезом.
У русских жителей г. Томска наблюдается неравновесие по сцеплению между четырьмя парами полиморфизмов гена NRAMP1: 469+14G/C и 274C/T (D=+0,104), 469+14G/C и 1465-85G/A (D=+0,078), 274C/T и 1465-85G/A (D=+0,085), D543N и 1465-85G/A (D=+0,017) и между полиморфизмами B/b и F/f гена VDR (D=+0,053). Структура неравновесия по сцеплению между полиморфизмами гена NRAMP1 не отличается от таковой у тувинцев.
Родственники индивидов больных туберкулезом заболевают этой инфекцией чаще, чем родственники здоровых лиц, даже при отсутствии семейного контакта с больным пробандом (OR=3,63, p<0,000).
Полиморфные варианты 1188A/C гена IL12B и 1465-85G/A гена NRAMP1 ассоциированны с туберкулезом первичного генеза у русских г. Томска. Распространенный вторичный туберкулез с деструкцией легочной ткани связан с изменчивостью по 274С/Т гена NRAMP1, 1188A/C гена IL12B, VNTR гена IL1RN, а ограниченный вторичный туберкулез с деструкцией легочной ткани – с полиморфизмом +3953А1/А2 гена IL1B.
Генотип 1465-85G/G NRAMP1 проявляет протективный эффект при первичном туберкулезе (OR=0,33, p=0,005), а генотипы 274С/С гена NRAMP1 (OR=0,51, p=0,005), А1/А1 IL1RN (OR=0,55, p=0,007) и гаплотип IL1RN*A1A1/IL1B*A1A1 (OR=0,50, p=0,003) – при вторичном туберкулезе. Рисковыми генотипами для туберкулеза являются 1465-85G/A NRAMP1 (OR=3,16, p=0,002) и 1188C/C IL12B (OR=13,47, p=0,013) при первичном генезе заболевания, 1188C/C IL12B (OR=7,43, p=0,023), 274С/Т NRAMP1 (OR=1,75, p=0,026), 274Т/Т NRAMP1 (OR=5,01, p=0,037) и А1/А2 IL1RN (OR=2,20, p=0,002) при вторичном туберкулезе.
Для полиморфизмов 1188А/С гена IL12B, 469+14G/C гена NRAMP1 и B/b гена VDR выявлена ассоциация с качественными и количественными патогенетически важными признаками туберкулеза: уровнем палочкоядерных нейтрофилов, показателем скорости оседания эритроцитов у женщин, деструкцией ткани легкого и объемом поражения легочной ткани при туберкулезе.
Выявлены отличия в структуре генетической компоненты подверженности к туберкулезу у русских и тувинцев, заключающиеся в разном вкладе исследуемых генов в формирование предрасположенности к заболеванию и в клинические проявления туберкулеза.
Список литературы
1. Авербах М.М. Иммунология и иммунопатология туберкулеза. - М.: Медицина, 1976. - 311с.
2. Авербах М. М., Литвинов В. И., Гергерт Г. В. Иммунологические аспекты легочной патологии. - М.: Медицина, 1980. - 113 с.
3. Авербах М. М., Гергерт В. Я., Мороз А. М. и др. Современные аспекты фтизиоиммунологии // Сб. трудов ЦНИИТ. – 1982. - С. 3-9.
4. Авербах М. М., Мороз А. М., Апт А. С. и др. Межлинейные различия чувствительности мышей к туберкулезу // Иммунология. - 1980. - №2. - С. 42-43.
5. Алтухов Ю. П. Генетические процессы в популяциях. – М.: ИКЦ "Академкнига", 2003. – 431 с.
6. Алтухов Ю. П., Курбатова О. Л. Наследственность человека и окружающая среда. – М.: Наука, 1984. – С. 7-34.
7. Апт А. С., Никоненко Б. В., Мороз А. М., Авербах М. М. Генетический анализ факторов, детерминирующих восприимчивость к туберкулезу // Бюл. Эксперимю биол. – 1982. – № 12. – С. 83-85.
8. Апт А. С. Генетические аспекты выявления групп риска по туберкулезу // Проблемы туберкулеза. - № 10. – С. 65-68.
9. Белиловский Е. М., Борисов С. Е., Дергачев А. В. и др. Заболеваемость туберкулезом в России: ее структура и динамика // Проблемы туберкулеза. – 2003. - № 7. – С. 4-11.
10. Березовский Б. А., Мостовой Ю. М., Пухлик Б. М., Михей Л. В. Проверка гипотезы мультифакториального типа наследования предрасположенности к туберкулезу легких // Проблемы туберкулеза. – 1986. – №2. – С.24-26.
11. Богадельникова И. В., Сергеев А. С., Агапова Р. К., Перельман М. И. Исследование уровней гетерозиготности у больных туберкулезом легких с различной эффективностью лечения // Вестник РАМН. – 2000. – № 3. – С. 15-21.
12. Вахидова Г. А., Еремеев В. В., Убайдуллаев А. М. Иммунологические механизмы патогенеза туберкулеза // Проблемы туберкулеза. – 1991. – № 5. – С. 69-71.
13. Вейр Б. Анализ генетических данных. – М.: Мир, 1995. – 400 с.
14. Визель А. А., Гурелева М. Э. Туберкулез. – М.: ГЭОТАР Медицина, 2000. - 208 с.
15. Галактионов В. Г. Иммунология. – М.: МГУ, 1998. – 440 с.
16. Гамалея Н. Ф. Инфекция и иммунитет. – М.: Медицина, 1939. – 280 с.
17. Гланц С. Медико-биологическая статистика. – М.: Практика, 1998. - 459 с.
18. Гольдберг Е. Д. Справочник по гематологии с атласом микрофотограмм. – Томск: Изд-во Том. Ун-та, 1989. – 468 с.
19. Давыдовский И. В. Проблема причинности в медицине. – М.: Медицина, 1962. – 728 с.
20. Еремеев В. В. Взаимодействие макрофаг-микобактерия в процессе реакции микроорганизма на туберкулезную инфекцию // Проблемы туберкулеза. – 2004. – № 8. – С. 3-7.
21. Ерохин В. В. Основные итоги и перспективы работы сотрудничающего центра ВОЗ по борьбе с туберкулезом в Российской Федерации. // Проблемы туберкулеза. – 2003. – № 3. – С. 11-21.
22. Ерохин В. В. Субклеточная морфология легких при экспериментальном туберкулезе // Автореф. дис. д-ра мед. наук. – М., 1974 – 42 с.
23. Ерохин В. В., Земскова З. С. Современные представления о туберкулезном воспалении // Проблемы туберкулеза. – 2003. – № 3. – С. 11-21.
24. Животовский Л. А. Интеграция полигенных систем в популяциях. Проблемы анализа комплексных признаков. – М.: Наука, 1984. – 183 с.
25. Животовский Л. А. Статистические методы анализа частот генов в природных попкляциях // М.: ВИНИТИ, 1983. – Т. 8. – С. 76-104.
26. Земскова З. С., Дорожкова И. Р. Скрыто протекающая туберкулезная инфекция. – М: Медицина, 1984. – 224 с.
27. Имангулова М. М., Бикмаева А. Р., Хуснутдинова Э. К. Исследование полиморфных локусов D543N и 3-UTR гена NRAMP1 у больных инфильтративным туберкулезом легких в Башкортостане // Медицинская генетика. – 2004. – № 8. – Т. 4. – С. 376-379.
28. Имангулова М. М., Бикмаева А .Р., Хуснутдинова Э. К. Полиморфизм кластера гена интерлейкина 1 у больных туберкулезом легких // Цитокины и воспаление. – 2005. – № 1. – Т. 4. – С. 36-41.
29. Кан Е. Л. Изменения в системе крови и их диагностическое значение / Руководство по туберкулезу органов дыхания. – М., 1972. - С.116-128.
30. Клеточная биология легких в норме и при патологии. / Под ред. В. В. Ерохина, Л. М. Романовой // М.: Медицина, 2000. – 469 с.
31. Кноринг Б. Е., Фрейдлин И. С., Симбирцев А. С. и др. Характер специфического иммунного ответа и продукция цитокинов мононуклеарами крови больных разными формами туберкулеза легких // Медицинская иммунология. – 2001. – Т. 3. - № 1. – С. 61-69.
32. Кобринский Б. А. Формирование групп риска и прогноз развития заболеваний // Вестник АМН. – 1987. – № 4. – С. 85-89.
33. Краснов В. А. Калачев И. В. Степанов Д. В. и др. Перспективы развития противотуберкулезной помощи населению Сибири. // Проблемы туберкулеза. – 2003. - № 5. – С. 3-6.
34. Лакин Г. Ф. Биометрия. – М.: Наука, 1990. – 300 с.
35. Лильин Е. Т., Трубников В. И., Ванюков М. М. Введение в современную фармакогенетику // М.: Медицина, 1984. – 160 с.
36. Литвинов В. И., Чуканова В. П., Маленко А. Ф. и др. Проблемы иммуногенетики болезней легких // Сборник трудов ЦНИИ туберкулеза МЗ СССР. – 1983. – Т. 37. – С. 16-19.
37. Литвинов В. И., Гергерт В. Я., Мороз А. М. и др. Иммунология туберкулеза: современное состояние проблемы // Вестник РАМН. – 1999. – №7. – С. 8-11.
38. Маниатис Т., Фрич Э., Сэмбук Дж. Методы генетической инженерии. Молекулярное клонирование. – М.: Мир, 1984. – 480 с.
39. Меньшиков В.В. Лабораторные методы исследования в клинике. - М.: Медицина, 1987. - 350с.
40. Мороз А. М. Иммуногенетические механизмы резистентности к туберкулезу (экспериментальное исследование) / Дис. д-ра мед. наук. – М., 1984. – 42 с.
41. Мурашкина Г.С., Алексеева Т.В., Ревякина О.В., Новикова Н.М. Туберкулез в западной Сибири //Современная фтизиатрия и проблемы туберкулеза XXI века. - Тезисы докладов. - 1999. - С.5.
42. Онищенко Г. Г. Эпидемическая ситуация в Российской Федерации и меры по ее стабилизации // Проблемы туберкулеза. – 2003. - № 11. – С. 4-9.
43. Пальцев М. А. Молекулярная медицина // Вестник молодых ученых. – 2002. - № 4. – С. 64-84.
44. Пальцев М. А. Значение биомедицинских фундаментальных исследований для фтизиатрии // Проблемы туберкулеза. – 2004. - № 3. – С. 3-7.
45. Патофизиология: учебник для медицинских вузов / Под ред. В. В. Новицкого, Е. Д. Гольдберга // Томск: Из-во Том. ун-та, 2001. – 716 с.
46. Перельман М. И., Хомяков Ю. Н., Киселев В. И. и др. Молекулярная медицина и лечение туберкулеза // Проблемы туберкулеза. – 2001. - № 5. – С. 5-7.
47. Перельман М. И. Основные итоги противотуберкулезной работы в России в 2001 г. // Проблемы туберкулеза. – 2003. - № 2. – С. 3-11.
48. Пименов Е. В., Тотолян А. А., Бывалов А. А. и др. Современные представления о патогенезе инфекционных заболеваний // Вестник РАМН. – 2003. – № 6. – С. 3-9.
49. Покровский В. И., Авербах М. М., Литвинов В. И., Рубцов И. В. Приобретенный иммунитет и инфекционный процесс. – М.: Медицина, 1979. – 280 с.
50. Пузик В. И., Уварова О. А., Авербах М. М. Патоморфология современных форм легочного туберкулеза. – М.: Медицина, 1973. – 244 с.
51. Пузырев В. П. Генетика мультифакториальных заболеваний: между прошлым и будущим // Медицинская генетика. – 2003. – Т.2. № 12. – С. 498-508.
52. Пузырев В. П., Никитин Д. Ю., Напалкова О. В. Ген NRAMP1: структура, функция и инфекционные болезни человека // Молекулярная генетика, микробиология и вирусология. – 2002. – №3. – С.34-40.
53. Пузырев В. П., Степанов В. А. Патологическая анатомия генома. – Новосибирск: Наука, 1997. – 224 с.
54. Рабухин А.Е. Туберкулез органов дыхания у взрослых. – М.: Медицина, 1976. - 328с.
55. Рабухин А. Е. Исторический очерк развития учения о туберкулезе. Руководство по туберкулезу. – М., 1959 – 134 с.
56. Рабухин А. Е. Эпидемиология и патогенез легочного туберкулеза.– М., 1948 – 120 с.
57. Ридер Г. Л. Эпидемиологические основы борьбы с туберкулезом // Пер. с англ. – М.: Весь Мир. – 2001. – 192 с.
58. Ройт А. Основы иммунологии. – М.: Мир, 1991. – 327 с.
59. Ройт А., Бростофф Дж., Мейл Д. Иммунология. – М.: Мир, 2000. – 592 с.
60. Рудко А. А. Аллельные варианты генов подверженности к туберкулезу у тувинцев / А.А. Рудко: Автореф. дисс. канд. мед. наук. - Томск, 2004. - 20 с.
61. Рудко А. А., Ондар Э. А., Фрейдин М. Б., Пузырев В. П. Полиморфизм генов NRAMP1 и IL12B у больных туберкулезом и здоровых жителей республики Тыва / Актуальные проблемы сохранения здоровья населения Республики Тыва // Под ред. Ондар Э. А., Монгуш Р. Ш. – Вып. 3. – Кызыл: ТывГУ, 2003. – С. 55-62.
62. Рудко А. А., Ондар Э. А., Фрейдин М. Б., Пузырев В. П. Полиморфизм генов NRAMP1 и IL12B у больных туберкулезом Республики Тыва / Сборник тезисов "Вопросы сохранения и развития здоровья населения Севера и Сибири" / Красноярск, 2003. – С. 372-374.
63. Рудко А. А., Ондар Э. А., Фрейдин М. Б., Пузырев В. П. Полиморфизм генов-кандидатов подверженности к туберкулезу у населения Республики Тыва / Сборник тезисив 3-го съезда генетиков и селекционеров России "Генетика в XXI веке: современное состояние и перспективы развития" / М. – 2004. – С. 93.
64. Рудко А. А., Фрейдин М. Б. Генетика предрасположенности к туберкулезу / Генетика человека и патология: Сборник научных трудов / Под. ред. В. П. Пузырева. – Вып. 6. – Томск: "Печатная мануфактура". – 2002. – С. 170-176.
65. Рудко А. А., Фрейдин М. Б. Генетические основы подверженности к туберкулезу // Тихоокеакский медицинский журнал. – 2002. - №1(8). – С. 61-61.
66. Рудко А. А., Фрейдин М. Б., Пузырев В. П. Полиморфизм генов NRAMP1 и IL12B у больных туберкулезом Республики Тыва / Сборник тезисов 13-го национального конгресса по болезням органов дыхания / Санкт-Петербург, 2003. – С. 289.
67. Сабадаш Е. В., Павлов В. А., Кравченко М. А. и др. К вопросу о формировании естественной резистентности к туберкулезу / Материалы междун. конф. "Туберкулез – старая проблема в новом тысячелетии", 1-5 июля 2002г. – М.: Медицина и жизнь. – С. 150-151.
68. Селедцова Г. В., Козлов В. А. Иммунорегуляторные свойства моноцитов/макрофагов у больных туберкулезом легких // Проблемы туберкулеза. – 1991. - № 5. – С. 54-56.
69. Сергеев А. С., Богадельникова И. В., Агапова Р. К., Перельман М. И. Анализ уровней гетерозиготности по локусам PL, TF, PGM1, ACP1, HP, GC, GLO1, C3 и ESD у больных туберкулезом легких с различной эффективностью лечения // Генетика. – 2001. – Т.37. № 12. – С. 1673-1680.
70. Симбирцев А. С. Цитокины – новая система регуляции защитных сил организма // Цитокины и воспаление. – 2002. – Т.1.№ 1. – С. 9-16.
71. Скворцова Л. А., Павлова М. В., Виноградова Т. И., Арчакова Л. И. Комплексная терапия туберкулеза легких с применением рекомбинантных интерлейкинов // Проблемы туберкулеза. – 2003. – № 10. – С. 9-12.
72. Скутко А.Я. Особенности клиники деструктивных и кавернозных форм туберкулеза легких у впервые выявленных больных //Врачебное дело. - 1970. - №12. - С.61-65.
73. Состояние противотуберкулезной помощи населению сибирского и дальневосточного федеральных округов по итогам работы в 2003 году / Под ред. В. А. Краснова // Новосибирск. – 2004. – 122 с.
74. Справочные материалы по эпидемиологии туберкулеза в Сибирском и Дальневосточном федеральном округах / Выездное заседание президиума СО РАМН 19 мая 2004 г., г. Новосибирск.
75. Стрелис А.К. Актовая речь //Современная фтизиатрия и проблемы туберкулеза XXI века. - Томск, 1999. - 69с.
76. Стрелис А. К. Туберкулез сегодня – инфекционный агрессор и бомба замедленного действия / Сборник трудов международной научно-практической конференции "Проблемы туберкулеза и современные пути их решения", 7-8 октября 2004 г. – Томск. – С. 19-23.
77. Струков А. И. Формы легочного туберкулеза в морфологическом освещении. – М., 1948. – 160 с.
78. Cтруков А.И. Кауфман О.Я. Гранулематозное воспаление и гранулематозные болезни. - М: Медицина, 1989. - 184с.
79. Тотолян А. А., Фрейдлин И. С. Клетки иммунной системы. - СПб.: Наука, 2000. – 231 с.
80. Туберкулез. Руководство для врачей / Под ред. А. Г. Хоменко. – М.: Медицина, 1996. – 496 с.
81. Уварова О. А., Ильина Т. Я., Зикеев В. В. Взаимосвязь морфологических иммунных реакций и характера туберкулезного процесса в легких // Проблемы туберкулеза. – 1981. – № 4. – С. 65-68.
82. Урсов И. П. Эпидемиология туберкулеза. – Новосибирск, 1997. – 112 с.
83. Флейс Д. Статистические методы для изучения таблиц долей и пропорций. - М.: Финансы и статистика, 1989. – 319 с.
84. Фогель Ф., Мотульски А. Генетика человека: Пер. с англ. – М.: Мир, 1989. – Т.1 – 313 с.
85. Фрейдлин И.С. Система мононуклеарных фагоцитов. - М., 1984. - 272с.
86. Хаудамова Г. Т. Риск заболевания туберкулезом основных этнических групп Казахстана // Проблемы туберкулеза. – 1991. – №4. – С. 22-25.
87. Холмовская М. Б. Исторический очерк развития медико-биологического учения о туберкулезе. – М., 1997. – 247 с.
88. Хоменко А. Г. Проблемы наследственности при болезнях легких. – М.: Медицина, 1990. – 240 с.
89. Хонина Н. А., Никонов С. Д., Шпилевский С. В. и др. Особенности иммунитета у больных с различными формами туберкулеза легких // Проблемы туберкулеза. – 2000. – №1. – С. 30-32.
90. Чуканова В. П., Сергеев А. С., Мороз А. М., Гафуров К. Г. Роль наследственных факторов при туберкулезе // Проблемы туберкулеза. – 1981. – №11. – С. 46-50.
91. Чуканова В. П., Литвинов В. И., Поспелов Л. Е., Слогоцкая Л. В. Значение факторов наследственной предрасположенности в развитии и течении легочного туберкулеза // Проблемы туберкулеза. – 1995. – №2. – С. 6-9.
92. Чуканова В. П., Поспелов Л. Е., Маленко А. Ф. Значение факторов наследственной предрасположенности при туберкулезе и других гранулематозных заболеваниях легких // Проблемы туберкулеза. – 2001. – №2. – С. 33-36.
93. Шевченко Ю. Л. Борьба с туберкулезом в России на пороге ХХ1 века // Проблемы туберкулеза. – 2000. - № 3. – С. 2-5.
94. Шмелев Н.А. Цитологический анализ крови и его значение при туберкулезе. -М.: Медицина, 1959. – 112 с.
95. Штефко В. Г. Туберкулез и конституция. – Л., 1930. – 240 с.
96. Ярилин А. А. Симбиотические взаимоотношения клеток иммунной системы // Иммунология. – 2001. - №4. – С. 16-20.
97. Ярилин А. А. Межклеточная кооперация при иммунном ответе // Вестник РАМН. – 1999. - №4. – С. 25-29.
98. Abe T., Linuma Y., Ando M. et al. Nramp1 polymorphisms susceptibility and clinical features of tuberculosis // J. Infect. Dis. – 2003. – Vol. 46. – P. 215-220.
99. Abel L., Casanova J. L. Genetic predisposition to clinical tuberculosis: bridging the gap between simple and complex inheritance // Am. J. Hum. Genet. – 2000. – Vol. 67. – P. 274-277.
100. Abel L., Dessein A. J. The impact of host genetics on susceptibility to human infectious diseases // Curr. Opin. Immunol. – 1997. – Vol. 9. – P. 509-516.
101. Altare F., Jouanguy E., Lamhamedi S. et al. Mendelian susceptibility to mycobacterial infection in man // Curr. Opin. Immunol. – 1998. – Vol. 10. – P. 413-417.
102. Baghdadi J. E., Remus N., Benslimane A. et al. Variants of the human NRAMP1 gene and susceptibility to tuberculosis in Morocco // Int. J. Tuberc. Lung Dis. – 2003. – Vol. 7(6). – P. 599-602.
103. Barton C. H., Biggs T. E., Baker S. T. et al. Nramp1: a link between intracellular iron transport and innate resistance to intracellular pathogens // J. Leuk. Biol. – 1999. – Vol. 66. – P.757-762.
104. Bellamy R. Genetic susceptibility to tuberculosis in human populations // Thorax. – 1998. – Vol. 53. – P. 588-593.
105. Bellamy R. Identifying genetic susceptibility factors for tuberculosis in Africans: a combined approach using a candidate gene study and a genome-wide screen // Clin. Science. – 2000. – Vol. 98. – P.245-250.
106. Bellamy R. The natural resistance-associated macrophage protein and susceptibility to intracellular pathogens // Microbes and Infection. – 1999. – Vol. 1. – P. 23-27.
107. Bellamy R., Beyers N., McAdam K. P. W. J. et al. Genetic susceptibility to tuberculosis in Africans: a genome-wide scan // Proc. Natl. Acad. Sci. USA. – 2000. – Vol. 97. – P. 8005-8009.
108. Bellamy R., Hill A. V. S. Genetic susceptibility to mycobacteria and other infectious pathogens in humans // Curr. Opin. Immunol. – 1998. – Vol. 10. – P. 483-487.
109. Bellamy R., Ruwende C., Corrah T. et al. Assessment of the interleukin 1 gene cluster and other candidate gene polymorphisms in host susceptibility to tuberculosis // Tuber. Lung. Dis. – 1998. – Vol. 79(2). – P. 83-89.
110. Bellamy R., Ruwende C., Corrah T. et al. Tuberculosis and chronic hepatitis B virus infection in Africans and variation in the vitamin D receptor gene // J. Infect. Dis. – 1999. – Vol. 179. – P. 721-724.
111. Bellamy R., Ruwende C., Corrah T. et al. Variations in the NRAMP1 gene and susceptibility to tuberculosis in west Africans // N. Engl. J. Med. – 1998. – Vol. 338(10). – P. 640-644.
112. Blackwell J. M., Barton C. H., White J. K. et al. Genetic regulation of leishmanial and mycobacterial infections: the Lsh/lty/Bcg gene story continues // Immunol. Lett. – 1994. – Vol. 43. – P. 99-107.
113. Blackwell J. M., Barton C. H., White J. K. et al. Genomic organisation and sequence of the human NRAMP gene: identification and mapping of a promoter region polymorphism // Mol. Med. – 1995. – Vol.1. – P. 194-205.
114. Blackwell M. J., Searle S. Genetic regulation of macrophage activation: understanding the function of Nramp1 (= Ity/Lsh/Bcg ) // Immunol. Lett. – 1999. – Vol. 65. – P. 73-80.
115. Bornman L., Campbell S. J., Fielding K. et al. Vitamin D receptor polymorphisms and susceptibility to tuberculosis in west Africa: a case-control and family study // J. Infect. Dis. – 2004. – Vol. 190(9). – P. 1631-1641.
116. Bradley D. J. Regulation of Leishmania populations within the host. II. Genetic control of acute susceptibility of mice to Leishimania donovani infection // Clin. Exp. Immunol. – 1977. – Vol. 30. – P. 130-140.
117. Brightbill H. D., Libraty D. H., Krutzik S. R. et al. Host defense mechanisms triggered by microbial lipoproteins through toll-like receptors // Science. – 1999. – Vol. 285. – P. 732-736.
118. Cadranel J., Hance A. J., Milleron B. et al. The production of 1,25(OH)2D3 by cells recovered by bronchoalveolar lavage and the role of this metabolite in calcium homeostasis // Am. Rev. Respir. Dis. – 1988. – Vol. 138. – P. 984-989.
119. Canonne-Hergaux F., Gruenheid S., Govoni G., Gros P. The Nramp1 protein and its role in resistance to infection and macrophage function // Proc. Assoc. Am. Physicians. – 1999. – Vol. 111(4). – P. 283-289.
120. Cellier M., Belouchi A., Gros P. Resistance to intracellular infections: comparative genome analysis of NRAMP // Trends Genet. – 1996. – Vol. 92. – P. 201-204.
121. Cellier M., Govoni G., Vidal S. et al. Human natural resistance-associated macrophage protein: cDNA cloning, chromosomal mapping, genomic organization, and tissue-specific expression // J. Exp. Med. – 1994. – Vol. 180. – P. 1741-1752.
122. Cellier M., Bergevin I., Boyer E. et al. Polyphyletic origins of bacterial Nramp transporters // Trends Genet. – 2001. – Vol. 17. – № 7. – P. 365-370.
123. Cervino A. C. L., Lakiss S., Sow O. et al. Fine mapping of a putative tuberculosis – susceptibility locus on chromosome –15q11-13 in African families // Hum. Mol. Genet. – 2002. – Vol. 11. – P. 1598-1603.
124. Cervino A. C. L., Lakiss S., Sow O., Hill A. V. S. Allelic association between the NRAMP1 gene and susceptibility to tuberculosis in Guinea – Conakry // Ann. Hum. Genet. – 2000. – Vol. 64. – P. 507-512.
125. Chan T. Y. Vitamin D deficiency and susceptibility to tuberculosis // Calcif. Tissue. Int. – 2000. – Vol. 66(6). – P. 476-478.
126. Chensue S. W., Davey V. P., Remick D. G., Kunkel S. L. Release of interleukin-1 by peripheral blood mononuclear cells in patiens with tuberculosis and active inflammation // Infect. Immun. – 1986. – Vol. 52, № 1. – P. 341-343.
127. Comstock G. W. Tuberculosis in twins: a reanalysis of the Prophit study // Am. Rew. Respir. Dis. – 1978. – Vol. 117. – P. 621-624.
128. Cooper A. M., Kipnis A., Turner J. et al. Mice lacking bioactive IL-12 can generate protective, antigen-specific cellular responses to mycobacterial infection only if the IL-12 p40 subunit is present // J. Immun. – 2002. – Vol. 168. – P. 1322-1327.
129. Cooper A. M., Magram J., Ferrante J., Orme I. M. Interleukin 12 (IL-12) Is crucial to the development of protective immunity in mice intravenously infected with Mycobacterium tuberculosis // J. Exp. Med. - 1997. - Vol. 186(1). - P. 39-45.
130. Davies P. D., Brown R. C., Woodhead J. S. Serum concentrations of vitamin D metabolites in untreated tuberculosis // Throax. – 1985. – Vol. 40. – P. 187-190.
131. Denis M. Killing of Mycobacterium tuberculosis within human monocytes: activation by cytokines and cacitriol // Clin. Exp. Immunol. – 1991. – Vol. 84. – P. 200-206.
132. Dorman S. E., Holland S. M. Interferon-γ and interleukin-12 pathway defects and human disease // Cytokine Growth Factor Rev. - 2000. - Vol. 11. - P. 321-333.
133. Edwards J. H. Familial predisposition in man // Brit. Med. Bull. – 1969. – V. 25. – P. 58-64.
134. Falconer D. S. The inheritance of liability to certain diseases, estimated from the incidence among relatives // Ann. Hum. Genet. – 1965. – V. 29. – P. 51-76.
135. Fine P. E. M. Immunogenetics of susceptibility to leprosy, tuberculosis and leishmaniasis: An epidemiological perspective // Int. J. Leprosy. – 1981. – Vol. 49. – P. 437-454.
136. Flynn J. L., Goldstein M. M., Triebold K. J. et al. IL-12 increasis resistance of BALB/c mice to mucobacterium tuberculosis infection // J. Immunol. – 1995. – Vol. 155. – P. 2515-2524.
137. Flynn J. L., Chan J., Triebold K. J. et al. An essential role for interferon gamma in resistance to mucobacterium tuberculosis infection // J. Exp. Med. – 1993. – Vol. 178. – P. 2249-2254.
138. Forget A., Skamene B., Gros P. et al. Differences in response among inbred strains of mtce to infection with small doses of mycobacterium bovis (BCG) // Infect. Immun. – 1981. – Vol. 32. – P. 42-50.
139. Gao P. S., Fujishima S., Mao X.-Q. et al. Genetic variants of NRAMP1 and active tuberculosis in Japanese populations // Clin. Genet. - 2000. – Vol. 58. – P. 74-76.
140. Giovine F. S., Takhsh E., Blakemore A. I. F., Duff G. W. Single base polymorphism at-511 in the human interleykin-1β gene // Hum. Mol. Genet. – 1993. – Vol. 1. – P. 450.
141. Golli V., Ghitulescu I., Ionescu N. et al. Clinical and epidemiological significance of isolated culture Koch bacillus after conclusion of chemotherapy // Pneumoftiziol. – 1981. – Vol. 30, №1. – Р. 55-58.
142. Govoni G., Gros P. Macrophage NRAMP1 and its role in resistanse to microbial infections // Inflam. Res. – 1998. – Vol. 47, №7. – P. 277-284.
143. Govoni G., Vidal S., Gauthier S. et al. The Bcg/Ity/Lsh Locus: genetic transfer of resistance to infections in C57BL/6J mice transgenic for the Nramp1Gly169 allele // Infect. Immun. – 1996. – Vol. 64. – P. 2923-2929.
144. Greenwood C. M. T., Fujiwara T. M., Boothroyd L. J. et al. Linkage of tuberculosis to chromosome 2q35 loci, including NRAMP1, large aboriginal canadian family // Am. J. Hum. Genet. – 2000. – Vol. 67. – P. 405-416.
145. Griffin M. D., Xing N., Kumar R. Vitamin D and its analogs as regulators of immune activation and antigen presentation // Annu. Rev. Nutr. – 2003. – Vol. 23. – P. 117-145.
146. Gros P., Skamene E., Forget A. Genetic control of natural resistance to Mycobacterium bovis (BCG) in mice // J. Immunol. – 1981. – Vol. 127, №6. – P. 2417-2421.
147. Gruenheid S., Gros P. Genetics susceptibility to intracellular infections: Nramp1, macrofage function and divalent cations transport // Curr. Opin. Microbiol. – 2000. – Vol. 3. – P. 43-48.
148. Gruenheid S., Pinner E., Desjardins M., Gros P. Natural resistance to infection with intracellular pathogens: the Nramp1 protein is recruited to the membrane of the phagosome // J. Exp. Med. – 1997. – Vol. 185. – P. 717-730.
149. Hall M. A., McGlinn E., Coakley G. et al. Genetic polymorphism of IL-12 p40 gene in immunemediated disease // Genes and Immunity. – 2000. – Vol. 1. – P. 219-224.
150. Hara H., Matsushima T., Soejima R. et al. A tuberculosis epidemic. An outbreak of cases in a furniture company // Kekkaku. - 1982. – Vol. 57, №9. – P. 491-496.
151. Hill A. V. S. Genetics and genomics of infectious disease susceptibility // Brit. Med. Bull. – 1999. – Vol. 55, №2. – P. 401-413.
152. Hill A. V. S. The immunogenetics of human infectious disease // Annu. Rev. Immunol. – 1998. – Vol. 16. – P. 593-617.
153. Hill W. G. Estimation of linkage disequilibrium in random mating populations // Hereditary. – 1974. – Vol. 33. – P. 229-479.
154. Jabado N., Jankowski A., Dougaparsad S. et al. Natural resistance to intracellular infections: natural resistance-associated macrophage protein 1 (NRAMP1) functions as a pH-dependent manganese transporter at the phagosomal membrane // J. Exp. Med. – 2000. – Vol. 192, № 9. – P. 1237-1247.
155. Jackett P. S., Aber V. R., Lowrie D. B. Virulence of Mycobacterium tuberculosis and susceptibility to peroxidative killing systems // J. Gen. Microbiol. – 1978. – Vol. 107(2). – P. 273-278.
156. Kallman F. J., Reisner D. Twin studies on the significance of genetic factors in tuberculosis // Am. Rev. Tuberc. – 1942. – Vol. 47. – P. 549-574.
157. Kameda K., Kuchii N., Horii F. et al. A study on the family contacts examination of tuberculosis patients // Kekkaku. – 1983. – Vol. 58, №1. – P. 33-37.
158. Kindler V., Sppino A. P., Grau G. E. et al. The inducing role of tumor necrosis factor in the daveloptment of bactericidal granulomas during BCG infection // Cell. – 1989. – Vol. 56. – P. 731-740.
159. Knight J. C., Kwiatkowski D. Inherited variability of tumor necrosis factor production and susceptibility to infectious disease // Proc. Assoc. Am. Physicians. – 1999. – Vol. 111. – № 4. – P. 290-298.
160. Kramnik I., Dietrich W. F., Demant P., Bloom B. R. Genetic control of resistance to experimental infection with virulent Mycobacterium tuberculosis // Proc. Natl. Acad. Sci. USA. – 2000. – Vol. 97(15). – P. 8560-8565.
161. Labuda M., Ross M. V., Fujiwara T. M. et al. Two hereditary defects related to vitamin D metabolism map to the same region of human chromosome 12q.II // Cytogenet. Cell Genet. – 1991. - Vol. 58. – P. 1978.
162. Lahiri D. K., Bye S., Nunberg J. I. et al. Anon-organic and non-enzymatic eztraction method gives higher yields of genomic DNA from whole-blood samples than do nine other methods used // J. Biochem. Biophys. Methods. – 1992. – Vol. 25. – P. 193-205.
163. Liu J., Fujiwara T. M., Buu N. T. et al. Identification of polymorphisms and sequence variants in the human homologue of the mouse natural resistance – associated macrophage protein gene // Am. J. Hum. Genet. – 1995. – Vol. 56. – P. 845-853.
164. Liu W., Cao W. C., Zhang C. Y. et al. VDR and NRAMP1 gene polymorphisms in susceptibility to pulmonary tuberculosis among the Chinese Han population: a case-control study // Int. J. Tuberc. Lung Dis. – 2004. – Vol. 8(4). – P. 428-434.
165. Lurie M. B., Zappasodi P., Dannenberg A. M., Weiss G. H. On the mechanism of genetic resistance to tuberculosis and its mode of inheritance // Am. J. Hum. Genet. – 1952. – Vol. 4. – P. 302-314.
166. Lynch C. J., Pierce-Chase C. H., Dubos R. A genetic study of susceptibility to experimental tuberculosis in mice infected with mammalian tubercle bacilli // J. Exp. Med. – 1965. – Vol. 121. – P. 1051-1070.
167. Malo D., Vogan K., Vidal S. et al. Haplotype mapping and sequence analysis of the mouse Nramp gene predict susceptibility to infection with intracellular parasites // Genomics. – 1994. – Vol. 23. – P. 51-61.
168. Marquet S., Lepage P., Hudson T. J. et al. Complete nucleotide sequence and genomic structure of the human NRAMP1 gene region on chromosome region 2q35 // Mamm. Genome. – 2000. – Vol. 11. – P. 755-762.
169. Mohan V. P., Scanga C. A., Yu K. Effects of Tumor Necrosis Factor alpha on host immune respons in chronic persistent tuberculosis: possible role for limiting Pathology // Infect. Immun. – 2001. - № 3. – P. 1847-1855.
170. Myrvik Q., Leake E. Wright M. Disruption of fhagosomal membranes of normal alveolar macrophages by the H37Rv strain of M. tuberculosis. A correlate of virulence // Am. Rev. Resp. Dis.— 1984. — Vol.129. – P.322-328.
171. Nei M. Molecular population genetics and evolution. – New York, Amsterdam: North-Holland publishing companu, Oxford American Elsevier publishing company, 1975. – 288 p.р.
172. Nelson N. Metal ion transporters and homeostasis // EMBO J. – 1999. – Vol. 18. – P. 4361-4371.
173. Nicklin M. J. H., Weith A., Duff G. W. A physical map of the region encompassing the human interleykin-1-alpha, interleykin-1-beta, and interleykin-1 receptor antagonist genes // Genomics. – 1994. – Vol. 19. – P. 382-384.
174. Noben-Trauth N., Schweitzer P. A., Johnson K. R. et al. The interleukin-12 beta subunit (p40) maps to mouse chromosome 11 // Mamm. Genome. – 1996. – Vol. 7. – P 392.
175. North R. J., Medina E. How important is Nramp1 in tuberculosis? // Trends Microbiol. – 1998. – Vol. 6, №11. – P. 441-443.
176. Oppmann B., Lesley R., Blom B. et al. Novel p19 protein engages IL-12p40 to form a cytokine, IL-23, with biological activites similar as distinct from IL-12 // Immunity. – 2000. – Vol. 13. - P. 715-725.
177. Orme I. M., Cooper A. M. Cytokine / chemokine cascades in immunity to tuberculosis // Immunol. Today. – 1999. – Vol. 20. – P. 307-311.
178. Ottenhoff T. H. M., Verreck F. A. W., Lichtenauer-Kaligis E. G. R. et al. Genetics, cytokines and human infectious disease: lessons from weakly pathogenic mycobacteria and salmonellae // Nature Genetics. – 2002. - Vol. 32. – P. 97-104.
179. Patterson D., Jones C., Hart I. et al. The human interleukin-1 receptor antagonist (IL1RN) gene is located in the chromosome 2q14 region // Genomics. – 1993. – Vol. 15. – P. 173-176.
180. Pearce N. What does the odds ratio estimate in a case-control study? // Int. J. Epidemiol. – 1993. – Vol. 26 № 6. – P. 1189-1192.
181. Pоciot F., Molving J., Wogensen L. et al. A TaqI polymorphism in the human interleykin-1 beta (IL-1 beta) gene correlates with IL-1 beta sacretion in vitro // Eur. J. Clin. Invest. – 1992. – Vol. 22. – P. 396-402.
182. Rigby W. F. The immunobiology of vitamin D // Immunol. Today. – 1988. – Vol. 9. – P. 54-58.
183. Rook G. Role of activated macrophages in the immunopathology of tuberculosis // Brit. Med. Bull.— 1988.— Vol.44, №3.— P.611—623.
184. Rook G., Steele J., Fraher L. et al. Vitamin D3, gamma interferon, and control of mucobacterium tuberculosis by human monocytes // Immunology. – 1986. – Vol. 57. – P. 159-163.
185. Roth D. E., Soto G., Arenas F. et al. Association between vitamin D receptor gene polymorphisms and response to treatment of pulmonary tuberculosis // J. Infect. Dis. – 2004. – Vol. 190(5). – P.920-927.
186. Ryu S., Park Y. K., Bai G. H. et al. 3’UTR polymorphisms in the NRAMP1 gene are associated with susceptibility to tuberculosis in Koreans // Int. J. Tuberc. Lung Dis. – 2000. – Vol. 4, № 6. – P. 577-580.
187. Schlesinger L. S. Entry of Mycobacterium tuberculosis into mononuclear phagocytes // Curr. Top. Mycrobiol. Immunol. – 1996. – Vol. 215. – P. 71-96.
188. Schlesinger L. S. Role of mononuclear phagocytes in M. tuberculosis pathogenesis // J. Invest. Med. – 1996. – Vol. 44. – P. 312-323.
189. Selvaraj P., Kurian S. M., Uma H. et al. Influence of non-MHC genes on lymphocyte response to Mycobacterium tuberculosis antigens and tuberculin reactive status in pulmonary tuberculosis // Indian J. Med. Res. – 2000. – Vol. 112. – P. 86-92.
190. Servaraj P., Narayanan P. R., Reetha A. M. Association of vitamin D receptor genotypes with the susceptibility to pulmonary tuberculosis in femele patients and resistance contacts // Indian J. Med. Res. – 2000. – Vol. 111. – P. 172-179.
191. Sevaraj P., Narayanan P. R., Reetha A. M. Association of functional mutant homozygotes of the mannose binding protein gene with susceptibility to pulmonary tuberculosis in India // Tuberc. Lung. Dis. – 1999. – Vol. 79. – P. 221-227.
192. Sieburth D., Fabs E. W., Warrington J. A. et al. Assignment of NKSF/IL-12, a unique cytokine composed of two unrelated subunits, to chromosomes 3 and 5 // Genomics. – 1992. – Vol. 14. – P. 59-62.
193. Skamene E., Kongshavn P. A. L., Landy M. Genetic control of natural resistance to infection and malignancy – New York: Academic Press.,1980. – 280 p.р.
194. Skamene E. The Bcg gene story // Immunobiology. – 1994. – Vol. 191. – P. 451-460.
195. Soborg C., Andersen A. B., Madsen H. O. et al. Natural resistance-associated macrophage protein 1 are associated with microscopy-positive tuberculosis // J. Infect. Dis. – 2002. – Vol. 186 - № 4. – P. 517-521.
196. Spielman R. S., McGinnis R. E., Ewens W. J. Transmission test for linkage disequilibrium: the insulin gene region and insulin-dependent diabetes mellitus (IDDM) // Am. J. Hum. Genet. – 1993. – Vol. 52. – P. 506-516.
197. Spielman R. S., Ewens W. J. The TDT and other family-based tests for linkage disequilibrium and association // Am. J. Hum. Genet. – 1996. – V. 59. – P. 983-989.
198. Stead W. W. Genetics and resistance to tuberculosis: could resistance be enhanced by genetics engineering? // Ann. Int. Med. – 1992. – Vol. 116. – P. 937-941.
199. Stead W. W., Senner J. W., Reddick W. T., Lofgren J. P. Racial differences in susceptibility to infection by Mycobacterium tuberculosis // N. Engl. J. Med. – 1990. – Vol. 322. – P.422-427.
200. Tarlow J. K., Blakemore I. F., Lennard A. et al. Polymorphism in human IL-1 receptor antagonist gene intron 2 is caused by variable numer of an 860-bp tandem repeat // Hum. Genet. – 1993. – Vol. 91. – P. 403-404.
201. Uitterlinden A. G., Fang Y., Meurs J. B. et al. Genetics and biology of vitamin D receptor polymorphisms // Gene. – 2004. – Vol. 338(2). – P. 143-156.
202. Vidal S. M., Malo D., Vogan K. et al. Natural resistance to infection with intracellular parasites: isolation of a candidate for Bcg // Cell. – 1993. – Vol. 73, №3. – P. 469-485.
203. Walker L., Lowrie D. B. Killing of Mycobacterium microti by immunologically activated macrophages // Nature. – 1981. – Vol. 293. – P. 69-71.
204. Warrington J. A., Bailey S. K., Armstrong E. et al. A radiation hybrid map of 18 growth factor, growth factor receptor, hormone receptor, or neurotransmitter receptor genes on the distal region of the long arm of chromosome 5 // Genomics. – 1992. – Vol. 13. – P. 803-808.
205. Warrington J. A., Bengtsson U. High-resolution physical mapping of human 5q31-q33 using three methods: radiation hybrid mapping, interphase fiuorescence in situ hybridization, and pulsed-field gel electrophoresis // Genomics. – 1994. – Vol. 24. – P. 395-398.
206. Wilkinson R. J., Lieweiyn M., Toossi Z. et al. Influence of vitamin D deficiency and vitamin D receptor polymorphisms on tuberculosis among Gujarati Asians in west London: a case-control study // Lancet. – 2000. – Vol. 355. – P. 618-621.
207. Wilkinson R. J., Patel P., Llewelyn M. et al. Influence of Polymorphism in the Genes for the Interleukin (IL)-1 Receptor Antagonist and IL-1β on Tuberculosis // J. Exp. Med. – 1999. – Vol. 189 (12). – P. 1863-1873.
208. Yang Y. S., Kim S. J., Kim J. W., Koh E. M. NRAMP1 gene polymorphisms in patients with rheumatoid arthritis in Koreans // J. Korean Med. Sci. – 2000. - № 15. – P. 83-87.
209. Zaahl M. G., Robson K. J. H., Warnich L. et al. Expression of SLC11A1 (NRAMP1) 5’-(GT)n repeat: Opposite effect in the presence of - 237C → T // Blood Cells, Molecules, and Diseases. – 2004. – Vol. 33. – P. 45-50.
Похожие работы
... препаратов. Установлена связь полиморфизма 313A>G гена GSTP1 с изменчивостью уровня аланинаминотрансферазы (р=0,021). 7. Выявлены различия в структуре генетической подверженности к бронхиальной астме и туберкулезу по генам ферментативной системы метаболизма ксенобиотиков: гены GSTM1, CYP2E1 и CYP2C19 связаны с бронхиальной астмой и значимыми для заболевания качественными и ...
0 комментариев