Навигация
Обзор литературы
1. Обзор литературы
1.1 Роль наследственных факторов в возникновении и развитии туберкулеза
Туберкулез известен с глубокой древности. Об этом свидетельствуют многочисленные литературные данные и исторические факты. Научные материалы палеонтологов указывают на древний возраст микобактериальной инфекции. На костях древнеегипетских мумий эпохи бронзы удалось обнаружить несколько бесспорных туберкулезных поражений. Большая заслуга в этом принадлежит английскому исследователю Арманду Рафферу (1921) [Холмовская М.Б., 1997].
Некоторые признаки легочной чахотки описаны в египетских папирусах, а так же в произведениях древнейших китайских ученых и в священных книгах индусов [Хоменко А.Г., 1990]. Уже в те времена исследователи пытались объяснить вопрос, который интересовал многих. Почему некоторые люди более подвержены туберкулезу, чем другие?
Решалась эта проблема различными учеными по-разному, в зависимости от уровня знаний в тот или иной период человеческой истории. Гиппократ, а так же его современники считали туберкулез наследственной болезнью: "Некоторые – более устойчивы в болезнях, другие совершенно не способны им противостоять. Как от родителей эпилептиков рождаются дети-эпилептики, так от чахоточных рождаются дети предрасположенные к чахотке" [Цит. по Рабухин А.Е., 1959].
Однако уже в те времена высказывалась мысль о заразности легочной чахотки. Так в Персии, по свидетельству Геродонта, обычно изолировали не только "прокаженных, но и чахоточных и золотушных" больных, запрещали им оставаться в городах и поддерживать какую-либо связь с окружающим населением [Рабухин А.Е., 1948].
С открытием возбудителя туберкулеза роль наследственности при этом заболевании фактически перестала признаваться. В течение длительного времени во фтизиатрии основное внимание уделялось изучению возбудителя болезни, патологических изменений и их клинических проявлений.
В настоящее время общепризнанно, что этиологическим фактором туберкулеза являются микобактерии туберкулеза (МБТ). Туберкулез – инфекционное заболевание, которое отличается преимущественно хроническим течением различных клинических форм, своеобразием специфических иммунологических и морфологических проявлений. Однако проникновение в организм возбудителя туберкулеза является необходимым, но недостаточным условием для развития болезни. В патогенезе туберкулеза немаловажную роль играют так называемые способствующие факторы. К таким факторам относят некоторые свойства макроорганизма (пол, возраст, сопутствующие заболевания, общая реактивность организма и т.д.), вирулентность микобактерии туберкулеза и массивность инфицирования, а также воздействие внешней среды (неблагоприятная микросоциальная среда, социально-гигиенические факторы и низкий экономический уровень жизни), при котором происходит инфицирование. Иногда роль сопутствующих факторов в этиологии туберкулеза выступает на первое место [Давыдовский И.В., 1962].
Несомненно, что семейное накопление туберкулеза обусловлено общностью внешнесредовых факторов, воздействующих на каждого члена семьи. Но даже в условиях тесного семейного контакта с бактериовыделителем не все члены семьи заболевают туберкулезом. Если проследить историю взаимодействия человеческой популяции с возбудителями инфекционных болезней, то можно заметить, что эпидемии особо опасных заболеваний не заканчивались полным вымиранием. Выживали индивиды - возможно, носители определенных генетических систем, имеющих отношение к сопротивляемости соответствующим инфекциям [Хоменко А.Г., 1990].
Туберкулез отличается клиническим полиморфизмом, что проявляется различными формами заболевания – от малых с бессимптомным течением до обширных деструктивных процессов в легких с выраженной клинической картиной, а также наличием туберкулезного процесса различной локализации в других органах [Пузик В.И. и др., 1973]. По-видимому, причины такого разнообразия проявлений туберкулеза могут определяться не только неблагоприятным сочетанием внешних факторов, но и внутренними, наследственными причинами.
Степень влияния наследственных факторов на возникновение и течение болезни при разной патологии неодинакова. В одних случаях генетически могут быть детерминированы несовместимые с жизнью дефекты, в других – речь может идти об одном из многих компонентов патогенеза заболевания.
Чувствительность к туберкулезу у разных видов животных существенно варьирует: от врожденной резистентности крыс, до крайней подверженности у морских свинок. Кроме того, существуют внутривидовые отличия в подверженности к данному заболеванию [Гамалея Н.Ф., 1939; Авербах М.М. и др., 1980; Сабадаш Е.В. и др., 2002].
Аналогичным образом человеческая популяция проявляет врожденную относительную резистентность к туберкулезу [Апт А.С. и др., 1982; Авербах М.М. и др., 1982; Мороз А.М., 1984]. Благодаря этому заболевает лишь малая часть инфицированных МБТ, в то время как по данным ВОЗ инфицируется практически каждый третий житель планеты. Подобная избирательность свидетельствует о том, что не все члены популяции в равной степени подвержены туберкулезу.
Исследуя группу больных туберкулезом методом изучения их родословных, В. Г. Штефко (1930) провел параллели между конституциональными признаками и заболеванием. Так же он установил различное течение болезни у лиц разной национальности. Полученные данные позволили предположить существование наследственной предрасположенности к туберкулезу.
Выявление при профилактических флюрографических обследованиях рентгенположительных лиц с зажившими элементами перенесенной первичной инфекции, у которых наступило спонтанное излечение, также свидетельствует о том, что не все люди в равной степени подвержены заболеванию туберкулезом в условиях заражения микобактериями туберкулеза.
Б. А. Березовский и соавт. (1986) провели анализ частоты болезни среди родственников больных туберкулезом, не находившихся в контакте с последними, а также в контрольной группе здоровых лиц. Полученные результаты выявили достоверные различия в сравниваемых группах, при этом частота туберкулеза среди родителей и сибсов пробанда более чем в 5 раз превышала таковую в популяции. На основании этих данных было сделано предположение, что наряду с известными, достаточно изученными причинами возникновения туберкулеза легких определенное значение в его развитии имеют генетические факторы.
Анализ 33 больных рецидивирующим туберкулезом с бактериовыделением после завершенной химиотерапии показал, что из 25 лиц находившихся с этими больными в контакте, 5 остались неинфицированными. В тоже время среди остальных туберкулинположительных лиц из контакта не отмечено случаев заболевания туберкулезом [Golli V. et al., 1981].
Сходные результаты получили и другие авторы, наблюдавшие за лицами из семейного контакта с 458 больными туберкулезом в течение 4 лет после выявления источника инфекции. Всего за 4 года было выявлено, что среди 1250 лиц из семейного контакта заболели лишь 48 из них преимущественно на 1-ом и 2-ом году наблюдения [Kameda K. et al., 1983].
H. Hara и соавторы (1982) приводят данные о том, что из 28 человек, находящихся в контакте с бациллярными больными, лишь у 6 на протяжении 2,5 лет был установлен туберкулез.
Под руководством академика РАМН А. Г. Хоменко было осуществлено комплексное генетико-эпидемиологическое исследование, в котором принимали участие 522 многодетные семьи узбекской, туркменской, молдавской этнических групп. Задача данного исследования сводилась к определению коэффициента наследуемости (подверженности, предрасположенности). Для этого обследовали более 5000 родственников первой и второй степени родства по отношению к пробандам, которые страдали туберкулезом легких.
Результаты исследования установили семейное накопление туберкулеза среди различных групп родственников разной степени родства. При этом в семьях пробандов, которые болели деструктивным туберкулезом легких и являлись бактериовыделителями, частота туберкулеза среди родственников первой степени родства значительно превышала частоту заболевания среди населения не только при наличии семейного контакта (в 7,2 раза), но и при отсутствии тесного семейного контакта (в 5 раз). Кроме того, аналогичным образом во всех обследованных этнических группах в семьях родственников первой степени родства, где пробанды болели недеструктивными формами туберкулеза без бактериовыделения, частота туберкулеза легких в 4,3 раза превышала частоту заболевания среди населения сопоставимого возраста [Чуканова В. П. и др., 2001].
У родственников второй степени родства (племянников пробандов), которые не состояли в семейном контакте с пробандами, установлено, что частота туберкулеза среди них превышала частоту заболевания среди населения соответствующего возраста в 2-2,5 раза. Учитывая более отдаленную степень родства, увеличение частоты заболевания в этой группе родственников в большей мере подчеркивает значение генетических факторов в семейном накоплении заболевания. Выявленные закономерности распространения туберкулеза позволяют считать, что среди кровных родственников больных туберкулезом легких риск развития болезни значительно выше, чем среди всего населения.
Особый способ клинико-генеалогического изучения предрасположен-ности к болезням – изучение заболеваемости индивидов, генетически не родственных с больным туберкулезом (супруги пробандов, приемные дети), но связанных с ним общностью семейных средовых влияний. Анализ распространенности туберкулеза среди супругов пробандов, не состоящих в кровном родстве с больными туберкулезом, но находившихся с ними в семейном контакте, установил, что частота туберкулеза легких в этой группе достоверно не отличалась от частоты заболевания среди населения обследованных этнических групп [Чуканова В. П. и др., 1995].
На основании проведенных популяционных исследований были выявлены этнические особенности в патогенезе и клиническом течении туберкулеза [Хаудамова Г.Т., 1991; Хоменко А.Г., 1996; Stead W.W., 1992; Bellamy R., 1998]. Анализ заболеваемости туберкулезом органов дыхания основных этнических групп Казахстана (казахов и русских) выявил повышенный риск (в 3 раза) заболевания коренного населения [Хауадамова Г.Т., 1991].
Вероятно, большая часть такой этнически зависимой предрасположенности обусловлена факторами внешней среды, то есть определенными традициями данной популяции, экономическими причинами и т. д. Однако имеются данные о том, что более подвержены туберкулезу популяции, происходящие с территорий свободных от этого заболевания [Bellamy R., 1998; Stead W.W., 1992]. Данное положение легко объяснимо с точки зрения естественного отбора. Резистентность к туберкулезной инфекции создавалась и поддерживалась в процессе симбионтных отношений макро- и микроорганизмов [Земскова З.С., Дорожкова И.Р., 1984].
С целью разделения генетических и средовых эффектов и оценки их соотносительного вклада в этиологию и патогенез туберкулеза были предприняты близнецовые исследования [Kallman F., Reisner D., 1943; Comstock G.W., 1978; Fine P.E.M., 1981]. Эти работы показали, что заболеваемость туберкулезом монозиготных близнецов в среднем в 3,5 раза выше, чем дизиготных.
Полученные в ходе близнецовых исследований факты свидетельствовали о генетической подоплеке туберкулеза, однако, не предоставили данных о типе наследования заболевания. Генетический анализ восприимчивости и резистентности к туберкулезу, проведенный на лабораторных животных, показал, что наследование этих признаков носит сложный, полигенный характер [Lurie M.B. et al., 1952; Lynch C.J. et al., 1965].
На основании экспериментальных исследований была выдвинута гипотеза мультифакториального типа наследования предрасположенности к туберкулезу легких [Мороз А. М., Торонджадзе В. Г., 1977]. Позднее Б. А. Березовский и соавт. (1986) сравнили имеющиеся сведения по генетике туберкулеза с критериями мультифакториального наследования, предложенными J.H. Edwards (1969). Полученные в ходе сравнения результаты подтвердили высказанную ранее гипотезу.
С генетической точки зрения, мультифакториальные заболевания представляют результат сложного взаимодействия большого числа генов с разнообразными факторами окружающей среды. В отличие от менделирующей патологии, в основе которой лежат редко встречаемые "главные гены", но со значительными эффектами, при мультифакториальных болезнях генетическая система полигенов представлена огромным числом аллельных вариантов генов, эффекты которых в отдельности незначительны. Однако их совокупное действие формирует неблагоприятный "генетический фон", который под влиянием дополнительных факторов реализуется в патологический фенотип [Пузырев В. П., 2003].
Современные представления о генетической составляющей мультифакториальных заболеваний во многом связаны с концепцией подверженности и порогового проявления мультифакториального фенотипа [Falconer D., 1965; Edwards J.H., 1969]. Согласно этой концепции, подверженность к заболеванию наследственно обусловлена, но реализация ее возможна только при взаимодействии с факторами среды. Патологический фенотип проявляется при пересечении некоего "порога" подверженности, описываемого количественными признаками. Порог подразумевает наличие резкого качественного различия: за этим порогом на шкале подверженности располагаются пораженные индивиды [Фогель Ф., Мотульски А., 1989].
Развитие молекулярно-генетических технологий позволило решить проблему идентификации конкретных генетических систем, ответственных за предрасположенность к мультифакториальным заболеваниям. Картирование генов осуществляется в рамках двух стратегий: генов-кандидатов и позиционного клонирования [Пузырев В.П., Степанов В.А., 1997].
Ген определяется как кандидатный, если продукт его экспресии вовлечен в развитие болезни. Анализ ассоциации полиморфизма генов-кандидатов с изучаемой болезнью или патологическими признаками позволяет установить их патогенетическую роль и, таким образом, "картировать" ген заболевания. При позиционном клонировании определение генов подверженности проводится путем анализа сцепления заболевания и маркерами с установленным положением на хромосоме. Это дает возможность картировать болезни, для которых не известны не только гены-кандидаты, но даже детали развития болезни.
Идентификация генов и их аллелей, от экспресии которых зависит чувствительность или резистентность к туберкулезу позволила бы глубоко проникнуть в фундаментальные механизмы иммунитета и патологии этой инфекции. В результате появилась бы возможность использовать методы генетического типирования для выявления среди здоровых людей групп с генетически повышенным риском заболевания, требующих первоочередных мер профилактики и, вероятно, особого подхода к вакцинации [Кобринский Б.А., 1987].
Сложность патогенеза, а так же различия в клиническом проявлении туберкулеза предполагают, что число генов-кандидатов заболевания достаточно велико (табл. 1). При этом вклад каждого из них в суммарную подверженность различен [Hill A.V.S., 1998]. Дело еще более осложняется действием факторов внешней среды, значительно модифицирующих положение порога подверженности туберкулезу. Кроме того, большое значение для определения генов сложнонаследуемых заболеваний имеет также выбор популяции для исследования. Индивидуальные сочетания аллелей генов предрасположенности, формирующие риск заболевания, являются уникальными для каждой популяции, что может быть одной из причин невоспроизводимости в разных выборках результатов анализа сцепления болезни с маркером [Terwilliger J.D. et al., 1997].
Таким образом, само по себе картирование генов туберкулеза еще не исчерпывает все проблемы генетики данной патологии. Следующим за картированием шагом, по-видимому, является изучение совместного действия комплекса генов предрасположенности, выявление его основных функциональных звеньев, установление особенностей взаимодействия с факторами негенетической природы – вот задачи, которые необходимо решить для понимания механизмов нормальной и патологической реализации генетической информации.
Таблица 1 Гены-кандидаты подверженности туберкулезу
| Ген | Хромосомная локализация (MIM) | Название белкового продукта | Функция белка |
| NRAMP1 | 2q35 (600266) | Макрофагальный протеин 1, ассоциированный с естественной резистентностью | Транспорт двухвалентных ионов металлов, киллинг внутриклеточно расположенных МБТ |
| VDR | 12q12-q14 (601769) | Рецептор к витамину D | Связывание с витамином D, активация клеточного иммунитета |
| IL1А, IL1В | 2q14(147760) 2q14(147720) | Интерлейкин 1a Интерлейкин 1b | Активация клеточного иммунного ответа |
| IL12В | 5q31.1-q33.1 (161561) | Интерлейкин 12 b | Индукция синтеза IFN-g |
| IFNG | 12q14 (147570) | Интерферон g | Активация Т-лимфоцитов, макрофагов |
| TNFА | 12р13.2 (191190) | Фактор некроза опухолей a | Индукция формирования гранулемы |
| NOS2 | 17р13.1-q25 (600719) | Индуцибельная синтаза оксида азота | Цитотоксическое действие |
| MBP | 10q11.2-q21 (154545) | Маннозо-связывающий белок | Активация системы комплемента |
| HLA | 6p21.3 (142860) | Главный комплекс гистосовместимости | Регуляция силы иммунного ответа |
| IL1RN | 2q14.2 (147679) | Антагонист рецептора к интерлейкину-1 | Угнетение провоспалительного эффекта |
| IL12R | 19p113.1 (601604) | Рецептор к интерлейкину 12 | Связывание интерлейкина 12 на поверхности клеток-мишеней |
Важную роль в противотуберкулезной защите играет, секретируемый макрофагами и моноцитами цитокин – фактор некроза опухолей (TNFa). Он принимает участие в индукции формирования гранулемы, а так же способствует активации Т-клеток, тем самым повышая антибактериальную активность макроорганизма [Kindler V. et al., 1989; Mohan V. P. et al., 2001]. На модели мышей с "нокаутированным" геном, кодирующим рецептор для TNFa, продемонстрировано существенное значение фактора некроза опухолей для выживания в условиях туберкулезной инфекции [Flynn J. L. et al., 1995]. В настоящее время известно несколько мутаций гена TNFА, находящегося в локусе главного комплекса гистосовместимости, однако их связь с туберкулезом не выявлена. Так, в небольшом исследовании, проводившемся в Гамбии, не обнаружили ассоциации полиморфизма 308G/A гена TNFА с клинически подтвержденным туберкулезом. Такой же результат был получен при поиске взаимосвязи полиморфизма гена TNFА c туберкулезом в Бразилии [Knight J. C., Kwiatkowski D., 1999].
При поиске конкретных генетических систем, отвечающих за развитие восприимчивости или резистентности к туберкулезу, в первую очередь обращалось внимание на главный комплекс гистосовместимости человека – HLA-систему, в которой расположены гены иммунного ответа. При этом продукты данного комплекса – антигены HLA – выступали в качестве биологических маркеров. Результаты анализа ассоциаций аллелей HLA-комплекса с туберкулезом показали связь DR-локуса с заболеванием, к тому же выявили высокую рассовую и этническую специфичность. В русской популяции заболевание ассоциировалось с В5, В14 и В17 антигенами HLA-комплекса [Хоменко А.Г., 1996]. Вероятно, гены комплекса HLA оказывают влияние на восприимчивость к туберкулезу, регулируя силу иммунного ответа и обуславливая этнические различия в подверженности ТБ.
Также была выявлена ассоциативная взаимосвязь ряда генетических маркеров – фенотипов крови с возникновением туберкулеза и с характером уже возникшего заболевания. Анализировали распределение фенотипических и генных частот 9 генетических локусов белков крови: ингибитора протеаз, трансферрина, фосфоглюкомутазы 1, кислой эритроцитарной фосфотазы 1, гаптоглобина, витамин-Д-транспортирующего белка, глиоксалазы 1, комплемента и эстеразы Д. При этом выявили существование различий между больными туберкулезом легких и практически здоровыми людьми. Эти различия выражаются в накоплении у больных туберкулезом одних фенотипов и в уменьшении частот других фенотипов. Следует отметить, что полученный эффект касался в основном одних и тех же 6 белковых локусов, что подтверждает их реальное значение в дифференциации между больными ТБ и здоровыми людьми [Богадельникова И.В., 1999].
С целью картирования генов предрасположенности к туберкулезу группа исследователей провели широкомасштабное сканирование генома с использованием 299 высокоинформативных ДНК – маркеров у 173 пар сибсов, полностью конкордантных по развитию туберкулеза [Bellamy R. et al., 2000]. При этом выявили 2 локуса предрасположенности – на длинных плечах хромосомы 15 и Х [Cervino A.C.L. et al., 2002].
На основании экспериментальных исследований, проведенных А.М. Морозом и В.Г. Торонджадзе (1977), были выявлены две линии мышей, оппозитные по своей чувствительности к туберкулезной инфекции. У резистентных линий после внутривенного заражения микобактериями туберкулеза наблюдаются длительный латентный период и медленное развитие инфекционного процесса, выражающееся в персистенции микобактерий на фоне незначительных гранулематозно измененных тканей, не приводящих к гибели животных. В то же время заражение мышей чувствительной линии приводит к быстрому размножению микобактерий в тканях, образованию гранулем в легких, селезенке, печени и быстрой гибели животных [Авербах М.М. и др., 1980; Мороз А. М., 1984]. На этих линиях исследователи изучили некоторые механизмы естественной резистентности и приобретенного иммунитета и высказали предположение, что устойчивость к инфекциям во многом зависит от способности макрофагов подавлять рост микобактерий в своей цитоплазме. Проведенные позднее эксперименты на 60 мышах двух линий, одна из которых чувствительна, другая устойчива к туберкулезной инфекции, полностью подтвердили данное предположение [Ельшанская М. П. и др., 1985].
Важнейший этап патогенеза туберкулеза - персистенция возбудителя в фагосомах макрофагов. Макрофаги поглощают патоген в очагах воспаления, но часто теряют способность элиминировать его в лизосомах, что в итоге приводит к их массированному внутриклеточному размножению и последующему выходу из погибших клеток. Получены данные, свидетельствующие о том, что имеются существенные различия в судьбе фагосом, содержащих вирулентные и авирулентные микобактерии, поскольку только первые препятствуют их слиянию с лизосомами [Myrvik Q. et al., 1984; Frenkel G. et al., 1986]. С точки зрения развития новых подходов к лечению туберкулеза очевидна необходимость контроля прохождения микобактерий по эндосомально-лизосомальному пути: от ранней эндосомы - к поздней, от поздней эндосомы – к лизосоме. 1.3 Физиологические функции белковых продуктов генов-кандидатов подверженности туберкулезу, их роль в патогенезе заболеванияОдним из генов предрасполагающих к развитию туберкулеза является NRAMP1 (от англ. Natural-Resistance-Associated Macrophage Protein 1 gene – ген макрофагального протеина 1, ассоциированного с естественной резистентностью). Более того, R. Bellamy и соавт. (1998) отнесли NRAMP1 к основным кандидатным генам туберкулеза у человека. Белковый продукт этого гена имеет вес около 60 кД, он локализован в лизосомальном компартменте покоящегося макрофага, но во время фагоцитоза он работает на мембране фагосомы [Gruenheid S. et al., 1997]. Nramp1 участвует в процессах активации макрофагов, являясь ключевым звеном в механизме транспорта нитритов из внутриклеточных компартментов в более кислую среду фаголизосомы, где он способен вступать в химическую реакцию с образованием NO [Blackwell J. M., Searle S., 1999].
Белок входит в семейство функционально связанных мембранных белков (к этому семейству относят также Nramp2), ответственных за транспорт двухвалентных катионов, таких как Fe2+, Mn2+, Zn2+, Cu2+ [Jabado N. et al., 2000; Cellier M. et al., 2001]. Известно, что ионы металлов являются жизненно важными элементами, участвующими во многих метаболических реакциях, происходящих в каждой живой клетке. Следовательно, недостаток, избыток или отсутствие данных элементов может привести к развитию какого-либо патологического состояния или даже к гибели клетки. Постоянство ионов металлов в организме обеспечивается регуляцией их потребления, хранения и выведения. Для того чтобы поддерживалась необходимая концентрация ионов, каждая клетка обладает определенной системой, обеспечивающей транспорт веществ через мембрану. Сбой этой системы или ее части может повлечь за собой потерю равновесия между выведением и поступлением веществ, что приведет к изменению внутриклеточной концентрации ионов. Недостаточный транспорт ионов может оказаться причиной нехватки жизненно важных метаболических элементов, а чрезмерное их накопление может вызвать токсическое воздействие этих же веществ, ведущее к гибели клетки. Возможно, что антибактериальная функция Nramp1 заключается в создании неблагоприятной для бактерии окружающей среды внутри фагосомы [Gruenheid S. et al., 2000; Barton C.H. et al, 1999]. Во время фагоцитоза микроба макрофаг продуцирует активные кислородные метаболиты, которые являются токсичными для бактерии. Выживание патогена во время кислородозависимой перестройки метаболизма фагоцита обеспечивается микробными ферментами, большинство из которых содержат ионы металлов в своих активных центрах [Cellier M. et al., 1994]. В свою очередь истощение запаса ионов металлов в фагосоме, вызванное транспортной деятельностью макрофагального белка ассоциированного с естественной резистентностью, приводит к снижению продукции металлосодержещих ферментов поглощенной бактерией. Следовательно, дефекты продукции или функции Nramp1 могут приводить к нарушению его транспортной функции и, как следствие, к повышению чувствительности к внутриклеточным патогенам, таким как микобактерии (рис. 1) [Barton C.H. et al., 1999].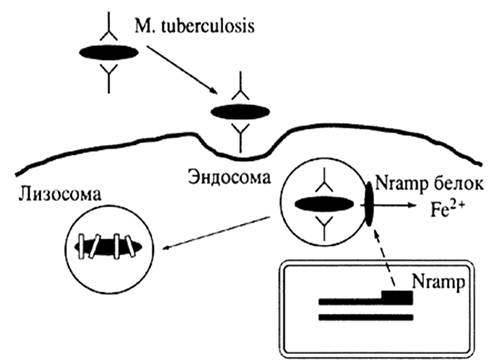
Рис. 1. Схема антибактериального действия NRAMP1 [по Пальцеву М.А., 2002]
Опыты, проведенные на инбредных мышах, показали, что уровень естественной резистентности к внутривенному заражению низкими дозами M. bovis (BCG) контролируется одним геном, локализованным в проксимальном регионе мышиной хромосомы 1. Этот локус обозначили как Bcg (также он известен как Lsh или Ity). Два различных фенотипа Bcg были ассоциированны с чувствительностью (Bcg-s) и с резистентностью (Bcg-r) на ранней стадии инфекции, вызванной M. bovis, M. avium, M. lepraemurium, Leishmania donovani, Salmonella typhimurium [Bredley D.J., 1977; Forget A. et al., 1981].
Экспериментальные исследования показали, что через 3 недели после заражения 10 КОЕ M. bovis (BCG) из селезенки мышей Bcg-s высевается на 3-4 порядка больше микобактерий, чем из селезенки мышей Bcg-r [Gros P. et al., 1981].Результаты исследований на моделях мышей позволили утверждать, что высокая чувствительность линий мышей Bcg/Lsh/Ity к заражению внутриклеточными патогенами объясняется дефектом локализованного на 1-ой хромосоме гена в локусе Bcg [Blackwell S.M. et al., 1994; Skamene E., 1994].
При помощи позиционного клонирования изолировали кандидатный ген и обозначили его как Nramp1 [Vidal S.M. et al., 1993]. Позже было подтверждено, что Nramp1 и ген, расположенный в локусе Bcg, идентичны [Govoni G. et al., 1996]. У лабораторных мышей ген Nramp1 имеет 2 аллеля Nramp1-s (восприимчивый, рецессивный) и Nramp1-r (резистентный, доминантный) [Malo D. et al., 1993].
Секвенирование матричной РНК Nramp1 от восприимчивых и резистентных линий мышей показало, что подверженность к инфекции связана с заменой глицина на аспарагиновую кислоту в позиции 169 (G169D) внутри 4-ого трансмембранного домена белка [Malo D. et al., 1994]. Элиминация функции Nramp1 у "нокаутированных" мышей (Nramp1-/-) приводит к повышению восприимчивости к группе бактериальных возбудителей, хорошо адаптированных к выживанию в макрофаге [Govoni G., Gros P., 1998].
Однако нельзя не учитывать, что в выше перечисленных экспериментах на мышах использовался штамм M. bovis (BCG), а он является авирулентным для человека. Более того, E. Medina и R. North (1998) показали, что в то время как Nramp1 действительно контролирует резистентность мышей к заражению M. bovis, резистентность к заражению M. tuberculosis, вероятно, не связана с мутациями данного локуса. Мыши с мутантным (чувствительным к заражению M. bovis) фенотипом не отличались по чувствительности к заражению M. tuberculosis от мышей с резистентным (дикого типа) фенотипом.
Учитывая полученные результаты, G. Govoni и P. Gros (1998) сделали вывод, что возбудители, не попадающие под контроль Nramp1, либо отличаются своим поведением внутри макрофага, либо не являются внутриклеточными паразитами. Эти данные свидетельствуют, что Nramp1 играет важную роль в резистентности к микобактериям и некоторым другим возбудителям инфекций у мышей, а его человеческий гомолог, вероятно, связан с подобными инфекциями у людей.
Такой человеческий гомолог гена Nramp1, обозначенный как NRAMP1, клонировали и картировали на человеческой хромосоме 2q 35 [Cellier M. et al., 1996]. В данном гене содержится 15 экзонов различной протяженности, разделенных интронами, размер которых также широко варьирует [Marquet S. et al., 2000]. Описано 9 полиморфных вариантов гена NRAMP1, которые, вероятно, влияют на функцию гена [Liu J. et al., 1995].
С целью изучения функции гена было проведено исследование различных полиморфизмов NRAMP1 у западных африканцев в Гамбии всвязи с туберкулезом в местной популяции. Четыре полиморфизма гена - 5`(CA)n, INT4, D543N, 3`UTR были ассоциированы с туберкулезом (р=0,03; р=0,009; р=0,008; р<0,001 соответственно). 5`(CA)n 201 п.о. аллель находился в неравновесии по сцеплению с одним из аллелей полиморфизма INT4 (Р<0,001). Полиморфизм D543N также проявил неравновесие по сцеплению с делецией в 3`UTR регионе гена (р<0,001). Аллельные варианты INT4 и 3`UTR гена NRAMP1 были незначительно связаны друг с другом и статистически значимо ассоциированы с туберкулезом [Bellamy R. et al., 1998]. Таким образом, при изучении связи NRAMP1 с туберкулезом у африканцев было обнаружено, что изменчивость данного гена связана с вариабельностью восприимчивости к туберкулезу.
Аналогичным образом, было проведено изучение различных полиморфных вариантов гена NRAMP1 в корейской популяции. Материалом для исследования послужили образцы крови от 192 пациентов с лабораторно подтвержденным туберкулезом легких. Как показал анализ, в исследуемой этнической группе туберкулез был ассоциирован с полиморфизмом 3`UTR гена NRAMP1 [Ryu S. et al., 2000].
По всей видимости, отличия в модели аллельной ассоциации гена с туберкулезом можно объяснить генетической гетерогенностью разных этнических групп. Так, например, анализ японской популяции показал различия в ассоциации гена с туберкулезом в двух группах пациентов: первая – жители города Токио, вторая – жители города Осака. Была обнаружена слабая зависимость между полиморфизмом D543N и туберкулезом в популяции Токио (р=0,045), и, напротив, имелась существенная связь с полиморфизмом (GT)n гена NRAMP1 в обеих популяциях [Gao P.S. et al., 2000]. К тому же была показана ассоциация полиморфизма D543N гена NRAMP1 с формированием деструкции при туберкулезе [Abe T. et al., 2003]. Для полиморфизмов D543N и 3`UTR найдена ассоциация с туберкулезом (р=0,041, р=0,030 соответственно) в китайской популяции [Liu W. et al., 2004].
Если в упомянутых выше исследованиях материалом послужили образцы крови от не родственных между собой индивидов больных туберкулезом, то в исследовании, проведенном в Гвинее (Конакри) тестировались 44 семьи на предмет ассоциации между NRAMP1 и туберкулезом. Каждая из этих семей содержала как минимум одного сибса больного туберкулезом. Всего было проанализировано 160 образцов крови путем тестирования по трем полиморфизмам: 5`(CA)n, 3`UTR, INT4. Для обработки полученных результатов был применен TDT-тест, при помощи которого обнаружили статистически значимую ассоциацию полиморфизма INT4 гена NRAMP1 с туберкулезом [Cervino A.C.L. et al., 2000].
Недавно был проведен поиск связи этого гена с туберкулезом в России (Башкортостан, Тува). При сравнении частот генотипов в группах больных инфильтративным туберкулезом легких и здоровых индивидов жителей Башкортостана была найдена ассоциация полиморфизма 3`UTR с подверженностью к туберкулезу (χ2 =21,34, OR=6,83) [Имангулова М.М. и др., 2004]. При аналогичном исследовании тувинцев показана связь с туберкулезом для варианта 1465-85G/A гена NRAMP1 (χ2 =6,40, р=0,041) [Рудко А.А., 2004].
Однако несколько исследований предоставили негативные результаты. Так, не было найдено связи полиморфных вариантов гена NRAMP1 с туберкулезом в эндемичной популяции Морокко и Дании [Soborg C. et al., 2002; Baghdadi J. et al., 2003]. Итак, несмотря на некоторую неопределенность в функции полиморфных вариантов гена NRAMP1, его ассоциация с данным заболеванием подтверждена в различных популяционных исследованиях (табл. 2).
Возможность с большой надежностью определять группы высокого риска, используя ДНК-типирование детей, чьи родители больны туберкулезом, для выявления тех, кто унаследует неблагоприятные аллели, была бы очень важна. По мнению R. J. North и E. Medina (1998), основное препятствие для более или менее надежного определения групп риска путем типирования по гену NRAMP1 – относительно слабый вклад этого гена в общую структуру генетически обусловленной восприимчивости и резистентности к туберкулезу.
Таблица 2 Обзор исследований полиморфных вариантов гена NRAMP1 при туберкулезе
| Популяция | Количество пациентов с ТБ | Количество здоровых лиц | Исследованные полиморфизмы | Ассоциации с ТБ | Авторы |
| Гамбия | 410 | 417 | 5’(CA)n, INT4, D543N, 3’UTR | INT4, 3’UTR | Bellamy R. et al., 1998 |
| Корея | 192 | 192 | D543N, 3’UTR | 3’UTR | Ryu S. et al., 2000 |
| Япония | 267 | 202 | (GT)n, INT4, D543N, 3’UTR | D543N, (GT)n | Gao P.S. et al., 2000 |
| Гвинея | 44 семьи | - | 5’(CA)n, INT4, 3’UTR | INT4 | Cervino et al., 2000 |
| Дания | 104 | 176 | 5’(CA)n, INT4, D543N, 3’UTR | - | Soborg C. et al., 2002 |
| Морокко | 116 семей | - | 274С/Т, INT4, 1465-85G/A, D543N, 3’UTR, (GT)n | - | Baghdadi J. et al., 2003 |
| Россия (Башкор-тостан) | 108 | 195 | D543N, 3’UTR | 3’UTR | Имангулова М.М. и др., 2004 |
| Россия (Тува) | 238 | 263 | 274С/Т, INT4, 1465-85G/A, D543N, | 1465-85G/A | Рудко А.А. и др., 2004 |
| Китай | 120 | 240 | INT4, D543N, 3’UTR | D543N, 3’UTR | Liu W. et al., 2004 |
Способность уничтожать внутриклеточных паразитов зависит от стадии активации макрофагов и приобретается ими под действием цитокинов, в частности, под действием гамма интерферона (IFN-g), которые выделяются стимулированными лимфокинпродуцирующими Т-клетками [Ройт А., 1991]. Цитокины представляют собой группу полипептидных медиаторов, участвующих в формировании и регуляции защитных реакций организма. К цитокинам относят интерфероны, колониестимулирующие факторы, интерлейкины, хемокины, трансформирующие ростовые факторы, группа фактора некроза опухолей и некоторые другие. К общим главным свойствам цитокинов, объединяющим их в самостоятельную систему регуляции, относятся: плейотропизм и взаимозаменяемость биологического действия, отсутствие антигенной специфичности действия, саморегуляция продукции и формирование цитокиновой сети. Цитокины в первую очередь регулируют развитие местных защитных реакций в тканях с участием различных типов клеток крови, эндотелия, соединительной ткани и эпителиев. Гиперпродукция цитокинов ведет к развитию системной воспалительной реакции и может служить причиной развития ряда патологических состояний [Симбирцев А.С., 2002].
Мутации генов некоторых цитокинов, играющих важную роль в механизмах иммунологической защиты против микобактерий, а так же мутации генов кодирующих рецепторы к этим интерлейкинам могут играть свою роль в предрасположенности к туберкулезу. Так, генетически измененные мыши ("нокауты"), лишенные гена, кодирующего IFN-g или рецептор к нему, очень чувствительны к заражению микобактериями [Flynn J. et al., 1993]. Описаны также случаи летальной БЦЖ инфекции у детей с врожденным дефектом экспрессии рецепторов к IFN-g [Altare F. еt al., 1998]. Примечательно, что в литературе не встречается описание пациентов с генетическим недостатком IFN-g. Вероятно, такие мутации являются фатальными.
Роль макрофагов в противотуберкулезном иммунитете не ограничивается фагоцитозом. Второй основной функцией клеток макрофагального ряда является презентация переработанных микобактериальных антигенов, что необходимо для запуска последующих иммунологических реакций [Покровский В.И. и др., 1979]. Кроме того, макрофаги участвуют в синтезе важнейших медиаторов иммунного ответа при туберкулезе, таких как интерлейкин-1 (ИЛ-1) и др. [Chensue S. et al., 1986]. ИЛ-1 является ключевым элементом в развитии воспаления, биологический эффект которого опосредуется через специфические клеточные рецепторные комплексы. Регуляция действия данного цитокина осуществляется посредством рецепторного антагониста интерлейкина-1, который конкурентно взаимодействует с рецептором к ИЛ-1 и, таким образом, ингибирует провоспалительный эффект [Tarlow J.K. et al., 1993].
S. Chensue и соавторы (1986) считают, что продукция интерлейкина-1 мононуклеарными клетками периферической крови больных является специфическим индикатором активности процесса, более выраженным, чем показатели СОЭ или С-реактивного белка, и предлагают использовать этот показатель для диагностики активного туберкулеза и контроля за эффективностью лечения больных.
В одной из работ была исследована in vitro способность макрофагов синтезировать интерлейкин-1 в ответ на воздействие синтетического активатора макрофагов мурамилдипептида у больных туберкулезом и здоровых доноров. Обнаружено, что макрофаги больных отличает пониженная способность секретировать этот цитокин [Селедцова Г.В. и др., 1991]. Причем при фиброзно–кавернозной форме туберкулеза наблюдалось более выраженное снижение продукции ИЛ-1, чем при инфильтративном туберкулезе [Хонина Н.А. и др., 2000] В настоящее время многие цитокины, в том числе и интерлейкин-1, применяются в клинической практике в виде лекарственных препаратов. Была изучена эффективность лечения больных туберкулезом с применением в комплексной терапии рекомбинантного ИЛ-1b. Наблюдения показали, что использование препарата беталейкина повышает эффективность лечения по закрытию полостей распада, уменьшению и фрагментации специфических фокусов, степени выраженности остаточных изменений [Скворцова Л.А. и др., 2003].
Возможно, неспособность макрофагов активироваться для продукции ИЛ-1 под влиянием стимула связана с мутацией в гене, кодирующем этот цитокин. Было показано, что ген, кодирующий интерлейкин-1b – IL1B находится на хромосоме 2q14, а недалеко от этого гена на участке 2q14.2 расположен ген рецепторного антагониста ИЛ-1b – IL1RN [Patterson D. et al., 1993; Nicklin M.J.H. et al., 1994]. Известны два биаллельных полиморфизма в гене IL1В в позициях – 511 и +3953 [Giovine F.S. et al., 1993; Pociot F. et al., 1992]. Так же описан VNTR полиморфизм во втором интроне гена IL1RN, обусловленный тандемным повтором участка из 86 п.о. от 2 до 6 раз. Пяти аллелям VNTR полиморфизма в зависимости от частоты встречаемости были присвоены следующие названия: самый частый аллель – А1 (четыре повтора), второй по частоте аллель А2 (два повтора), А3 (пять повторов), А4 (три повтора), А5 (шесть повторов) [Tarlow J.K. et al., 1993].
Анализ полиморфизма кластера генов интерлейкина-1 (IL1A, IL1B, IL1RN) у африканцев показал взаимосвязь IL1A, IL1RN с чувствительностью к туберкулезу. Так, гетерозиготы по аллелю 2 VNTR полиморфизма гена IL1RN статистически значимо реже встречались среди больных туберкулезом, чем в контрольной группе. Однако авторы отмечают отсутствие влияния полиморфизма IL1B на подверженность туберкулезу [Bellamy R., Ruwende C., 1998]. В другом исследовании не было найдено различий в частотах генотипов IL1RN между выборками больных легочным туберкулезом и контрольной [Selvaraj P. et al., 2000].
Wilkinson R.J. и соавторы (1999) не обнаружили различий в частотах генотипов полиморфизма генов IL1B и IL1RN в группах больных туберкулезом и здоровых индивидов. Между тем было показано, что стимулированная in vitro микобактериями туберкулеза секреция IL-1RN у IL-1RNА2+ индивидов выше, чем у IL1RNА2- индивидов. Таким образом, с аллелем 2 (2 повтора) VNTR полиморфизма связано повышение продукции IL1RN. В исследовании было описано влияние полиморфизма +3953А1/А2 IL1B на экспрессию продукта гена. В дополнение к этому авторы обнаружили ассоциацию IL1RNА2-/IL1B(+3953)А1+ гаплотипа с низкой экспрессией IL1RN и повышенным уровнем IL-1b, что проявляется в провоспалительном фенотипе [Wilkinson R.J. et al., 1999].
Ген, кодирующий интерлейкин-12β (IL12В) также можно рассматривать в качестве кандидата при развитии туберкулезной инфекции, так как продукт данного гена играет ключевую роль в клеточном иммунном ответе [Тотолян А.А., Фрейдлин И.С., 2000]. Brightbill H. D. и соавторы (1999) продемонстрировали, что бактериальные лиганды (липопротеины) стимулируют выработку IL-12 макрофагами человека посредством активации Toll-like рецепторов на поверхности макрофага. Интерлейкин -12 связывается с b1 и b2 комплексом рецептора к IL-12 на поверхности Т-хелперов и других клеток-киллеров. В свою очередь, Т-хелперы продуцируют IFN-g, который связывается с R1/R2 комплексом рецептора к IFN-g на поверхности макрофагов и активирует их. Активированные макрофаги устремляются к месту нахождения микобактерий и активно их поглощают [Rook G. A. W. et al., 1985]. Таким образом, гибель микобактерий внутри макрофага осуществляется в результате сложных, опосредованных цитокинами, взаимодействий лимфоцитов и фагоцитов.
Интерлейкин 12 имеет 2 цепи, массой 35 kD (р35), кодируемая IL12А и массой 40 kD (р40), кодируемая IL12В. Тогда как IL12р40 главным образом взаимодействует с рецептором IL12b1 на поверхности Т-хелпера, IL12р35 в первую очередь сцепляется с IL12b2. Используя иммунопреципитацию, Oppmann B. и соавторы (2000) определили, что IL12В и р19 формируют растворимый комплекс, который они назвали IL23. Анализ установил, что IL23, подобно IL12, связывается с рецептором IL12b1. Не так давно были выявлены цитокины IL18 и IL29 имеющие сходство в функции с IL12 и IL23. Ген NKSF2 (от англ. Natural Killer Cell Stimulatory Factor 2 – альтернативное название IL12) был картирован в дистальной области длинного плеча 5 хромосомы [Warrington J.A. et al., 1992]. В дальнейшем при помощи ПЦР анализа ДНК клеток гибридов был определен участок на хромосоме 5q31-33, где локализован IL12В [Sieburth D. et al., 1992]. J. A Warrington. и U Bengtsson. (1994) используя методы физического картирования, определили порядок расположения и относительное расстояние между 12 генами в 5q31-33 регионе. Ген IL12В был одним из них. Группа исследователей картировала ген IL12в на 11 хромосоме мыши [Noben-Trauth N. et al., 1996]. Используя модель животного, были получены экспериментальные данные о роли гена IL12В в защите от туберкулезной инфекции. Элиминация функции IL12в у "нокаутированных" мышей (IL12р40-/-) при условии их инфицирования вирулентным штаммом М. tuberculosis приводила к распространенной туберкулезной инфекции и гибели животного. Однако мыши с генотипом IL12р35-/- не проявляли повышенной чувствительности к туберкулезу. Данное наблюдение наводит на мысль о значительной роли субъединицы р40 интерлейкина-12 в развитии резистентности к туберкулезу [Cooper A. M. et al., 2002]. Генетический дефицит IL12 или IL12R приводит к частичной или полной недостаточности выработки IFN-g. Как правило, вакцина BCG и непатогенные микобактерии не вызывают у человека заболевания, однако известны случаи, когда они приводили к развитию тяжелой распространенной инфекции. Так было описано несколько пациентов с генетическим дефектом выработки IL12р40 и IL12р70 (комплекс судъединиц р40 и р70), большинство из которых страдали от диссеминированной инфекции М. bovis BCG. Недавно был обнаружен мононуклеотидный полиморфизм гена IL12В в 3`-UTR, обусловленный заменой А на С [Cervino A.C.L. et al., 2000]. Эта информация дает возможность оценить роль изменчивости гена IL12В в формировании полигенной подверженности к туберкулезу. Если рассмотреть патогенез туберкулеза, возникает множество привлекательных кандидатов на роль "причинного" гена. Одним из таких генов, предположительно влияющих на исход отношений между человеком и микобактерией, является ген рецептора к витамину Д (VDR) [Uitterlinden A.G. et al., 2004]. Витамин Д – это группа родственных стероидов, одним из важнейших среди которых является так называемый Д3 (холекальциферол). Главный эффект активированного витамина Д3 (1,25(ОН)2Д3) или кальцитриола – стимуляция активной адсорбции кальция и фосфата из кишечника. К тому же кальцитриол оказывает влияние на клетки крови – модулирует пролиферацию и дифференциацию лимфоцитов, а также способствует конверсии циркулирующих моноцитов в макрофаги [Rigby W. F., 1988; Bellamy R., Hill A. V. S., 1998]. Активизированные макрофаги в свою очередь также способны к образованию кальцитриола. При туберкулезе этот локально продуцируемый кальцитриол может активизировать "проглатывание" и элиминацию МБТ макрофагами и минимизировать тканевую деструкцию [Davies P.D.O., 1985; Cadranel J. et al., 1988]. Исследования in vitro показали, что метаболиты витамина Д могут усиливать способность моноцитов человека ограничивать размножение внутриклеточно расположенных микобактерий туберкулеза. В то время как добавление одного рекомбинантного человеческого IFN-g к пулированным моноцитам человека не оказывало влияния на их туберкулостатическую активность, введение в данную систему дополнительно кальцитриола приводило к полной остановке роста микобактерий [Rook G.A.W. et al., 1986; Denis M., 1991].Все перечисленные эффекты холекальциферола осуществляются посредством специальных рецепторов, которые присутствуют во многих клетках и органах, в том числе в лимфоцитах периферической крови и моноцитах [Griffin M.D. et al., 2003]. Такая широкая распространенность рецепторов к витамину Д говорит о том, что данный стероид и его метаболиты регулируют деятельность многих систем организма.
Локализация гена кодирующего рецептор к витамину Д определена у человека на хромосоме 12q12-q14 [Labuda M., 1991]. Известны его полиморфные варианты, наиболее часто из которых исследуются три полиморфизма: F/f, T/t, B/b. Обозначение и название этих полиморфных маркеров произошло от первых букв рестриктаз, используемых для их детекции в ПДРФ-анализе (FokI, TagI, BsmI).
Результаты исследования, проведенного в Западной Африке (Гамбия) методом случай – контроль, выявили статистически значимую ассоциацию tt генотипа VDR гена с резистентностью к легочному туберкулезу [Bellamy R., 2000]. Подобная работа была проведена в Китае, результаты которой показали наличие ассоциации ff генотипа VDR гена с подверженностью к ТБ [Liu W. et al., 2004].
Однако в популяции Перу статистически значимой ассоциации различных полиморфизмов гена VDR с туберкулезом найдено не было [Roth D. E. еt al., 2004]. В другом исследовании было показано, что большую роль в предрасположенности к ТБ играют гаплотипы гена VDR [Bornman L. et al., 2004]. В Лондоне была проведена работа, в результате которой исследователи определили наличие связи между дефицитом холекальциферола в организме человека и активным туберкулезом. Наряду с этим, авторы продемонстрировали отрицательное влияние комбинации генотипов ТТ и Tt, а так же генотипа ff с недостатком витамина Д на резистентность к ТБ [Wilkinson R.J. et al., 2000].
В другом исследовании было показано, что генотип tt VDR гена ассоциирован с подверженностью к легочному туберкулезу у женщин, а, в свою очередь, ТТ генотип – с резистентностью к ТБ у женщин [Selvaraj P. et al., 2000]. Таким образом, витамин Д, действуя через рецепторы и модулируя функцию макрофагов, может повышать противотуберкулезную защиту человека. Данное утверждение отчасти объясняет тот факт, что заболеваемость туберкулезом выше в течение холодных сезонов года, когда кожный синтез кальцитриола от экспозиции солнца понижен и серологический уровень витамина Д более низкий [Chan T.Y., 2000].
Однако известно, что действие продукта экспрессии гена рецептора витамина D оказывает умеренное влияние на полную чувствительность к туберкулезу [Hill A.V.S., 2001]. К тому же, роль кальцитриола в антибактериальном иммунитете не однозначна, поскольку он наряду с активизацией макрофагов проявляет такие эффекты, как угнетение пролиферации лимфоцитов, снижение продукции иммуноглобулина и синтеза цитокинов [Bellamy R., Hill A.V.S., 1998; Wilkinson R. J. et al., 2000].
В целом, можно отметить, что в настоящее время имеется достаточно разрозненная информация о генетических основах подверженности к туберкулезу, а так же, видимо, общее количество генов, в той или иной мере влияющих на развитие этого инфекционного заболевания, гораздо выше. Таким образом, поиск новых генов-кандидатов туберкулеза, а так же изучение полиморфизма известных генов-кандидатов в популяциях различного этнического состава и их вклада в общую подверженность к заболеванию представляется на сегодняшний день важной задачей, решение которой позволит определить новые подходы к более эффективному лечению и профилактике ТБ.
Похожие работы
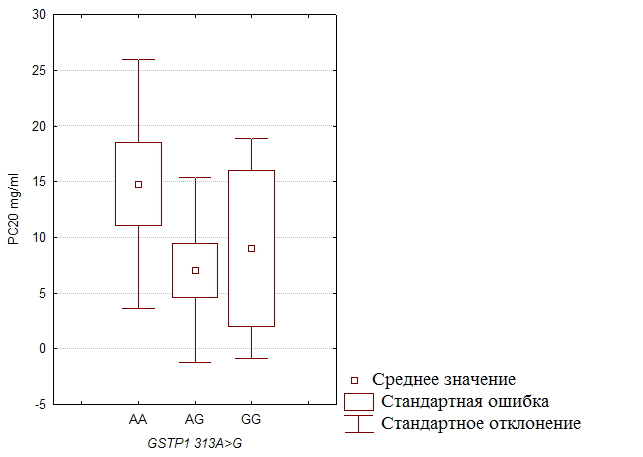
... препаратов. Установлена связь полиморфизма 313A>G гена GSTP1 с изменчивостью уровня аланинаминотрансферазы (р=0,021). 7. Выявлены различия в структуре генетической подверженности к бронхиальной астме и туберкулезу по генам ферментативной системы метаболизма ксенобиотиков: гены GSTM1, CYP2E1 и CYP2C19 связаны с бронхиальной астмой и значимыми для заболевания качественными и ...
0 комментариев