Навигация
2 s-МЕТАЛИ.
s-Елементи розміщуються в ІА - і ІІА-підгрупах періодичної системи Д.І. Менделєєва. Всі вони, за винятком Гідрогену і Гелію, належать до металів.
Висока хімічна активність s-металів і найсильніші серед відомих відновні властивості приводять до того, що у природі вони ніколи не зустрічаються у вільному стані (як прості речовини), а знаходяться у численних сполуках у вигляді позитивно заряджених йонів. Завдяки великим негативним значенням електродних потенціалів добування s-металів неможливо здійснити із водних розчинів, оскільки вони бурхливо реагують з водою, даючи розчини гідроксидів - луги. Звідки і виникла назва s-металів ІА-підгрупи - лужні, а s-метали ІІА-підгрупи (крім берилію та магнію) одержали назву лужноземельні, тому що розчинність їх гідроксидів у воді є значно меншою. Вільні лужні та лужноземельні метали одержують переважно електролізом розплавів їх солей-галогенідів - найчастіше хлоридів, які утворюють природні мінерали.
Невеликі заряди ядер і порівняно велики радіуси атомів зумовлюють високу хімічну активність s-металів, показником якої є дуже низькі значення їх потенціалів (енергій) йонізації та електронегативностей. Перший потенціал йонізації зменшуються по групі зверху униз. У літію він найбільший, у натрію - дещо менший. Більш різьке зниження потенціалу йонізації при переході від натрію до калію пояснюється явищем кайносиметрії - виникнення вільного d-підрівня. Найблизкішими за властивостями є повні електронні аналоги K, Rb, Cs, помітно відрюзняється від них Li, а Na займає проміжне місце. Чим вище значення потенціалу йонізації, тим сильнішою є поляризувальна дія катіону і тим вищою є його схільність до утворення ковалентних зв’язків. Тому йон Li+ існує лише в кристалічному стані, а у розчинах внаслідок гідратації він переходить у гідратовану форму [Li (H2O) 4] +, причому молекули води утримуються досить міцно і для їх видалення недостатньо простого нагрівання.
Всі s-метали мають на зовнішньому енергетичному рівні по одному-два електрони і можуть легко їх віддавати, прагнучи набути електронну конфігурацію попереднього інертного газу. При цьому метали ІА - і ІІА-підгруп утворюють відповідно йони Ме+ і Ме2+.
Металічні зв’язки утворюються делокалізованими валентними електронами, які утримують разом позитивно заряджені йони, що знаходяться у вузлах кристалічних решіток металів. Чим більшим є металічний радіус, тим тонкішим шаром розподілені делокалізовані електрони по позитивних йонах і тим слабкішим є зв’язок. Хімія таких елементів є, головним чином, йонною хімією, за винятком літію та берілію, які мають сильніші поляризувальні властивості. Однак у лужних і, особливо, у лужноземельних металів помітна тенденція до утворення ковалентних зв’язків. Так, у газуватому стані існують ковалентні молекули Na2, Cs2 тощо. Крім того, зв’язок цих металів у деяких комплексних сполуках з C, N, O теж відноситься до ковалентних.
У водних розчинах йони s-металів деякою мірою виявляють здатність до реакцій комплексоутворювання та до утворення донорно-акцепторних зв’язків з монодентантними лігандами. Більшість таких комплексів характеризується невеликою стійкістю. Причому, двохзарядні йони металів ІІА-підгрупи мають дещо сильніші комплексоутворювальні властивості. Для них найбільш притаманними є координаційні зв’язки з донорними атомами Оксигену, а для магнію - ще з атомами Нітрогену.
2.1 Лужні метали
Загальна електронна формула s-металів ІА-підгрупи ns1, де n - номер періоду і, одночасно, номер зовнішнього енергетичного рівня атома. Попередній електронний шар містить 8 електронів за винятком атомів літію, у яких є тільки два електрони на передзовнішньому шарі. Починаючи з четвертого періоду, атоми калію, рубідію, цезію мають вільні d-, f - і g-підрівні, які заповнються лише у наступних періодах.
Низькі значення перших потенціалів йонізації і, навпаки, дуже високі - других потенціалів йонізації є причиною того, що лужні метали у складних сполуках виявляють постійний ступінь окиснення +1. Незважаючи на те, що спорідненість до електрона у лужних металів має позитивне значення (тобто приєднання електрона до нейтрального атома супроводжується виділенням енергії), вони практично ніколи не виявляють негативних ступенів окиснення. Правда, нещодавно з’явилися відомості про те, що штучно одержано сполуку, в якій натрій перебуває у ступені окиснення -1, але це виключно рідкий випадок.
При переході від Li до Fr послідовно зменшуються такі властивості:
температури плавлення і теплоти сублімації;
енергії утворення кристалічних решіток усіх солей (за винятком солей з аніонами, що мають дуже невеликі радіуси);
легкість термічного розкладання нітратів і карбонатів (збільшується їх міцність);
ефективні радіуси гідратованих йонів і енергії гідратації;
міцність ковалентних зв’язків у молекулах типу M2;
теплоти утворення фторидів, гідридів, оксидів і карбідів - внаслідок великих енергій кристалічних решіток сполук, утворених невеликими за розміром аніонами.
Для атомів лужних металів притаманне дуже невелике значення роботи виходу електрона, завдяки чому вони знайшли широке застосування в електроніці як емітери електронів для фотоелементів, фотомножників, перетворювачів світлових сигналів у електричні.
2.1.1 Поширення у природіВміст літію у земній корі становить усього 5.10-3% (мас). Літій утворює власні рідкі мінерали: сподумен LiAl (Si2O6), амблігонит LiF. AlРО4, але найчастіше він зустрічається у природі як домішка до сполук натрію та калію. Натрій становить 2,6% від маси земної кори і знаходиться у вигляді NaCl у твердому мінералі - кам’яній солі - і в морській воді, а також у мінералах: тенардит Na2SO4, глауберова сіль Na2SO4.10H2O; глауберит Na2SO4. CаSO4; чилійська селитра NaNO3; сода Na2CO3.10H2O; бура Na2B4O7.10H2O. Калій, кількість якого у земній корі дорівнює 2,4%, утворює мінерали: сильвін KCl, карналіт KCl. MgCl.6H2O, каїнит KCl. MgSO4, селітра KNO3. Рубідій і цезій у невеликих кількостях знаходяться, як правило, разом із натрієм і калієм в їх сполуках.
2.1.2 фізичні властивостіЛужні метали - сріблясто-білі речовини, крім цезію, у якого золотаве забарвлення. На свіжому повітрі s-метали у розрізі мають блискучу поверхню, але при контакті з киснем повятря дуже швидко тускніє, тому їх зберігають під шаром гасу. Більшість складних сполук лужних металів безбарвні, оскільки електронна оболонка Ме+ (оболонка інертного газу) є дуже стійкою, а йони не деформані (якщо йони не деформовані, то сполука безбарвна).
Фізичні властивості лужних металів змінюються досить закономірно залежно від положення у періодичній системі елементів, будови атома і структури кристалічної решітки (табл.1).
Таблиця 1 - Фізичні властивості лужних металів
| Метал | Густина, г/см3 | Кристалічна структура | Темп. плавлення, К | Темп. кипіння, К |
| Li | 0,534 | Об’ємно - центрована кубічна | 461 | 1613 |
| Na | 0,97 | " | 371 | 1163 |
| K | 0,86 | " | 336 | 1033 |
| Rb | 1,50 | " | 312 | 969 |
| Cs | 1,90 | " | 301,5 | 981 |
Температури плавлення і кипіння для металів ІА-підгрупи низькі, вони зменшуються по групі згори униз, а густини, навпаки, збільшуються. Це пояснюється так. Валентні електрони надзвичайно тонким шаром розподіляються по позитивно заряджених йонах s-металів, параметри кристалічних комірок зростають (завдяки збільшенню радіусів атомів) із зростанням порядкового номера, що призводить по послабшення хімічних зв’язків. Це й зумовлює зменшення температур плавлення. Однак поряд із зростанням радіусів збільшується й маса атомів. У калію відбувається різке збільшення радіуса порівняно з натрієм (за рахунок появи d-підрівня), тому вплив об’єму переважає над впливом маси, що приводить до зниження густини порівняно з натрієм (табл.1).
Хімічний аналіз лужних металів проводять за допомогою метода пламеневої фотометрії, оскільки їх пари інтенсивно забарвлені: літію - у червоний колір, натрію - у жовтий, калію - у фіолетовий, рубідію - у фіолетово-рожевий, цезію - у блакитний. В атмосфері водню пари натрію мають фіолетове забарвлення, калію - блакитнувато-зелене, а у рубідію та цезію, навпаки, - зеленувато-блакитне.
Лужні метали дуже м’які, пластичні, легко ріжуться ножем, тому їх неможливо використовувати як конструкційні матеріали, але літій і натрій застосовуються у сплавах з іншими металами.
2.1.3 Хімічні властивості
Хімічні властивості лужних металів визначаються будовою їх атомів і енергетичними характеристиками (табл.2).
Низькі значення перших потенціалів йонізації, великі ефективні радіуси атомів, які різко зменшуються при утворенні з нейтральних атомів позитивно заряджених йонів, - все це сприяє зростанню хімічної активності у міру збільшення порядкового номера. У хімічних реакціях атоми лужних металів виявляють сильні відновні властивості, вони легко втрачають валентні електрони, перетворюючись на позитивно заряджені йони - катіони:
Mе0 - ē àMе+.
Таблиця 2 - Енергетичні характеристики лужних металів
| Метал | Заряд ядра | Електронна формула | Радіус атома, нм | Радіус йона, нм | Потенціал йонізації, В | Электро-негативність | Електродний потенціал, В |
| Li | 3 | 1s22s1 | 0,155 | 0,078 | 5,37 | 0,98 | -3,02 |
| Na | 11 | 2s22p63s1 | 0,189 | 0,098 | 5,12 | 0,93 | -2,71 |
| K | 19 | 3s23p64s1 | 0,236 | 0,133 | 4,32 | 0,82 | -2,92 |
| Rb | 37 | 4s24p65s1 | 0,248 | 0,149 | 4, 19 | 0,82 | -2,93 |
| Cs | 55 | 5s25p66s1 | 0,268 | 0,165 | 3,86 | 0,79 | -2,93 |
Відношення до води. Літій з водою взаємодіє досить повільно, натрій - вже енергійно, цезій - з вибухом відповідно до загальної схеми (символом Ме позначений лужний метал):
2 Ме + 2Н2О à 2МеОН + Н2.
Внаслідок реакції виділяється водень і утворюються сильні основи - луги.
Взаємодія з елементарними окисниками. Завдяки великій відновній активності лужні метали взаємодіть із більшістю елементів, утворюючи бінарні сполуки, в яких неметали виявляють негативні ступені окиснення, найчастіше - мінімальні. Відносно до лужних металів всі елементи з високими електронегативностями є окисниками, в тому числі й водень. Реакції лужних металів з елементарними окисниками можуть проходити при нагріванні чи за звичайних умов - залежно від активності як металу, так і окисника.
З киснем тільки літій окиснюється до оксиду, решта лужних металів дає пероксиди (в яких ступінь окисненя Оксигену дорівнює -1) чи супероксиди (в старій номенклатурі - надпероксиди, в яких О-1/ 2)
4Li + O2 à 2Li2O;
2 Na + O2 à Na2O2;
K + O2 à KO2 (або K2O4).
Доречно згадати, що оксиди калію та натрію можуть бути одержані тільки при нагріванні суміші пероксиду з надлишком металу при повній відсутності кисню:
Na2O2 + 2Na à 2 Na2O.
З воднем лужні метали утворюють гідриди
2Li + H2 à 2LiH;
з азотом - нітриди; при кімнатній температурі у реакцію вступає літій, решта лужних металів - при нагріванні
6Mе + 3N2 à 2Mе3N;
з галогенами – галіти
2Mе + Hal2 à 2MеHal,
де Hal - F, Cl, Br, I;
з фосфором – фосфіди
3Mе + P à Mе3P;
з сіркою та її аналогами (Se, Te) у розплавленому стані чи при нагріванні – халькогеніди
2Mе + S à Mе2S;
з графітом – карбіди
2Mе + 2C à Mе2C2;
з кремнієм – силіциди
4Mе + Si à Mе4Si.
Крім того, лужні метали здатні енергійно, з виділенням теплоти розчинятися у ртуті, утворюючи амальгами змінного складу, які використовують як м’які, але сильні окисники.
Відношення до кислот. Взаємодія всіх лужних металів з кислотами супроводжується вибухом, тому спеціально такі реакції не проводять. Однак корисно знати, які продукти утворюються внаслідок таких реакцій, якщо за якихось причин їх все ж таки необхідно буде здійснити.
Взаємодія з неокислювальними кислотами (розведена сірчана H2SO4, галогеноводневі HF, HCl, HBr, HI, фосфорна H3PO4, оцтова CH3COOH та інші слабкі кислоти), в яких окисником завжди є йон Гідрогену Н+ (чи, точніше, гідроксоній-катіон Н3О+) супроводжується виділенням водню та утворенням солі і проходить за загальною схемою:
2Mе + 2HАn àMеAn + H2.
Взаємодія з окиснювальними кислотами (азотна HNO3, концентрована сірчана H2SO4 та ін), окиснювальна здатність яких зумовлюється не наявністю йона Гідрогену, а властивостями недисоційованих молекул самих кислот чи їх кислотних залишків - аніонів. Особливість дії цих кислот полягає в тому, що вони окиснюють метал без виділення водню. Однак у випадку реакції лужних металів (Li, Na, K) з дуже розведеними розчинами окиснювальних кислот, яка проходить надзвичайно бурхливо, поряд з основними продуктами реакції може виділятися і водень, але це є результатом побічної реакції, тобто взаємодії металу не з кислотою, а з водою, наявною у розчині кислоти. Розглянемо відношення лужних металів до кислот-окисників на прикладі натрію:
8Na + 10HNO3 (розв) à8NaNO3 + NH4NO3 + 3H2O,
3Na + 4HNO3 (конц) à 3NaNO3 + NO + 2H2O,
8 Na + 5H2SO4 (конц) à 4Na2SO4 + H2S + 4H2O.
Як видно з рівнянь реакцій натрій відновлює Нітроген (+5) у конценрованій HNO3 до ступеня окиснення +2, а в розведеній - аж до -3. Сульфур (+6) в концентрованій H2SO4 теж відновлювається максимально - до найнижчого ступеня окиснення -2.
Відношення до солей.
Лужні метали, які розміщуються на самому початку ряду напруг, належать до найбільш активних відновників, тому при внесенні їх у водні розчини солей малоактивних металів вступають у взаємодію не з самою сіллю, а з водою, що міститься у розчині, наприклад:
2K + 2H2O à 2KOH + H2.
Однак натрій здатний взаємодіяти з розплавами солей - переважно з хлоридами чи фторидами менш активних металів. На цьому заснований металургійний метод добування металів, так звана натрієтермія - одержання Ti, Zr, Nb, Ta та ін. при відновлюванні їх за допомогою натрію:
TiCl4 + 4Na à Ti + 4NaCl,
BeF2 + 2Na à Be + 2NaF.
Взаємодія з амоніаком, в яку вступають лужні метали, проходить при контакті металу з рідким NH3 чи при його нагріванні в парах амоніаку
2Na + 2NH3 à 2NaNH2 + H2.
При цьому утворюються аміди лужних металів складу MeNH2 - кристали, що легко гідролізуються водою:
NaNH2 + H2O à NaOH + NH3.
З органічними сполуками. Метали ІА-підгрупи можуть взаємодіяти зі спиртами, утворюючи алкоголяти, з органічними кислотами з утворенням органічних солей – карбоксил атів
CH3-CH2-OH + Na à CH3-CH2-ONa + ½ H2O,
Етанол Етанолят натрію
CH3-COOH + Na à CH3COONa + ½ H2O.
Оцтова кислота Ацетат натрію.
Натрієві солі вищих жирних кислот широко застосовуються при одержанні мил та миючих засобів. Крім того, лужні метали здатні вступати в реакції з іншими органічними речовинами, продуктами чого є так звані металоорганічні сполуки, у тому числі - натрійорганічні сполуки.
2.1.4 Сполуки лужних металів та їх властивостіОксиди (загальна формула М2О) добувають, як вже згадувалося, при безпосередньому контакті з киснем в умовах його недостачі і контрольованого доступу в реакційне середовище. Причому, спочатку утворюється пероксид, який розкладається при підвищеному температурному режимі за схемою:
2Na + O2 à Na2O2,2Na2O2 à 2Na2O + O2.
Оксиди мають такі забарвлення: Li2О і Na2О - безбарвні, K2О і Rb2О - жовті, Cs2О - оранжевий. Забарвлення посилюється, оскільки у міру збільшення розмірів йонів М+ збільшується їх поляризованість. При контакті з водою оксиди лужних металів швидко розчиняються з утворенням сильних основ – лугів
2Na2O + Н2Oà2NaOН.
Оксиди лужних металів виявлять властивості типових основних оксидів, тому легко вступають у взаємодію з кислотами, кислотними і навіть амфотерними оксидами і основами (останні дві реакції відбуваються при сумісному сплавленні вихідних речовин)
Na2O + 2 HCl à 2NaCl + H2O, Na2O + CO2 à Na2CO3,Na2O + BeO à Na2BeO2,Na2O + Zn (OH) 2 à Na2ZnO2 + H2O.
Крім звичайних оксидів лужні метали з Оксигеном утворюють пероксиди загального складу М2О2, що містять йони О22-, в яких ступінь окиснення Оксигену дорівнює -1, і супероксиди М2О4 (чи МО2) зі ступенем окиснення Оксигену -1/2. Стійкість пероксидів і супероксидів зростає при збільшенні розміру йона металу М+, оскільки зі збільшенням радіуса катіона стабілізується кристалічна решітка. Пероксиди - солеподібні речовини, їх можна розглядати як сіль надто слабкої кислоти Н2О2. При дії на них холодною водою пероксиди піддаються швидкому гідролізу, внаслідок якого утворюється гідроген пероксид
Na2O2 + 2H2O à 2NaOH + Н2O2,
однак при дії гарячою водою чи при нагріванні пероксиди диспропорціонують за схемою:
2Na2O2 + 2H2O à 4NaOH + O2.
Пероксид натрію уявляє собою жовтий кристалічний порошок, який розкладається при триваловому зберіганні
2Na2O2 à 2Na2O + O2.
Оскільки пероксиди містять атоми Оксигену в проміжному ступені окисненя (-1), то для них притаманна окисно-відновна двоїстіть. Із сильними відновниками вони виступають як окисники, наприклад:
4Na2O2 + H2S + 2H2O à 4Na2SO4 + 6NaOH
S-2 - 8 ē à S+6
O2-2 + 2ē à 2O-2,
але - з сильними окисниками - як відновники:
3Na2O2 + HIO3+ 3H2SO4 à 3Na2SO4+HI +O2+ 3H2O
O2-2 - 2ē à 2O2
I+5 + 6ē à I-1.
Супероксиди належать до сильніших окисників: у них майже миттєво згоряє алюміній, а деревинні ошурки - при незначному нагріванні. Вони реагують з водою з утворенням кисню і гідроген пероксиду
2КО2 +2Н2О à2КОН + Н2О2 + О2.
Гідриди -білі кристалічні речовини, що містять аніон Н-1. Їх термічна стійкість зменшується у ряді LiH-NaH-KH-RbH-CsH, а реакційна здатність, навпаки, - збільшується від LiH до CsH. Завдяки невеликій стікості вони розкладаються водою, при цьому Гідроген (-1), що входить до складу гідриду відновлює Гідроген (+1), який знаходиться у воді
NaH + H2O à NaOH + H2.
Їх вважають солеподібними сполуками, оскільки вони легко вступають у реакцію с кислотними оксидами, наприклад, з вуглекислим газом, утворюючи форміат натрію - сіль органічної (мурашиної) кислоти
NaH + CO2 à HCOONa.
Гідроксиди лужних металів - луги. Це безбарвні кристалічні речовини, легкоплавкі: Тпл. зменшується від LiОH (473оС) до CsОH (346оС), дуже добре розчинні у воді (за винятком LiОH), cтійкі до нагрівання навіть до 1000оС, крім LiОH, який розкладається вже при температурі 500оС
2LiОH à Li2О + Н2О.
Луги належать до дуже сильних електролітів, вони майже повністю дисоціюють у водних розчинах, утворюючи незв’язані йони
MeOH à Me+ + OH-.
Наявність у розчинах лугів незв’язаного гідроксилу OH- зумовлює високу реакційну здатність гідроксидів лужних металів, які взаємодіють з численними речовинами багатьох класів неорганічних і органічних сполук:
з мінеральними і органічними кислотами
NaOH + HCl à NaCl + H2O,
NaOH + С17H35СOOH à С17H35СOONa + H2O;
з кислотними оксидами
6NaOH + P2O5 à 2Na3PO4 + 3H2O,
2NaOH + 2NO2 à NaNO3 + NaNO3 + H2O;
вони добре поглинають із повітря вуглекислий газ, який теж належить до кислотних оксидів
2NaОH + CO2 à Na2CO3 + Н2О,
з амфотерними оксидами і основами
NaOH (кр) + Al2O3 à NaAlO2 + H2O (при сплавленні),
NaOH (р-н) + Al2O3 +H2O à Na [Al (OH) 4]
з нормальними, кислими, основними і амонійними солями (умовою протікання цих реакцій є утворення внаслідок неї газу, осаду чи малодисоційованої сполуки)
NaOH + Fe (NO3) 3 à NaNO3 + Fe (OH) 3↓, NaOH + NaHCO3 à Na2CO3 + H2O, NaOH + Cr (OH) 2Cl à NaCl + Cr (OH) 3↓,NaOH + NH4Cl à NaCl + NH4OH,
однак при нагріванні остання реакція проходить іншим шляхом:
NaOH + NH4Cl à NaCl + NH3 + H2O;
з деякими неметалами, наприклад:
6NaOH (гаряч. розчин) + 3Cl2 à 5NaCl + NaClO3 + 3H2O;
2NaOH +Cl2 à NaCl + NaClO + H2O;
8NaOH + 4S (розплав) à 3Na2S + Na2SO4 + 4H2O.
Луги є настільки сильними основами, що при плавленні реагують навіть зі склом і фарфором і розчиняють платину та деякі інші малоактивні метали у присутності кисню
2NaOH (кp) + SiO2 à Na2SiO3 + H2O,
2NaOH + Pt + O2 à Na2PtO3 + H2O.
Солі. Лужні метали утворюють солі з усіма оксигенвмісними і безкисневими кислотами. Корисно пам’ятати, що для деяких солей лужних металів більш поширеними є не номенклатурні, а тривіальні назви, наприклад: NaCl - поварена сіль, Na2CO3 - сода, або кальцінована сода NaHCO3 - питна сода, K2CO3 - поташ, NaNO3 і KNO3 - селітри, Na2B4O7 - бура, а натрієві солі вищих карбонових кислот загального складу СnН2n+1СООNa - мила.
Майже всі солі лужних металів добре розчиняються у воді, тому найчастіше їх добувають за обмінними реакціями нейтралізації
3NaOH + H3PO4 à Na3PO4 + 3H2O.
Солі лужних металів і слабких кислот гідролізуються у водних розчинах з утворенням лужного середовища, в якому рН >7:
СН3СООNa + H2O Û CH3COOH + NaOH,
СН3СОО- + Na+ + H2O Û CH3COOH + Na+ + OH-,
СН3СОО- + H2O Û CH3COOH + OH-.
Якщо у складі солі є багатозарядний аніон слабкої кислоти, то така сіль гідролізується ступінчасто, наприклад, гідроліз карбонату натрію:
I ступінь: Na2CO3 + H2O Û NaHCO3 + NaOH,
2Na+ + CO32- + H2O Û Na+ + HCO3- + Na+ + OH-,
CO32- + H2O Û HCO3- + OH-;
ІІ ступінь: NaНCO3 + H2O Û H2CO3 + NaOH,
Na+ + НCO3- + H2O Û H2CO3 + Na+ + OH-,
НСО3- + Н2О Û Н2СО3 + ОН-.
Солі безкисневих кислот стійкі до нагрівання, при високих температурах вони просто переходять з твердого стану в рідкий розплав. Однак солі оксигенвмісних кислот не завжди витримують значне підвищення температури. Нітрати розкладаються, причому нітрат літію розкладається за однією схемою, а нітрати всіх інших лужних металів - за іншою, як показано на прикладі нітрату натрію:
4LiNO3 à2 Li2O + 4NO2 + O2,2NaNO3 à 2NaNO2 + O2.
Стійкість солей лужних металів до підвищених температур зростає згори вниз - від солей літію до солей цезію. Так, карбонат літію розкладається
Li2CO3 à Li2O + CO2,
а карбонат натрію Na2CO3 та карбонати інших лужних металів плавляться без розкладання.
2.1.5 Застосування лужних металів та їх сполукДеякі шляхи використання лужних металів та їх сполук вже були згадані у попередньому тексті. До того слід додати ще кілька моментів.
Металевий натрій - найширше застосований метал. Він використовується у металургії як відновник, для абсолютування органічних розчинників, як теплоносій в ядерних реакторах сумісно з калієм, для добування Na2O2, який, у свою чергу, застосовується для очищення та регенерації повітря в апаратах штучного дихання.
Сполуки натрію використовуються у медицині і багатьох галузях промисловості. Пероксиди застосувують для вибілювання тканин, гідроксид натрію - при виробництві целюлози, виготовленні мил і миючих засобів, штучного волокна, очищення мастил, виробництві барвників тощо. Фторид натрію використовують для просочення деревини і як флюс.
Металевий калій застосовують рідше, ніж натрій. Його використовують у металотермії та органічних синтезах для одержання сплавів з натрієм та іншими металами, а також для вимірювання поглинання рентгенівського випромінювання за допомогою калієвої пластинки. З нього одержують супероксид, який використовують у підводних човнах для регенерації повітря:
4КО2 + 2CO2 à 2K2CO3 + 3O2.
Сполуки калію застосовують у сільському господарстві як добрива, в стекольній промисловості, при виробництві рідкого мила та ін.
Рубідій та цезій застосовують для виготовлення фотоелементів. Інтерметалеві сполуки рубідію та цезію Rb3Sb і Cs3Sb використовують як напівпровідниковий матеріал при виготовленні фотокатодів. Багато комплексних сполук, що містять Rb і Cs, використовують в аналітичній хімії.
2.2 s-Метали ііа-підгрупиГоловна підгрупа ІІ групи періодичної системи елементів містить берілій Be, магній Mg і лужноземельні метали: кальцій Ca, стронцій Sr, барій Ba. Шостий елемент - радій Rа - є штучним радіоактивним елементом, одержаним під час ядерних реакцій. Берилій та магній не належать до лужноземельних металів, оскільки за своїми властивостями вони помітно відрізняються від лужноземельних металів: берилій за реакційною здатністю більше походить на алюміній, а магній окремими властивостями нагадує літій, а деякими іншими - цинк.
Електронна структура s-металів ІІ групи - ns2. Найбільш характерний ступінь окиснення дорівнює +2. Перший потенціал йонізації І1 вищий, ніж у s-металів ІА-підгрупи, що є наслідком зростання заряду ядра і зменшення атомних радіусів порівняно з лужними металами, а також підвищеної стійкості повністю заповненої електронами ns2-конфігурації на відміну від ns1.
Метали ІІА-підгрупи - це речовини, що мають більшу твердість і меншу активність, ніж лужні метали.
У межах ІІА-підгрупи хімічна активність металів зростає згори вниз, причому, за багатьма своїми показниками різко виділяється берилій.
Вони виявлять певну схильність до утворення ковалентних зв’язків, особливо Be, сполуки якого у розчинах і в твердому стані мають переважно ковалентні зв‘язки. У магнію теж спостерігається тенденція до утворення ковалентних зв’язків, а Са, Sr і Ba, навпаки, утворюють частіше йонні зв’язки. У розчинах ці метали знаходяться, в основному, у вигляді йонів Ме2+. Незважаючи на те, що електронегативності (ЕН) і потенціали (або енергії) йонізації у лужноземельних металів більші, ніж у лужних, їх стандартні електродні потенціали (табл.3) мають близькі значення з металами ІА-підгрупи внаслідок великої енергії гідратації йонів Ме2+:
Ме·aq2+ +2 ē à Me (тв).
Всі йони Ме2+ мають менші радіуси і поляризуються значно менше, ніж Ме+, тому їх солі майже не відхиляються від йонністі, яка зумовлюється поляризацією катіонів. Проте катіони магнію Mg2+ і особливо берилію Be2+ завдяки їх поляризувальній здатності помітно поляризують аніони, з якими контактують, - саме з цієї причини спостерігається тенденція до утворення ними ковалентних зв’язків.
Таблиця 3 - Властивості металів ІІА-підгрупи
| Метал | 4Be | 12Mg | 20Ca | 38Sr | 56Ba | 88Ra |
| Атомна маса | 9,01 | 24,31 | 40,08 | 37,62 | 137,34 | [226] |
| Електронна конфігурація | [He] 2s2 | [Ne] 3s2 | [Ar] 4s2 | [Kr] 5s2 | [Xe] 6s2 | [Rn] 7s2 |
| Атомний радіус, нм | 0,113 | 0,160 | 0, 197 | 0,215 | 0,221 | 0,235 |
| Радіус йона, нм | 0,034 | 0,074 | 0,104 | 0,120 | 0,138 | 0,144 |
| Енергія йонізації, еВ | 9,32 | 7,65 | 6,11 | 5,69 | 5,21 | 5,28 |
| Електро-негативність | 1,5 | 1,2 | 1,0 | 1,0 | 0,9 | 0,9 |
| Електродний потенціал, В | -1,85 | -2,31 | -2,57 | -2,89 | -2,90 | - |
В основі добування металів ІІА-підгрупи лежить реакція їх відновлення їз сполук за допомогою сильних відновників чи електричного струму. Берилій відновлюють із фторидів, а барій - із оксидів при високих температурах за схемами
BeF2 + Mg à Be + MgF2,3BaO + 2Al à 3Ba + Al2O3.
Інші метали - електролізом розплавів, наприклад:
CaCl2 à Ca + Cl2, Катод: Ca2+ +2 ē à Cao, Анод: 2Cl- - 2 ē à Cl2o.
Крім того, магній добувають металотермічним методом (при прокалюванні доломиту при 1300оС з феросиліцієм чи алюмосиліцієм, в якому відновником виступає Si)
2 (CaO·MgO) + Si à Ca2SiO4 + 2Mg,
чи за тією ж схемою - вугільнотермічним методом (відновленням магнійвмістних сполук за допомогою вугілля С в електропечах при 2100оС).
2.2.1 Поширення у природіУ земній корі міститься берилію - 0,0005%, магнію - 1,95%, кальцію - 3,38%, стронцію - 0,014%, барію - 0,026%, радій - штучний елемент. У природі елементи ІІА-підгрупи, крім штучно одержаного радію, зустрічаються лише у вигляді складних сполук - силікатів, карбонатів, сульфатів, фосфатів тощо. Найважливішими є такі мінерали: берилію - берил 3BeO·Al2O3·6SiO2 (до речі, прозорі забарвлені домішками різновиди берила є дорогоцінними каміннями: зелений - ізумруд, блакитний - аквамарин),фенакит Be2SiO4, хризоберил BeO·AL2O3; магнію - магнезит MgCO3, доломит MgCO3·CaCO3, бішофіт MgCl2·6H2O, каїніт KCl·MgSO4·3H2O, карналіт KCl·MgCl4·6H2O; кальцію - кальцит (крейда, вапняк, мармур) CaCO3, гіпс CaSO4·2H2O, флюорит (плавиковий шпат) CaF2, фторапатит 3Ca3 (PO4) 2·CaF2, фосфорит Ca3 (PO4) 2; стронцію - целестин SrSO4, стронцініт SrCO3; барію - барит BaSO4, вітерит ВаСО3.
2.2.2 Фізичні властивостіУ вільному стані всі метали ІІА-підгрупи - сріблясто-білі речовини за винятком берилію, який має світло-сірий колір.
Загальна закономірність змінення фізичних властивостей нагадує лужні метали (табл.4).
За винятком берилію та радію, всі вони є достатньо ковкими, пластичними і м’якими, хоч і твердіші за лужні метали. Берилій відрізняється значною твердістю та крихкістю, барій при різкому сильному ударі розколюється на окремі шматки.
Таблиця 4 - Фізичні властивості металів ІІА-підгрупи
| Метал | Густина, г/см3 | Тпл., К | Ткип., К |
| Be | 1,85 | 1557 | 2700 |
| Mg | 1,74 | 923 | 1380 |
| Са | 1,55 | 1124 | 1760 |
| Sr | 2,63 | 1041 | 1640 |
| Ва | 3,76 | 983 | 1910 |
| Ra | 6,0 | 970 | 1410 |
Температури плавлення та кипіння цих металів вищі, ніж у лужних, причому із зростаннім порядкового номера Тпл. змінюються не монотонно, що пов’язано зі зміненою типу кристалічних решіток. У кристалічному стані за звичайних умов берилій та магній мають гексагональну кристалічну решітку, кальцій та стронцій - кубічну гранецентровану, а барій - кубічну об’ємоцентровану. Від Be до Mg при однаковому типі решітки температури плавленнязменшуються. При переході від Mg до Са змінюється тип кристалічної решітки, тому Тпл. (Mg) < Тпл. (Са). Потім, починаючи від Са, темпратури плавлення знов зменшуються
Тип зв’язку - металічний - зумовлює високу тепло - і елекропровідність. Найслабшим провідником електричного струму є берилій.
Крім радію, метали підгрупи ІІА є легкими. Ход змінення густин повинен бути монотонним, але з цього ряду випадають магній та кальцій. Справа в тому, що при зростанні порядкового номера по підгрупі збільшуються об’єми і маси атомів і тому можна було б очікувати зростання густини. Але насправді при переході від Mg до Ca радіус атома змінюється дуже різко, а маса - мало, що й призводить до стрибка густини.
Берилій та магній покриті оксидною плівкою і не змінюються на повітрі. Завдяки хімічній активності та для запобігання взаємодії з повітрям лужноземельні метали зберігать у запаяних ампулах під шаром гасу чи вазелинового масла.
При внесенні у вогонь деякі лужноземельні метали дають характерне забарвлення: кальцій - темно-оранжеве, барій та радій - темно-червоне, стронцій - блідо-зелене.
2.2.3 Хімічні властивостіМетали ІІА-підгрупи мають загальну електронну формулу зовнішнього енергетичного рівня ns2, на попередньому електронному шарі містять по всім електронів, а атом берилію - тільки два. Починаючи від Са, з’являються вільні d-підрівні, що зумовлює вищу активність лужноземельних металів (Ca, Sr, Ba) і відмінність хімічних властивостей від берилію і магнію.
Відношення до води. З водою Be і Mg завдяки наявності на їх поверхні інертної оксидної плівки взаємодіють дуже помірно тільки при нагріванні, а лужноземельні метали - вже за звичайних температур, причому Са реагує досить повільно, Sr - енергійно, а Ва - бурхливо. Реакція проходить згідно із загальною схемою
Ме + 2Н2О à Me (OH) 2 + H2.
Внаслідок реакції виділяється водень і утворюються основи: Ве (ОН) 2 і Mg (OH) 2 - нерозчинні у воді, а гідроксиди Ca (OH) 2 і, особливо, Sr (OH) 2 і Ba (OH) 2 розчиняються достатньо добре, належать до сильних основ, тому їх називають лугами.
Взаємодія з елементарними окисниками лужноземельних металів проходить подібно до реакцій лужних металів, але менш енергійно. При прямому окиснені киснем всі ІІА-метали дають оксиди, а барій – пероксид
2Mg + O2 à 2MgO (оксид),
Ba + O2 à BaO2 (пероксид).
Однак при температурі 800оС пероксиди барію розкладаються, тому при спалюванні Ва одразу утворюється оксид
2Ba + O2 (to) à 2BaO (оксид).
З іншими окисниками s-метали ІІ групи утворюють бінарні сполуки. Взаємодія с сіркою, азотом, фосфором, вуглецем протікає при нагріванні, з галогенами - за звичайних температур, за винятком берилію, який реагує при кімнатній температурі лише з фтором, а з рештою галогенів - при нагріванні. Внаслідок цих реакцій метали окиснюються до ступеня окиснення +2, а окисник набуває мінімального ступеня окиснення: S-2, N-3, P-3, Hal-1, C-4 (крім кальцію, який звичайно відновлює Карбон до ступеня окиснення C-1). З воднем безпосередньо взаємодіють лише лужноземельні метали, а Be і Mg в таку реакцію не вступають. Приклади реакцій (в дужках наводяться назви відповідних типів бінарних сполук):
Be + F2 à BeF2 (галіди),
Ba + S à BaS (халькогеніди),
3Mg + N2 à Mg3N2 (нітриди),
Ca + H2 à CaH2 (гідриди),
Ca + 2C à CaC2 (карбіди),
3Ba + 2P à Ba3P2 (фосфіди).
Відношення до кислот. Усі метали ІІА-підгрупи з різною мірою енергійності взаємодіють з неокиснювальними кислотами, утворюючи сіль і вільний водень:
Mе + 2HАn àMеАn2 + H2.
Взаємодія з окиснювальними кислотами проходить досить бурхливо, причому окисники, що містяться в азотній HNO3 чи концентрованій сірчаній H2SO4 кислотах, відновлюються до мінімального ступеня окиснення, наприклад:
4Mg+ 10HNO3 (дуже розв) à4Mg (NO3) 2+ NH4NO3+ 3H2O,
4 Ca + 5H2SO4 (конц) à 4CaSO4 + H2S + 4H2O.
Дещо отсторонь у цьому ряді стоїть Ве, який пасивується (тобто вкривається захисною оксидною плівкою) у присутності холодних концентрованих HNO3 H2SO4) і може вступати з ними у взаємодію лише при триваловаму нагріванні - цим Ве нагадує Al.
Відношення до лугів. Усі лужноземельні метали і магній виявляють стійкість до лугів, але берилій подібно до алюмінію розчиняється у рідких лугах з утворенням комплексних солей - тетрагідроксоберилатів, а при високих температурах здатний сплавлятися з твердими лугами, внаслідок чого утворюються середні солі - берилати:
Be + 2NaOH (р-н) + 2H2O à Na2 [Be (OH) 4] + H2,Be + 2NaOH (to) à Na2BeO2 + H2.
Взаємодія з амоніаком має особливе значення, оскільки дає змогу одержувати нейтральні комплекси. Метали ІІА-підгрупи як і лужні метали розчиняються у рідкому амоніаку з утворенням амідів, наприклад:
Ca + 2 NH3 (рідкий) à Ca (NH2) 2 + H2.
Аміди загального складу Ме (NH2) 2 на відміну від амідів лужних металів МеNH2 не розкладаються при кип’ятінні, а виділяють досить стійкі комплексні амоніакати [Me (NH3) 6], в яких ступінь окиснення металу дорівнює 0.
2.2.4 Сполуки s-металів ііа-підгрупи та їх властивостіЗавдяки високій реакцій здатності s-метали ІІ групи утворюють численні сполуки.
Оксиди мають загальну формулу МеО. Деякі оксиди мають поширені тривіальні назви: MgO - палена магнезія, СаО - негашене вапно.
Оксиди лужноземельних металів CaO, SrO і BaO належать до типових основних оксидів: при розчинені у воді вони дають відповідні гідроксиди - луги, а при взаємодії з кислотами і кислотними оксидами - солі.
Окреме місце займають оксиди берилію та магнію. Оксид ВеО не розчиняється у воді і виявляє амфотерні властивості, тобто реагує не тільки з кислотами, але й з лугами:
BeO + 2HCl à BeCl2 + H2O,
BeО + 2NaOH (р-н) + 2H2O à Na2 [Be (OH) 4],
BeO + 2NaOH (to, сплавлення) à Na2BeO2 + H2О.
Оксид магнію відносно до води та інших реагентів теж поводить себе неоднозначно: дрібнокристалічний MgO є хімічно активним: помірно розчиняється у воді, поглинає СО2 та інші кислотні оксиди, легко взаємодіє з кислотами:
MgO + H2O à Mg (OH) 2,MgO + CO2 à MgCO3,MgO + H2SO4 à MgSO4 + H2O.
Однак прокалений MgO стає твердим і втрачає хімічну активність.
Добувають оксиди металів ІІА-підгрупи не прямою взаємодіює з киснем, оскільки це був би дуже дорогий спосіб, а при розкладанні солей, найчастіше - карбонатів. Однак розкладання карбонату барію проходить при високій температурі (1625оС), тому для добування ВаО розкладають нітратну сіль:
MgCO3 à MgO + CO2,CaCO3 à CaO + CO2,4Ba (NO3) 2 à 2BaO + 4NO2 + O2.
Магній та елементи підгрупи кальцію утворюють пероксиди МеО2 і супероксиди (надпероксиди) МеО4. Пероксиди - білі тверді речовини, які можна вважати солями Гідроген пероксиду, тому у присутності води вони піддаються необоротному гідролізу:
СaО2 + 2H2O à Ca (OH) 2 + H2O2.
Стійкість пероксидів зростає у ряді:
BeO2<MgO2<CaO2<SrO2<BaO2.
Пероксид барію використовується для одержання Гідроген пероксиду:
BaO2 + 2H2O à Ba (OH) 2 + H2O2,BaO2 + H2SO4 à BaSO4↓+ H2O2.
Cупероксиди - речовини жовтого кольору, менш стійкі, ніж пероксиди, утворюються як побічний продукт при добуванні пероксидів.
Гідриди s-металів ІІ групи - тверді речовини, в яких атоми Гідрогену перебувають у ступені окиснення -1. При безпосередній взаємодії з воднем вдається одержати тільки гідриди лужноземельних металів, а BeH2 і MgH2 утворюються через обмінні реакції з гідридом літію в етерних розчинах, наприклад:
2LiH + BeCl2 à BeH2 + 2LiCl.
Гідрид берилію - типово ковалентна сполука, яка нагадує за властивостями AlH3, у MgH2 більш чітко виявляється йонний зв’язок, а в гідридах лужноземельних металів йонний зв’язок переважає. Всі гідриди є сильними відновниками, при розчиненні у воді вони розкладаються з виділенням водню:
MeH2 + 2H2O à Mе (OH) 2 + H2.
Гідроксиди s-металів ІІ групи складу Ме (ОН) 2 - білі кристалічні речовини. Для деяких з них застосовуються тривіальні назви: Сa (OH) 2 - гашене вапно, або вапняне молоко, Ba (OH) 2 - баритова вода.
Розчинність гідроксидів збільшується по підгрупі згори вниз: Be (OH) 2, Mg (OH) 2 і навіть Ca (OH) 2 належать до малорозчинних сполук, розчинність Sr (OH) 2 і Ba (OH) 2 дещо краща. Сила основ теж зростає по підгрупі: Ве (ОН) 2 - слабка амфотерна основа, Mg (OH) 2 - основа середньої сили, а решта гідроксидів вважаються сильними основами - лугами.
Для всіх гідроксидів, крім Ве (ОН) 2, характерні типові основні властивості: взаємодія з кислотами, кислотними оксидами, кислими, основними і нормальними солями, з деякими неметалами подібно до лугів s-металів І групи. Наприклад:
Ca (OH) 2 + 2HNO3 à Ca (NO3) 2 + 2H2O, Ca (OH) 2 + CO2 à CaCO3↓ + H2O, Ca (OH) 2 + 2NaHCO3 à CaCO3↓+ Na2CO3 + 2H2O, Ba (OH) 2 + FeOHCl2 à BaCl2 + Fe (OH) 3↓, Ba (OH) 2 + Na2SO4 à BaSO4↓ + 2NaOH, 2Ca (OH) 2 + Cl2 à CaCl2 + Ca (ClO) 2 + 2H2O.
Щодо гідроксиду берилію, то його амфотерний характер можна виразити рівняннями реакцій як з кислотами, так і з лугами:
Be (OH) 2 + H2SO4 à BeSO4 + 2H2O,
Be (ОH) 2 + 2KOH (р-н) à Na2 [Be (OH) 4],
Be (OH) 2 + 2NaOH (to, сплавлення) à Na2BeO2 + H2О.
Солі s-металів ІІ групи в основному - білі кристалічні речовини. Якщо солі мають інше забарвлення - це наслідок впливу аніона, наприклад, сіль Барій хромат BaCrO4 зобов’язана своїм яскраво жовтим кольором наявності хромат-аніона CrO42-. Розчинність солей (сульфатів, хлоридів, карбонатів) зменшується по групі згори вниз (рис.2).

Рисунок 2 - Розчинність солей Са, Sr, Ва у воді (моль/лН2О)
Це пояснюється зменшенням енергії гідратації йонів Ме2+ і збільшенням міцності кристалічної решітки. У такій самій закономірності зростає і термічна стійкість солей.
Солі, утворені лужними металами і аніонами сильних кислот, у воді не гідролізуються, а берилієві та магнієві солі таких кислот у розведених розчинах піддаються гідролізу, даючи кислу реакцію середовища, в яких рН<7, наприклад:
Mg (NO3) 2 + H2O ↔ (MgOH) NO3 + HNO3,Mg2+ H2O↔ MgOH+ + H+.
Галіди (або галогеніди) мають загальну формулу МеHal2, де Hal - F, Cl, Br, I. Це білі кристалічні сполуки, які одержують при безпосередній взаємодії елементів чи хлоруванням оксидів за наявності розжареного вугілля:
MgO + Cl2 + C à MgCl2 + CO.
Деякі галіди (MgCl2·6H2O) добувають з морської води при її випаровуванні.
Фториди різко відрізняються від інших галідів своєю малою розчинністю, наприклад, плавиковий шпат CaF2 має добуток розчинності усього ДР =10-11, що пояснюється дуже малими розмірами аніона F - порівняно з катіоном Ме2+. Інші галіди добре розчинні у воді (так, у 100г води при кімнатній температурі розчиняється близько 130г СаCl2). При випаровуванні вони виділяються з розчинів у формі кристалогідратів (наприклад, MgCl2·6H2O), які при нагріванні поводять себе по-різному:
BaCl2·2H2O à BaCl2 + 2H2O,
CaCl2·6H2O à BaCl2 + 6H2O,
MgCl2·6H2O à MgO + 2HCl + 5H2O.
Завдяки схильності утворювати кристалогідрати галогеніди є дуже гігроскопічними, на повітрі вони розпливаються, витягуючи атмосферну вологість.
Нітрати у кристалічному стані теж існують у формі кристалогідратів, крім нітрату барію, який частіше утворюється безводним, але можна виділити і кристалогідрати Ba (NO3) 2·nH2O (де n=2,4). За високих температур нітрати розкладаються за схемою:
2Ме (NO3) 2 à 2MeO + 4NO2 + O2.
Cульфати MeSO4- білі кристалічні речовини, розчинність яких зменшується у міру зростання порядкового номера металу. BeSO4 і MgSO4 добре розчиняються у воді, а розчинність СаSO4, SrSO4 і BаSO4 на 100г води становить відповідно 0, 202г; 0,014г; 0,0002г. Сульфати SrSO4 і BaSO4 кристалізуються без кристалізаційної води, а сульфати кальцію і магнію - у формі кристалогідратів СаSO4·2H2O і MgSO4·7H2O. Останню формулу іноді записують у вигляді комплексної сполуки, яка містить у зовнішній сфері тільку одну молекулу води: [Mg (H2O) 6] SO4·H2O.
Карбонати МеСО3 - білі кристалічні речовини, важкорозчинні у воді, причому розчинність, як і у сульфатів, зменшується по підгрупі згори вниз. Розчинити карбонат металу ІІА-підгрупи вдається тільки хімічним шляхом, пропускаючи вуглекислий газ через їх завіси (взбовтані у воді роздрібнені частинки кристалічного осаду), чи, використовуючи амоній хлорид:
MgCO3 (кр) + CO2 + H2O à Mg (HCO3) 2 (р),
CaCO3 (кр) + 2NH4Cl à CaCl2 (р) + 2NH3 + H2O + CO2.
2.1.5 Застосування S-металівIIА-ПІДГРУПИ ТА ЇХ СПОЛУК
Берилій використовують для виготовлення інтерметалічних сполук - берилідів складу МеВе12 (де Ме - Ti, Nb, Ta, Mo) чи MeBe11 (де Me - Nb, Ta), які мають високу температуру плавлення і не окиснюються навіть при нагріванні до 1200-1600оС. Крім того, берилій застосовують як легуючий компонент у багатьох сплавах, який надає їм підвищену корозійну стійкість, велику міцність і твердість. Найціннішими сплавами є берилієві бронзи, які використовують у літакобудівництві, електротехніці тощо. В атомних реакторах берилій і оксид берилію ВеО використовують як сповільнювачі і відбивачі (ОТРАЖАТЕЛИ) нейтронів. У суміші з препаратами радію Ве є джерелом нейтронів, що утворюються при дії альфа-частинок:
94Be + 42He à 126C + 10n.
Оксид берилію застосовують як хімічно стійкий вогнестікий матеріал для виготовлення тиглів і спеціальної кераміки, ВеО входить до складу деяких склоутворюючих сумішей. Сполуки берилію отруйні!
Магній в основному використовується для виробництва "надлегких" сплавів (таких як дюралімін, електрон, магналій, гідроналій, необхідних у машинобудівництві та авіації); в металургії - як розкислювач і десульфуючий агент, оскільки він відновлює оксиди і сульфіди з утворенням важкорозчинних у розплавлених металах сполук; у металотермії - для виробництва Ti, Zr, V, U та ін. Суміші порошку магнію з окисниками використовують для освітлювальних і запалювальних ракет, снарядів, у фото - і освітлювальній техніці.
Оксид магнію, або палену магнезію MgO застосовують при виробництві чистого магнію як наповнювач гуми для очищення нафтопродуктів при виготовленні вогнестійкої цегли, будівельних матеріалів.
Хлорид магнію MgCl2 використовують для одержання чистого магнію, а також у великих кількостях для виробництва магнезіального цементу, який виробляють, змішуючи попередньо прожарений MgO з 30% розчином MgCl2. При поступовому висиханні утворюються полімерні ланцюги - біла тверда маса, стійка відносно до кислот і лугів.
Кальцій вводять у сплави заліза для видалення з них вуглецю та сірки, а також використовують для добування гідриду і карбіду кальцію. Гідроксид кальцію Са (ОН) 2 (вапняне молоко, або гашене вапно) застосувють як дешева розчинна основа. Хлорид кальцію завдяки його високій гігроскопічності застосовують як зневоджуючий засіб. Нітрат кальцію - мінеральне добриво.
Сульфат кальцію поряд з іншими сполуками широко використовують для виробноцтва в’яжучих матеріалів.
Застосування природних різновидів карбонату кальцію дуже поширене. Вапняк СаСО3 є вихідною сировиною для одержання важливих будівельних матеріалів - вапна і цементу, крейда використовується як мінеральний барвник і основа для полірувальних засобів, мармур - для скульптурних робіт, виготовлення електротехнічних щитів.
Стронцій та його сполуки застосовуються менше, ніж кальцій. Амальгама стронцію застосовується для добування двохвалентних сполук рідкоземельних елементів. Металевий стронцій додають до сплавів магнію, алюмінію, свинця, нікелю та міді. Сплави на основі Sr і Mg використовують для створення вакууму в термоіонних перетворювачах. Нітрати стронцію використовують у піротехниці для виготовлення сумішей, що згоряють червоним полум’ям.
Барій використовують в антифрикційних сплавах на основі свинцю у вакуумній техніці, а в останній час - у поліграфії, де сплави на основі Ba-Pb майже зoвсім витіснили сплави Pb-Sb. Розчин Ва (ОН) 2 - баритова вода - лабораторний реактив для відкриття СО2. Нітрат барію Ba (NO3) 2 застовується у виробництві сигнальних ракет для забарвлення вогнів зеленим кольором. Солі барію на відміну від солей Са і Sr отруйні!
3. В’яжучі матеріали
В’яжучими матеріалами (або просто в’яжучими) називаються порошкоподібні речовини, що при контакті з водою перетворюються у пластичну масу, яка загустіває і переходить у твердий міцний стан. В'яжучі використовуються у будівельних розчинах (для скріплення цегли та інших елементів споруд), для виготовлення бетону, будівельних деталей і конструкцій.
До в’яжучих належать: вапно, гіпси, цементи.
Вапно одержують при випалюванні в шахтних пічах вапняка, який піддається термічній дисоціації із значним поглинанням теплоти
CaCO3 (to) à CaO + CO2.
Вапняк застосовують у багатьох галузях промисловості, а також у сільскому господарстві для нейтралізації закислених грунтів. Однак найчастіше вапно змішують у певній пропорції з піском і водою, отримуючи так званий вапняний розчин
СаO + H2O à Ca (OH) 2,
який поступово твердіє внаслідок кристалізації малорозчинного гідроксиду кальцію, утворення кристалічного СаСО3 (за рахунок повітряної вуглекислоти) і одночасного утворення силікатів кальцію
Ca (OH) 2 + CO2 à CaCO3 + H2O,
2Ca (OH) 2 + SiO2 à Ca2SiO4 + 2H2O.
Завдяки виділенню досить великої кількості води при твердінні вапняного розчину в побудованих спорудах довгий час зберігається вологість.
Цемент має помітну перевагу над вапняком. Крім того, що він усуває довгочасну вологість споруд, цемент характеризується здатністю затвердівати не тільки на повітрі, але й під водою.
Цемент - зеленувато-сірий порошок, що складається з суміші різних силікатів і алюмінатів кальцію - переважно складу Ca3SiO5, Ca2SiO4, Ca3 (AlO3) 2. Атоми Al і Si схильні до утворення гетероланцюгових полімерів, в основі яких містяться зв’язки Si-O-Si і Al-O-Al. Залежно від масового співвідношення у цементі Al і Si, він поділяється на портландцемент (силікатний) і глиноземний (алюмінатний). Цементи одержують при випалюванні тонкоподрібненої суміші вапняку і глини, багатою вмістом алюмінію. При цьому утворюються силікати і алюмінати кальцію і виділяєтся вуглекислий газ. Ретельно розмолоту після випалювання масу (клінкер) змішують з водою, внаслідок чого утворюється тістоподібна суміш, яка поступово твердіє - відбувається "тужавіння" цементу згідно із схемами:
Ca3SiO5 + 5H2O à Ca2SiO4·4H2O + Ca (OH) 2,Ca2SiO4 + 4H2O à Ca2SiO4·4H2O, Ca3 (AlO3) 2 + 6H2O à Ca3 (AlO3) 2·6H2O.
Як видно при "тужавінні" проходять процеси гідратації, яка завершується поступовою поліконденсацією складових частин клінкеру і утворенням високомолекулярних полімерних сполук - алюмінатів і силікатів кальцію. Причому, твердість цементу продовжує зростати протягом тривалого часу, оскільки відбувається поширення процесів гідратації у глибину цементних зерен.
Гіпси - палений гіпс, або алебастр CaSO4·1/2H2O (іноді його формулу записують у подвоєній формі: 2CaSO4·H2O) і гіпсовий камінь CaSO4·2H2O, який зневоджують нагріванням до 150-180оС до складу CaSO4·1/2H2O. При змішуванні напівгідрату сульфату кальцію з водою відбувається гідратація, внаслідок чого маса твердіє та кристалізується
CaSO4·1/2H2O +H2Oà CaSO4·2H2O.
На цій властивості базується застосування гіпсу для виготовлення панелей, будівельних плит, барельєфів, зліпків з різних предметів тощо.
4. Жорсткість води
Важливою обставиною є те, що на відміну від карбонату кальцію СаСО3 кисла сіль - гідрокарбонат кальцію Ca (HCO3) 2 - розчиняється у воді. Завдяки цьому у природі протікають цікаві процеси. Коли холодна дощова чи річкова вода, насичена вуглекислим газом, проникає під землю і попадає на вапняки, то відбувається їх поступове розчинення
Са СО3 (кр) + СО2 + Н2О à Ca (HCO3) 2 (р-н).
А в тих місцях, де насичена гідрокарбонатом вода виходить на поверхню землі і нагрівається соняшними промінями, проходить зворотна реакція
Ca (HCO3) 2 (р-н) àСа СО3 (кр) ↓ + СО2 + Н2О.
Так, у природі відбувається перенесення великих мас речовини. У результаті під землею можуть утворюватися величезні провалля та перечери із сталактитами.
Природна вода, яка містить розчинені гідрокарбонати кальцію та магнію, називається жорсткою. І відповідно жорсткість - це наявність у природній воді розчиненних солей кальцію та магнію.
Присутність у воді значних кількостей солей кальцію та магнію шкодить безпечному використанню води для технічних потреб. Так, при тривалій роботі парових котлів з жорсткою водою їх стінки поступово покриваються щільною плівкою накипу, який погано проводить тепло і робота котла стає неекономічною: так, шар накипу товщиною 1мм підвищує витрата палива приблизно на 5%. З іншого боку, ізольовані від води шаром накипу стінки котла нагріваються до високих температур, покриваються тріщинами і вздуттями. При цьому вони втрачають міцність, що може призвести до вибуху. Жорсткість набагато збільшує витрачання миючих засобів при пранні і погіршує якість тканин, оскільки катіони Са2+ і Mg2+ утворюють з милами (загальний склад мил СnH2n+1COONa) нерозчинні солі вищих карбонових кислот (пластівці складу Ca (СnH2n+1COO) 2↓), які осідають на випраних речах. У воді з високою жорсткістю погано розварюються овочі та м’ясо, тому що катіони кальцію утворюють з білками харчових продуктів нерозчинні сполуки. Солі магнію надають питній воді гіркого присмаку. Для запобігання зниженню органолептичних властивостей води її загальна жорсткість не повинна перебільшувати 7ммоль-екв. /л.
З цих причин проблеми, пов’язані з усуненням жорсткості води, набувають практичного значення.
4.1 Види жорсткості та її вимірюванняРозрізняють тимчасову і постійну жорсткість.
Тимчасова жорсткість води зумовлюється наявністю в ній Ca (HCO3) 2, Mg (HCO3) 2, а іноді - ще й Fe (HCO3) 2, тому таку жорсткість називають ще гідрокарбонатною. Її усувають простим кип’ятінням води, внаслідок чого розчинні гідрокарбонати розкладаються і випадають в осад у вигляді карбонатів чи гідроксидів - залежно від того, яка сполука має меншу розчинність
Ca (HCO3) 2 àСа СО3↓ + СО2 + Н2О,
Mg (HCO3) 2 àMg (ОH) 2↓ + 2СО2,Fe (HCO3) 2 àFe (ОH) 2↓ + 2СО2.
Нерозчинні продукти розкладання гідрокарбонатів осідають на стінках посудини у вигляді накипу, по забарвленню якого можна оцінити наявність заліза у воді: якщо воно відсутнє, то накип має білий колір, а при значній кількості Fe (HCO3) 2 - бурий.
Постійна, або некарбонатна жорсткість пов’язана з присутністю у воді кальцієвих і магнієвих солей сильних кислот - переважно сульфатів і хлоридів. Таку жорсткість не вдається усунути кип’ятінням, для цього необхідні спеціальні методи.
Сумарна кількість тимчасової і постійної жорсткості називається загальною жорсткістю води.
Будь-який тип жорсткості оцінюється кількістю мілімоль-еквівалентів солі в 1л води:
Ж = m/mекв. ·V·1000
Ж - жорсткість, ммоль-екв. /л; m - маса солі, що зумовлює жорсткість, г; m - еквівалента маса солі, г/моль-екв; V - об’єм, л. (У старих підручниках ще можна зустріти замість розмірності ммоль-екв. /л іншу назву цієї одиниці вимірювання - мг-екв/л).
Залежно від кількості розчиненої солі вода поділяються на типи: дуже м’яка (< 1,5мг-екв. /л), м’яка (1,5-3,0мг-екв. /л), середньожорстка (3-6мг-екв. /л), жорстка (6-9мг-екв. /л), дуже жорстка (<9мг-екв. /л). Останнім часом цей поділ дещо спростився і згідно з ним розрізнюють воду м’яку (до 2 ммоль-екв. /л), сереньожорстку (2-10 ммоль-екв. /л) і жорстку (більше 10 ммоль-екв. /л). За кордоном користуються умовними "градусами жорсткості", величини яких у різних країнах різні (1мг-екв. /л відповідає 2,8 німецьким, 3,5 англійським, 5 французьким і 50 американським "градусам жорсткості"). Жорсткість окремих природних вод коливається у широких межах. Для відкритих водоймищ вона залежить від сезону року і навіть від погоди. Найбільш м’якою природною водою є атмосферна (дощ, сніг), яка містить дуже мало розчинених солей.
4.2 Усунення жорсткості води
Усуненням жорсткості води, або пом‘якшенням води називається з метою руйнування чи видалення шкідливих солей, що зумовлюють жорсткість. Усунення жорсткості - це складова частина водопідготовки - комплексу заходів з обробки природної води, що використовуються для технічних і технологічних потреб. Водопідготовка здійснюється за допомогою спеціальних методів, що поділяються на механічні, хімічні та фізико-хімічні.
Механічний метод, який застосувується на першому етапі, полягає у тому, що із води шляхом відстоювання і фільтрації видаляються механічні домішки.
Хімічний метод реалізується, по-перше, при кип’ятінні води - у випадку гідрокарбонатної жорсткості, про що вже згадувалося раніше. По-друге, - при карбонатній жорсткості - через додавання до води певних реагентів, що вступають у хімічну взаємодію із забруднюючими речовинами і осаджують їх у вигляді нерозчинних сполук. Один із шляхів - додавання до води гашеного вапна Сa (OH) 2 чи соди Na2CO3, під час чого протікають реакції
CaSO4 (тв) + Na2CO3 (р-н) à CaCO3 (тв) ↓+ Na2SO4 (р-н),
Ca (HCO3) 2 (р-н) + Сa (OH) 2 (р-н) à CaCO3 (тв) ↓+ 2H2O (p),
MgSO4 (р-н) + Сa (OH) 2 (р-н) à Mg (OH) 2 (тв) ↓+ CaSO4 (тв) ↓.
Для видалення йонів Ca2+ і Mg2+ також застосовують фосфати лужних металів Na3PO4, буру Na2B4O7, поташ K2CO3 тощо. Наприклад:
3MgSO4 (р-н) + 2Na3PO4 (р-н) à Mg3 (PO4) 2 (тв) ↓ + 3Na2SO4 (р-н),
Ca (HCO3) 2 (р-н) +Na2B4O7 (р-н) à CaB4O7 (тв) ↓ + 2NaHCO3 (р-н),
CaSO4 (тв) + K2CO3 (р-н) à CaCO3 (тв) ↓+ К2SO4 (р-н).
Фізико-хімічні методи базуються на зворотному осмосі та електродіалізі, а також на використанні іоннообмінних властивостей деяких природних і синтетичних високомолекулярних матеріалів, які за природою йонів, що обмінюються, поділяються на катіоніти і аніоніти.
Рисунок 3 - Моделі катіоніта і аніоніта
Органічні та неорганічні іоніти нерозчинні у воді. Вони являють собою тримірний каркас, в який включені групи атомів, що несуть позитивний (у катіонітах) чи негативний (в аніонітах) заряд (рис.3).
| атіоніти - це найчастіше алюмосилікати приблизного складу Na2 [Al2Si2O8] ·nH2O, а також органічні смоли, які мають у своєму складі рухливі, здатні до обміну, катіони Н+ - їх позначають загальною формулою HR. Для пом’якшання воду пропускають через колону, заповнену шаром катіоніту, де проходять реакції йонного обміну Na2 [Al2Si2O8· (H2O) n] + Ca (HCO3) 2 ↔ ↔ 2NaHCO3 +Ca [Al2Si2O8· (H2O) n], Na2 [Al2Si2O8· (H2O) n] + CaSO4 ↔ ↔Na2SO4 + Ca [Al2Si2O8· (H2O) n]. У деяких випадках необхідно видалити з води не тільки катіони Ca2+ і Mg2+, але й аніони. Тоді використовують аніоніти, в яких обмінними групами є гідроксильні йони ОН-, що містяться на поверхні йонообмінної смоли. Якщо пропускати природну жорстку воду спочатку через катінообмінну колону (рис.4), а потім - через аніонообмінну, то вдається одержати майже повністю очищену воду. Катіонообмінна реакція: 2HR + Ca2+ àCaR2 + 2H+. Аніонообмінна реакція: 2ROH + SO42- à R2SO4 + 2OH-. |
Рисунок 4 - Схема катіонитної колони |
5. Тестові питання для самоперевірки
1. Чим визначається належність елементів до s-електронної родини?
а) атомною массою; б) порядковим номером;
в) кількістю енергетичних рівнів;
г) знаходженням всіх валентних електронів на зовнішньому s-підрівні.
2. Завдяки якому явищу залізо може існувати в α-, β-, γ - і δ-модифікаціях?
а) алотропія; б) ізотопія; в) поліморфізм; г) ізомерія.
3. До якої родини за природним походженням належить барій?
а) лужні; б) лужноземельні; в) рідкоземельні; г) поширені.
4. Зазначте найважчий метал.
а) Os; б) Cu; в) Pb; г) Hg.
5. Якою є температура, вище якої плавляться метали тугоплавкої групи?
а) >1000oC; б) >1350oC; в) >1800oC; г) >1500oC.
6. Метали виявляють таку характерну ознаку: підвищена хімічна стійкість відносно окиснювальних і агресивних реагентів. До якої класифікаційної групи належать такі метали?
а) рідкі; б) розсіяні; в) благородні; г) інертні.
7. Нижче якої величини повинна бути густина металу, щоб віднести його до групи легких металів?
а) <3,5г/см3; б) <5,0г/см3; в) <3,0г/см3; г) <5,3г/см3.
8. До якої групи металів належать технецій 43Tc, прометій 61Pm, полоній 84Po і всі метали з більшими, ніж у полонія атомними номерами?
а) рідкоземельні; б) рідкі; в) радіоактивні; г) розсіяні.
9. Назвіть найлегкоплавкіший метал.
а) Fr; б) Cs; в) Ga; г) Hg.
10. Який метал є найлегшим?
а) Li; б) Na; в) Mg; г) Al.
11. Які ступені окисненя можуть виявляти s-метали ІІ групи у сполуках?
а) +1; б) +2; в) -1; г) -2.
12. Які s-елементи не належать до металів?
а) Na, K; б) H, He; в) Sr, Sc; г) Fr, Ra.
13. Якими є значення стандартних електродних потенціалів для лужних металів?
а) < -2,5B; б) > -2,5B; в) >-0,43B; г) < -3,5B.
14. Яка властивість металічного зв’язку забезпечує теплопровідність металів?
а) ненасиченість; б) багатоелектронність;
в) багатоцентровість; г) ненапрямленість.
15. Що є причиною високих температур плавлення та великої механічної міцності d-металів?
а) утворення валентними електронами напрямленого ковалентного зв’язку між сусідніми атомами;
б) ненасиченність металічного зв’язку;
в) щільність пакування елементарної кристалічної комірки; г) наявність електронного газу, що переміщується по всьому кристалу металу.
16. Чим пояснити, що s-метали у природі ніколи не зустрічаються у вільному стані?
а) великими розмірами ефективних радіусів s-металів;
б) значеннями термодинамічних функцій;
в) тим, що атоми s-металів містять на зовнішньому енергетичному рівні по 1-2 електрони;
г) високою хімічною активністю s-металів і найсильнішими відновними властивостями.
17. Чому s-метали неможливо виділити із водних розчинів у вільному стані?
а) способи добування s-металів пов’язані з їх виділенням із розплавів;
б) s-метали мають великі негативні значення електродних потенціалів;
в) для s-металів притаманні металічні зв’язки у чистому вигляді;
г) атоми s-металів містять на зовнішньому енергетичному рівні по 1-2 електрони.
18. Як змінюються величини першого потенціалу йонізації s-металів?
а) збільшуються по групі зверху вниз;
б) зменшуються по групі зверху вниз;
в) від Li до Na зменшуються, а потім зростають;
г) від Li до Na зростають, а потім зменшуються.
19. Як пояснити існування у газуватому стані ковалентних молекул Na2, Cs2?
а) у газоподібному стані відсутня металічна кристалічна решітка, тому валентні електрони, що складали електронний газ, вивільняються для утворення ковалентних зв’язків;
б) зв’язки утворюються делокалізованими валентними електронами, які утримують разом позитивно заряджені йони;
в) всі s-метали мають на зовнішньому енергетичному рівні по одному-два електрони і можуть легко їх віддавати;
г) чим вище значення потенціалу йонізації, тим сильнішоє є поляризувальна дія катіону і тим вищою є його схільність до утворення ковалентних зв’язків.
20. Вкажіть метал, що не належить до лужних:
а) Ca; б) Sr; в) Mg; г) Ba.
21. Атоми яких металів містять незаповнений (n-1) d-енергетичний підрівень?
а) Li; б) Be; в) Cs; г) Mg.
22. Який метал дає фіолетове забарвлення при внесенні його парів у вогонь?
а) К; б) Li; в) Na; г) Cs.
23. Всі лужні метали у вільному стані - сріблясто-білі речовини, крім одного, у якого золотаве забарвлення. Який це метал?
а) Li; б) K; в) Rb; г) Cs.
24. Чому лужні метали неможливо використовувати як конструкційні матеріали?
а) атоми лужних металів мають великі радіуси;
б) лужні метали дуже м’які, пластичні, легко ріжуться ножем;
в) для лужних металів характерні низькі значення потенціалів йонізації;
г) лужні метали у вільному стані майже не утворюють ковалентних зв’язків.
25. Як можна одержати оксиди калію та натрію?
а) при безпосередній взаємодії металу з киснем;
б) тільки при нагріванні суміші пероксиду з надлишком металу при повній відсутності кисню;
в) при розкладанні гідроксиду;
г) при розкладанні нітрату.
26. Який лужний метал здатний взаємодіяти з азотом навіть при кімнатній температурі?
а) Li; б) Na; в) K; г) Rb.
27. З якою органічною сполукою лужні метали не вступають у взаємодію?
а) CH3COOH; б) HCOOH; в) CH3CH2OH; г) C5H12.
28. Зазначте формулу нітриду натрію.
а) NaNO2; б) Na3N; в) NaNO3; г) NaNH2.
29. Чим пояснюється зменшення температур плавлення для солей типу Me (NO3) 2 і MeCO3 зі збільшенням порядкового номера металу?
а) зменшуюються ефективні радіуси йонів Ме2+;
б) збільшується міцність зв’язків у солях;
в) збільшуються енергії кристалічних решіток;
г) зростає атомна маса металів.
30. Який метал взаємодіє з водою за схемою
2 Ме + 2Н2О à 2МеОН + Н2?
а) Ca; б) Sr; в) Cs; г) Mg.
31. Який s-метал утворює гідриди при безпосередній взаємодії з воднем за схемою Мe + H2à MeH2?
а) жоден; б) Ве; в) Са; г) всі.
32. Який метал при безпосередньому окисненні киснем дає оксид?
а) Li; б) Na; в) K; г) Ba.
33. Який метал при безпосередньому окисненні киснем дає пероксид?
а) Ca; б) Li; в) Na; г) Mg.
34. Який метал при безпосередньому окисненні киснем дає супероксид?
а) Ba; б) K; в) Be; г) Na.
35. В яку сполуку перетвориться FeCl3, якщо в його розчин внести декілька шматочків чистого натрію?
а) натрій не буде взаємодіяти з FeCl3;
б) FeCl2; в) Fe (OH) 3; г) Fe (OH) 2.
36. Чому при внесенні шматочків чистого натрію у розчин CuSO4 відбувається взаємодія Na не з CuSO4, а з водою за схемою 2Na + 2Н2О à 2NaОН + Н2?
а) із порівняння стандартних електродних потенціалів відповідних систем (табл.1) видно, що лужний метал легше відновлює Гідроген із води, ніж катіон малоактивного металу з розчину його солі;
б) натрій не здатний взаємодіяти з купрум (ІІ) - катіоном;
в) катіон Cu2+ виявляє слабкі окиснювальні властивості;
г) атоми Na і Cu містять по одному електрону на зовнішньому s-підрівні.
37. Які продукти утворюються внаслідок гідролізу натрій аміду NaNH2?
а) NaNО3 i H2; б) реакція не проходить;
в) NaOH і NH3; г) NaNО2 i H2.
38. Чим пояснити, що при взаємодії Na з дуже розведеним розчином НNО3 поряд з основним продуктом відновлення кислоти (NH3) виділяеться водень?
а) водень виділяється внаслідок розкладання кислоти у присутності натрію;
б) водень виділяється внаслідок розкладання кислоти у дуже розведеному розчині;
в) це є результатом побічної реакції - взаємодії Na з водою, наявною у розчині кислоти;
г) водень у даній реакції не виділяється.
39. Як називається клас сполук загального складу Mе2C2, що утворюються внаслідок безпосередньої взаємодії лужного металу з графітом?
а) карбонати; б) карбіди; в) карбоксилати; г) карбінади.
40. Чим пояснити, що в лабораторії та на виробництві не проводять спеціально реакцій між лужними металами і розчинами кислот?
а) лужні метали є дорогими реактивами;
б) лужні метали взаємодіють не з кислотою, а з водою, наявною у розчині кислоти;
в) ці реакції не мають промислового значення;
г) взаємодія лужних металів з кислотами супроводжується вибухом.
41. Як називаються розчини лужних металів у ртуті?
а) амальгами; б) суміші;
в) тверді розчини укоріненя; г) тверді розчини заміщення.
42. Нітрат якого лужного металу розкладається за такою схемою: 4MeNO3 à2 Me2O + 4NO2 + O2?
а) LiNO3; б) NaNO3; в) KNO3; г) RbNO3.
43. Для якого металу реакція з азотною кислотою протікає за такою схемою
8Ме + 10HNO3 (розв) à8МеNO3 + NH4NO3 + 3H2O?
а) всі лужні метали; б) всі лужноземельні метали;
в) жоден лужний метал; г) жоден лужноземельний метал.
44. Які метали добувають за допомогою натрійтермії?
а) всі лужні метали; б) всі лужноземельні метали;
в) Hg, Au, Ag; г) Ti, Zr, Nb, Ta.
45. Чому при внесенні лужних металів у водні розчини малоактивних солей виділяється водень?
а) лужні метали взаємодіють не з сіллю, а з водою;
б) лужні метали не здатні витісняти катіон малоактивного металу із розчину його солі;
в) велика активність лужних металів перешкоджує прямій взаємодії;
г) малоактивні метали не можуть витіснятися із розчинів їх солей.
46. З яким оксидом NaOH не вступає у взаємодію?
а) СаО; б) P2O5; в) Al2O3; г) NO2.
47. До якого типу окисно-відновних реакцій належить реакція NaH + H2O à NaOH + H2.
а) диспропорціонування; б) внутрішньомолекулярна;
в) міжмолекулярна; г) витіснення.
48. У скільки стадій може проходити гідроліз солі Cs2CO3?
а) одна; б) дві; в) три; г) п’ять.
49. Карбонат якого лужного металу розкладається при нагріванні до високих температур?
а) Rb2CO3; б) Na2CO3; в) К2CO3; г) Li2CO3.
50. Яку реакцію середовища виявляють натрієві солі слабких кислот внаслідок гідролізу?
а) кислу; б) нейтральну; в) лужну; г) гідроліз не протікає.
51. Яке практичне застосування має реакція
4КО2 + 2CO2 à 2K2CO3 + 3O2?
а) для одержання калій карбонату; б) у виробництві скла;
в) для поглинаня вуглекислого газу в протигазах і підводних човнах;
г) для нейтралізацію супероксиду калію.
52. Гідроксид якого лужного металу здатний розчиняти твердий Zn (OH) 2?
а) всі; б) жоден; в) тільки КОН; г) тільки NaOH.
53. Карбонати лужних металів плавляться без розкладання за винятком єдиної солі. Якої?
а) Li2CO3; б) К2CO3; в) Rb2CO3; г) Cs2CO3.
54. Яка сіль лужного металу не піддається гідролізу в розведеному водному розчині?
а) Cs2SO3; б) K3PO4; в) NaNO3; г) Rb2CO3.
56. З якою сполукою натрій гідроксид NaOH вступає в реакцію?
а) NH3; б) C6H14; в) F2; г) K2SO4.
57. При пропусканні хлору через гарячий розчин NaОН утворюється суміш двох солей. Одна з них - натрій хлорид NaCl. Який склад іншої солі?
а) NaClO4; б) NaClO3; в) NaClO2; г) NaClO.
58. З якою сполукою NaОН не вступає в реакцію?
а) NO2; б) Al (OH) 2NO3; в) NaHCO3; г) CsNO3.
59. В якому рядку формули карбонатів лужних металів наведені у порядку зростання стійкості до підвищених температур?
а) Cs2SO3, K2SO3, Na2SO3, Li2SO3;
б) Li2SO3, Na2SO3, K2SO3, Cs2SO3;
в) Na2SO3, Li2SO3, Cs2SO3,K2SO3;
г) Na2SO3, K2SO3, Li2SO3, Cs2SO3.
60. Яка сполука утвориться найвірогідніше при змішуванні розчинів NaOH і Fe (NO3) 3 у молярному співвідношенні 1: 1?
а) Fe (OH) 3; б) Fe (OH) 2NO3; в) NaFeO2; г) Fe (OH) (NO3) 2.
61. Чим пояснити, що розчинність сульфатів і карбонатів лужноземельних металів зменшується по групі згори униз?
а) зростанням зарядів атомних ядер;
б) зменшенням енергії гідратації йонів Ме2+ і збільшенням міцності кристалічної решітки;
в) підвищенням атомної маси металів;
г) зменшенням міцності кристалічних решіток.
Похожие работы
... сполуки”, а також зорієнтовані на їх загальний розвиток. Об’єкт дослідження: процес вивчення теми “Залізо та його сполуки” у класах з поглибленим вивченням хімії,мтворчо та інтелектуально обдарованими учнями. Предмет дослідження: навчання особливості організації та змісту урочної навчальної діяльності учнів. Дане педагогічне дослідження має переваги над існуючою традиційною технологією, яка ...
... класах проходить по-різному. Необхідна її адаптація до конкретних умов проведення [20]. РОЗДІЛ 3. МЕТОДИЧНІ ЗАБЕЗПЕЧЕННЯ ПРОВЕДЕННЯ УРОКІВ З ТЕМИ „МЕТАЛИ” 3.1 Тематичне планування теми „Метали” Тема „Метали” вивчається в 9 класі в середині другого семестру навчального року, на вивчення теми передбачено програмою 22 години. Тематичне планування представлено в табл. 3.1. Таблиця ...
... створюють одноманітні діаграми стану, властивості змінюються ідентично. Були розроблені спеціальні діаграми склад - властивість. Такі діаграми є цінним доповненням до діаграм стану сплавів, тому що вони для кожної системи характеризують зміну тієї або іншої властивості сплаву в залежності від складу. На рис.1.7.2. у верхньому ряду зображені діаграми стану, у середньому - діаграма зміни твердості, ...
... Переміщення металів всередині рослини обумовлюється хімічними особливостями елементу – так, кадмій, цинк, свинець малорухливі, а мідь – надзвичайно рухлива [33, 34]. Отже, питання шляхів надходження та особливостей накопичення важких металів у рослинній продукції і досі не має чітко визначених положень та закономірностей. На підставі аналізу літературних джерел можна зробити висновок, що кожен із ...

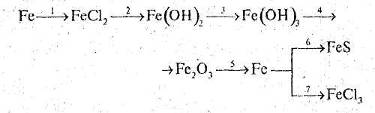







0 комментариев