Навигация
При уменьшении температуры химическое равновесие сместится в сторону продуктов реакции
4. При уменьшении температуры химическое равновесие сместится в сторону продуктов реакции.
Второй уровень5.
| Дано: m(Al)=10,8г | 1. Определяем количество атомов алюминия
| |
| N(Al) — ? | ||
| Ответ: | в 10,8г алюминия содержится 1,2∙1023 молекул. | |
6.
| Дано: V(H2)=6,72л | х 6,72л FeO + H2 = Fe + H2O 1моль 1моль 72г/моль 22,4л/моль 72г 22,4л 1. Определяем массу феррум (II) оксида х:72г=6,72л:22,4л
| |
| m(FeO) — ? | ||
| Ответ: | масса феррум (II) оксида – 21,6г. | |
7. б) AlCl3+3NaOH=Al(OH)3↓+3NaCl
Третий уровень8. а) Pb(NO3)2+K2S=PbS↓+2KNO3
9. Zn+2HCl=ZnCl2+H2
ZnCl2+2NaOH=Zn(OH)2↓+2NaCl
Zn(OH)2+H2SO4=ZnSO4+2H2O
10.
| Дано: ν(SO2)=1,5моль | SO2+O2=SO3 SO3+H2O=H2SO4
1,5 моль хг SO2 → H2SO4 1моль 1моль 98г/моль 98г 1. Определяем массу сульфатной кислоты 1,5моль:1моль=х:98г
| |
| m(H2SO4) — ? | ||
| Ответ: | 1,5 моль сульфур (IV) оксида пойдет на образование 147г сульфатной кислоты. | |
Задачи
Первый уровень
1.
| Дано: CaCO3 | 1. Определяем массовую долю кальция в кальций карбонате
| |
| W(Ca) — ? | ||
| Ответ: | массовая доля кальция в кальций карбонате – 40%. | |
2.
| Дано: N(CO2)=36∙1028 | 1. Определяем количество вещества карбон (IV) оксида
| |
| ν(CO2) — ? | ||
| Ответ: | количество вещества карбон (IV) оксида – 6 моль. | |
3.
| Дано: Д(Н2)=8 | 1. Определяем относительную молекулярную массу метана
| |
| Mr(метана) — ? | ||
| Ответ: | относительная молекулярная масса метана – 16. | |
4. Уменьшение концентрации исходных веществ вызывает смещение химического равновесия в сторону исходных веществ, т.е. СО и О2.
Второй уровень5.
| Дано: m(Cu)=128г | хг 128г CuO + H2 = Cu + H2O 1моль 1моль 80г/моль 64г/моль 80г 64г 1. Определяем массу купрум (II) оксида х:80г=128г:64г
| |
| m(CuO) — ? | ||
| Ответ: | в реакцию может вступить 160г купрум (II) оксида для получения 128г меди. | |
6. б) Na2CO3+2HNO3=2NaNO3+H2O+CO2
7.
| Дано: m(Fe)=28г m(O)=12г m(Fe2O3)=40г | 1. Определяем массовую долю феррума
2. Определяем массовую долю оксигена
| |
| W(Fe) — ? W(O) — ? | ||
| Ответ: | в феррум (III) оксиде массовая доля феррума – 70%, массовая доля оксигена – 30%. | |
8. Si+O2=SiO2
2W+3O2=2WO3
4As+3O2=2As2O3
Os+2O2=OsO4
9. N2+O2=2NO
2NO+O2=2NO2
4NO2+2H2O+O2=4HNO3
NaOH+HNO3=NaNO3+H2O
10.
| Дано: N:O=7:16 | N:O=7:16 N:O=14:32 число атомов нитрогена – 1, оксигена – 2, отсюда – NO2 | |
| Формула — ? | ||
| Ответ: | формула соединения – NO2. | |
Задачи
Первый уровень
1.
| Дано: CuSO4 | 1. Определяем массовую долю купрума в купрум (II) оксиде
| |
| W(Cu) — ? | ||
| Ответ: | массовая доля купрума – 40%. | |
2. Н2 – два атома гидрогена
3Fe – три атома феррума
2NaOH – две молекулы сложного вещества, каждая из которых состоит из одного атома натрия, одного атома оксигена и одного атома нитрогена.
3.
| Дано: H2S | 1. Определяем относительную плотность сероводорода по водороду
| |
| Д(Н2) — ? | ||
| Ответ: | относительная плотность сероводорода по водороду – 17. | |
4. Повышение давления смещает химическое равновесие в сторону образования карбон (IV) оксида, а понижение давления – в сторону исходных веществ, т.е. СО и О2.
Второй уровень5.
| Дано: m(O2)=8г | 1. Определяем объем кислорода
| |
| V(O2) — ? | ||
| Ответ: | объем 8г кислорода – 5,6л. | |
6.
| Дано: m(CuO)=320г | 320г хг CuO + 2HNO3 = Cu(NO3)2 + H2O 1моль 2моль 80г/моль 63г/моль 80г 63г 1. Определяем массу нитратной кислоты 320г:80г=х:63г
| |
| m(HNO3) — ? | ||
| Ответ: | на растворение 320г купрум (II) оксида пойдет 252г нитратной кислоты. | |
7. BaCl2+2AgNO3=Ba(NO3)2+2AgCl↓
Третий уровень8. 2Mg+O2=2MgO
MgO+2HCl=MgCl2+H2O
MgCl2+2AgNO3=Mg(NO3)2+2AgCl↓
Mg(NO3)2+Na2CO3=MgCO3+2NaNO3
9.
| Дано: υ(CaCO3)=20моль HNO3 | 20моль хл CaCO3 + HNO3=Ca(NO3)2+H2O+ CO2 1моль 1моль 22,4л/моль 22,4л 1. Определяем объем карбон (IV) оксида 20моль:1моль=х:22,4л
| |
| V(CO2) — ? | ||
| Ответ: | объем газа 448л. | |
10.
| Дано: С:Н=3:1 | 1. Определяем формулу вещества. С:Н=3:1С:Н=12:4 число атомов карбона – 1, гидрогена – 4 формула СН4 | |
| Формула — ? | ||
| Ответ: | формула соединения СН4. | |
Задачи
Первый уровень
1. 2Fe – два атома феррума.
2Р2О5 – две молекулы сложного вещества, каждая из которых состоит из двух атомов фосфора и пяти атомов оксигена.
4О2 – четыре молекулы простого вещества – кислорода, каждая из которых состоит из двух атомов оксигена.
S – один атом сульфура.
CuSO4 – одна молекула сложного вещества, которая состоит из одного атома купрума, одного атома сульфура и четырех атомов оксигена.
2.
| Дано: m(CO2)=8,8г | 1. Определяем число молекул карбон (IV) оксида
| |
| N(CO2) — ? | ||
| Ответ: | в 8,8 г карбон (IV) оксида содержится 1,2∙1023 молекул. | |
3.
| Дано: СО2 | 1. Определяем относительную плотность по водороду
| |
| Д(Н2) — ? | ||
| Ответ: | относительная плотность карбон (IV) оксида по водороду – 22. | |
4. Увеличение концентрации кислорода сместит химическое равновесие в сторону образования продукта реакции.
5.
| Дано: ν(Mg)=5моль HCl | 5моль хл Mg + 2HCl = MgCl2 + H2 1моль 1моль 22,4л/моль 22,4л 1. Определяем объём водорода 5 моль: 1 моль = х : 22,4 л
| |
| V(H2) — ? | ||
| Ответ: | объём водорода, который выделяется при действии хлоридной кислоты на 5 моль магния, равен 112 л. | |
6. SO2 + H2O = H2SO3
NaOH + SO2 = Na2SO3 + H2O
7.
| Дано: m (NaOH) = 40 г H2SO4 | 40 г х г 2 NaOH + H2SO4 = Na2SO4 + 2H2O 2 моль 1 моль 40 г/моль 142 г/моль 80 г 142 г 1. Определяем массу натрий сульфата 40 г : 80 г = х : 142 г
| |
| m (Na2SO4) — ? | ||
| Ответ: | при действии сульфатной кислоты на 40 г натрий гидроксида образуется 71 г натрий сульфата. | |
8. 2 Na + 2H2O = 2NaOH + H2
2NaOH + H2SO4 = Na2SO4 + 2H2O
Na2SO4 + BaCl = BaSO4¯ + 2NaCl
NaCl + AgNO3 = NaNO3 + AgCl¯
9.
| Дано: n (NaOH) = 3 моль Сl(NO3)3 | 3 моль х г Сl(NO3)3 + 3 NaOH = Cl(OH)3¯ + 3NaNO3 3 моль 1 моль 103 г/моль 103 г 1. Определяем массу хром (3) гидроксида 3 моль: 3 моль = х : 109 г
| |
| m (Cl(OH)3) — ? | ||
| Ответ: | в результате действия 3 моль натрий гидроксида на хром (III) нитрат образуется 103 г хром (III) гидроксида. | |
10. 1) 3Mg + 2H3PO4 = Mg3(PO4)2 + 3H2
2) 3MgO + 2H3PO4 = Mg3(PO4)2 + 3H2O
3) 3Mg(OH)2+ 2H3PO4 = Mg3(PO4)2 + 6H2O
Вариант 8 Задачи Первый уровень1.
| Дано: SO3 | 1. Определяем массовую долю сульфура
| |
| W(S) — ? | ||
| Ответ: | массовая доля сульфура в сульфур (VI) оксиде 40% | |
2.
| Дано: m (H2SO4) = 392 г | Определяем количество вещества сульфатной кислоты
| |
| n(H2SO4) — ? | ||
| Ответ: | 4 моль сульфатной кислоты | |
3.
| Дано: C3H8 | Определяем относительную плотность пропана по водороду
| |
| D(H2) — ? | ||
| Ответ: | относительная плотность пропана по водороду 22 | |
4. Повышение температуры будет способствовать смещению равновесия в сторону исходных веществ
Второй уровень5.
| Дано: m (CuO) = 16 г | 16 г х л CuO + H2= Cu + H2 1 моль 1моль 80 г/моль 22,4 л/моль 80 г 22,4 л 1. Определяем объём водорода 16 г : 80 г = х : 22,4 л
| |
| V (H2) — ? | ||
| Ответ: | объём водорода, необходимый для восстановления 16 г купрум (2) оксида 4,48 л | |
6. а) Ca(NO3)2+Na2CO3 = CaCO3¯ + 2NaNO3
7.
| Дано: n (Na) = 1,5 моль H2O, н.у. | 1,5 моль х л 2Na + 2H2O = 2NaOH + H2 2моль 1 моль 22,4 л/моль 22,4 л 1. Определяем объём водорода 1,5 моль : 2 моль = х : 22,4 л
| |
| V(H2) — ? | ||
| Ответ: | в результате действия воды на 1,5 моль натрия выделилось 33,6 л водорода | |
Третий уровень
8. 2Na +2HOH = 2NaOH + H2
Na2O + H2O = 2NaOH
9. Ba + 2H2O = Ba(OH)2 +H2
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Ba(NO3)2 +Na2CO3 = BaCO3¯ + 2NaNO3
BaCO3 + 2HNO3 = Ba(NO3)2 + H2O + CO2
10.
| Дано: C:O = 3:8 | C:O = 3:8 C:O = 12:32 число атомов С – 1 число атомов О –2, отсюда СО2 | |
| формула — ? | ||
| Ответ: | СО2 | |
Задачи
Первый уровень
1.
| Дано: C2H6 | 1. Определяем относительную плотность этана по водороду
| |
| D(H2) - ? | ||
| Ответ: | относительная плотность этана по водороду 15 | |
2.
| Дано: n (N2) = 2 моль | 1. Определяем число молекул азота в 2 моль азота
N(N2) = 2 моль∙6∙1023молекул/моль = 12∙1023 молекул 2. Определяем число атомов нитрогена 1 молекула азота N2 сод. 2 атома нитрогена 12∙1023 молекул — х
| |
| N(N2) - ? N(N) — ? | ||
| Ответ: | азот количеством вещества 2 моль содержит 12∙1023 молекул азота и 24∙1023 атомов нитрогена. | |
3.
| Дано: n (О2) = 2 моль | 1. Определяем объём 2 моль кислорода
V(O2) = 2 моль∙22,4 л/моль = 44,8 л | |
| V(O2) — ? | ||
| Ответ: | занимают объём 44,8 л | |
4. При понижении температуры химическое равновесие сместится в сторону исходного вещества, т.е. HBr
Второй уровень5.
| Дано: n (HNO3) = 2 моль KOH | 2 моль х г KOH + HNO3 = KNO3 + H2O 1 моль 1 моль 101 г/моль 101 г 1. Определяем массу калий нитрата 2 моль : 1 моль = х : 101 г
| |
| m (KNO3) — ? | ||
| Ответ: | в результате нейтрализации едкого калия 2 моль нитратной кислоты образовалось 202 г калий нитрата. | |
6. а) AlCl3 + 3AgNO3 = Al(NO3)3 + 3AgCl¯
7.
| Дано: n (Ca(OH)2) = 2 моль | x 2 моль Ca + 2HOH = Ca(OH)2 + H2 1 моль 1 моль 1. Определяем количество вещества кальция х : 1 моль = 2 моль : 1 моль
| |
| n (Ca) — ? | ||
| Ответ: | для получения 2 моль кальций гидроксида в реакцию с водой должно вступить 2 моль кальция | |
8. 1) Сu + Cl2 = CuCl2
2) CuO + 2HCl = CuCl2 + H2O
3) Cu(OH)2 + 2HCl = CuCl2 + 2H2O
9. 1) 2Ca + O2 = 2CaO
2) CaO + H2O = Ca(OH)2
3) Ca(OH)2 + 2HCl = CaCl2+ 2H2O
4) CaCl2+Na2SO4 = CaSO4¯ + 2NaCl
10.
| Дано: m (Zn и Ag) = 10 г V (H2) = 1,12 л | x г 1,12 л Zn + 2HCl = ZnCl2 + H2 1 моль 1 моль 65 г/моль 22,4 л/моль 65 г 22,4 л 1. Определяем массу цинка х : 65 г = 1,12 л : 22,4 л
2. Определяем массовую долю цинка в смеси
3. Определяем массовую долю серебра в смеси 100% - 32,5% = 67,5% | |
| W (Zn) — ? W (Ag) — ? | ||
| Ответ: | смесь состоит из 32,5% цинка и 67,5% серебра | |
Первый уровень
1.
| Дано: MgO | 1. Определяем массовую долю магния в оксиде магния
| |
| W(Mg) — ? | ||
| Ответ: | массовая доля магния в оксида магния 60%. | |
2.
| Дано: n (H2O) = 3 моль | 1. Определяем число молекул воды в 3 моль воды
N(H2O) = 3 моль∙6∙1023 молекул/моль=18∙1023молекул | |
| N(H2O) — ? | ||
| Ответ: | в 3 моль воды содержится 18∙1023 молекул. | |
3.
| Дано: HCl | Определяем относительную плотность хлороводорода по водороду
| |
| D(H2) - ? | ||
| Ответ: | относительная плотность хлороводорода по водороду 18,25. | |
4. При повышении давления химическое равновесие сместится в сторону образования аммиака NH3.
Второй уровень
5.
| Дано: V(O2)=16,8 л Al, н.у. | 16,8 л х моль 4Al + 3O2 = 2Al2O3 3 моль 2 моль 22,4 л/моль 67,2 л 1. Определяем количество вещества алюминий оксида 16,8 л : 67,2 л = х : 2 моль
| |
| n (Al2O3) - ? | ||
| Ответ: | в результате окисления алюминия 16,8 л кислорода образуется 0,5 моль оксида алюминия | |
6. а) MgSO4 + 2KOH = Mg(OH)2¯ +K2SO4
7.
| Дано: m(CaO)=280 г H2O | 280 г х г CaO + H2O = Ca(OH)2 1 моль 1 моль 56 г/моль 74 г/моль 56 г 74 г 1. Определяем массу кальций гидроксида 280 г : 56 г = х : 74 г
| |
| m(Ca(OH)2) - ? | ||
| Ответ: | в результате действия воды на 280 г кальций оксида образуется 370 г кальций гидроксида | |
8. CuO + H2SO4 = CuSO4 + H2O
9. 1) 4P + 5O2 = 2P2O5
2) P2O5 + 3H2O = 2H3PO4
3) H3PO4 + 3NaOH = Na3PO4 + 3H2O
4) 2Na3PO4 + 3Ca(NO3)2 = 6NaNO3 + Ca3(PO4)2¯
10.
| Дано: m(Fe) = 50 т W(Fe) = 0,7 | ||
| m(Fe2O3) - ? | ||
| Ответ: | ||
Задачи
Первый уровень
1.
| Дано: Ca3(PO4)2 | 1. Определяем массовую долю кальция
| |
| W(Ca)- ? | ||
| Ответ: | массовая доля кальция в кальций фосфате 38,7% | |
2.
| Дано: n(С2H12O6) = 6 моль | 1.Определяем число молекул глюкозы
N(C6H12O6)=6моль∙6∙1023молекул/моль=36∙1023 молекул 2. Определяем число атомов карбона в 1 молекуле C6H12O6 содержится 6 атомов в 36∙1023 молекул — х
| |
| N (C) - ? | ||
| Ответ: | в 6 моль глюкозы содержится 216∙10 23 атомов | |
3.
| Дано: D(O2) = 1,5 | 1.Определяем относительную молекулярную массу озона
Mr(O3) = 1,5∙32 = 48 | |
| Mr(O3) — ? | ||
| Ответ: | относительная молекулярная масса озона 48 | |
Похожие работы
... пособие по прикладной химии «Задачи по теоретическим основам химической технологии», составленное по материалам представленной работы. 3. Методика решения задач по теоретическим основам химической технологии Одна из главных задач химической науки и промышленности - получение необходимых человеку веществ (продуктов, материалов). Поэтому большинство учебных химических задач снизано с ...
... . Работа предназначена учителям химии, а также может быть полезна студентам педагогических вузов и колледжей. 2.2.ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Необходимость разработки элективного курса для учащихся 10-х классов «Решение задач по органической химии повышенного уровня сложности» обусловлена несколькими причинами. В соответствии с базисным учебным планом полной средней школы на изучение химии за 2 ...
... Сюда можно отнести и методы, называемые физико-химическими. Физические методы основаны на физических явлениях и процессах, биологические – на явлении жизни. Основные требования к методам аналитической химии: правильность и хорошая воспроизводимости результатов, низкий предел обнаружения нужных компонентов, избирательность, экспрессность, простота анализа, возможность его автоматизации. Выбирая ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
 ;
; 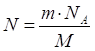
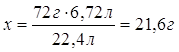
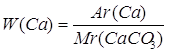
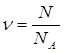
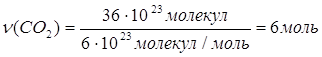
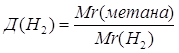 ;
; 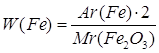
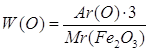
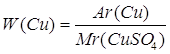
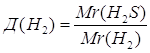
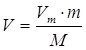
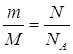 ;
; 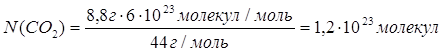
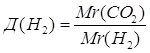
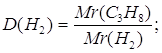
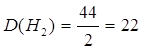
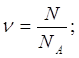
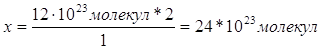
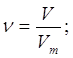
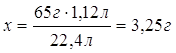
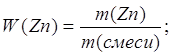
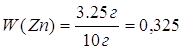 или 32,5 %
или 32,5 %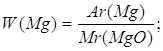
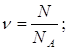
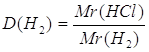
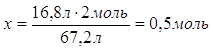
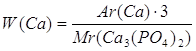
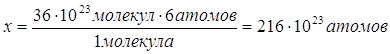
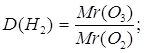

0 комментариев