Навигация
4. Конструкция.
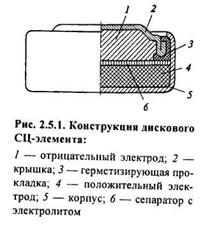
Конструкция серебряно-цинковых аккумуляторов существенно отличается от конструкции обычных щелочных или кислотных аккумуляторов. В серебряно-цинковых аккумуляторов положительные пластины изготавливаются из чистого тем или иным способом приготовленного серебра, а отрицательные – из окиси цинка в смеси с порошком металлического цинка. Положительные пластины отделены от отрицательных несколькими слоями гидратцелюлозной пленки, применение которой обусловлено тем, что через неё, с одной стороны хорошо диффундирует электролит, а с другой стороны она препятствует миграции коллоидных частиц окислов серебра от положительного электрода к отрицательному и произрастанию дендритов цинка в противоположном направлении.
Собранный пакет электродов помещается в пластмассовый сосуд и заливается химически чистой калиевой щелочью. Размеры электродов и сосудов подбираются таким образом, чтобы при заполнении аккумулятора электролитом электроды испытывали соответствующее боковое давление, обеспечивающее механическую устойчивость, предупреждающую осыпание активной массы электродов. Кроме того, при наличии бокового давления отпадает необходимость использования каких-либо жестких решёток и стоек, как это делается у обычных кислотных аккумуляторов.
5. Электрохимическая схема.
Электрохимическая схема серебряно-цинкового аккумулятора имеет вид:
– Zn | KOH | AgO, Ag +
6. Электрохимические процессы.
При зарядке аккумулятора (восстановление на электроде активных веществ) на аноде происходит окисление серебра до одновалентного иона:
2Ag + 2OH– =Ag2O + H2O + 2e–
с последующим окислением до иона двухвалентного серебра:
Ag + 2OH– = 2AgO + H2O + 2e–
На катоде происходит процесс восстановления:
+2Zn(OH)2 + 4e– = 2Zn + 4OH–
После того, как потенциал серебряного электрода достигнет величины потенциала выделения кислорода, главной реакцией становится реакция образования кислорода:
4OH– ® 2H2O + O2 + 4e–
Напряжение аккумулятора при этом снова возрастает и за время менее одного часа достигает величины 2,1 В. Продолжение заряда аккумулятора не только бесполезно, но и вредно, т.к. во первых аккумулятор уже не воспринимает емкости, а во вторых выделяющийся на серебряных электродах кислород окисляет целлофановую сепарацию и тем самым уменьшает её прочность. Кроме того, в результате наступающего электролиза цинкатного электролита на цинковых электродах начнется выделение цинка в виде дендритов, которые могут легко прокалывать сеперацию. Поэтому систематический перезаряд серебряно-цинкового аккумулятора резко снижает срок его службы.
При отборе электрического тока, т.е. при работе аккумулятора в режиме разряда, протекают следующие электрохимические процессы:
На аноде внутренней цепи происходит реакция окисления металлического цинка:
2Zn + 4OH– = ZnO + HOH + Zn(OH)2 + 4e–
На катоде внутренней цепи протекает реакция:
2AgO + 2e– + HOH = Ag2O + 2OH–
т.е. происходит реакция восстановления иона двухвалентного серебра до одновалентного иона и далее до чистого серебра по схеме:
Ag2O + 2e– + HOH = 2Ag + 2OH–
Суммарное уравнение записывается в виде:
2AgO + HOH + 2Zn = 2Ag + ZnO + Zn(OH)2
При заряде эта реакция идет в прямом направлении, а при разряде – в обратном.
Ц и н к
1. Электронное строение.
Zn 1s2 2s2 2p6 3s2 3p6 4s2 3d10
2. Положение в периодической системе элементов Д. И. Менделеева.
Элемент цинк (Zn) в таблице Менделеева имеет порядковый номер 30. Он находится в четвертом периоде второй группы.
3. Важнейшие физические свойства.
Цинк представляет собой синевато - белый металл, плавящийся при 419° С, а при 913° С превращающийся в пар; плотность его равна 7,14 г/см3. При обыкновенной температуре цинк довольно хрупок, но при 100-110° С он хорошо гнется и прокатывается в листы.
4. Взаимодействие с окислителями.
На воздухе цинк покрывается тонким слоем окиси или основного карбоната, предохраняющим его от дальнейшего окисления. Вода почти не действует на цинк, хотя он и стоит в ряду напряжений значительно левее водорода. Это объясняется тем, что образующаяся на поверхности цинка при взаимодействии его с водой гидроокись практически нерастворима и препятствует дальнейшему течению реакции.
Цинк является довольно активным металлом.
1. Он легко взаимодействует со многими неметаллами: кислородом, галогенами:
а) 2Zn + O2 = 2ZnO (оксид цинка)
Zn0 – 2e– = 2Zn2+
O2 + 4e–=2O22–
б) Zn + Cl2 = ZnCl2 (хлорид цинка)
Zn0 – 2e– = 2Zn2+
Cl2 + 2e–=2Cl–
2. При нагревании взаимодействует с водой:
Zn + H2O = ZnO + H2
Zn0 – 2e– = 2Zn2+
2H2O + 2e– = H20 + 2OH–
j(Zn0/Zn2+) = -0,763 В
j(2H2O/H2, OH–) = -0,414 В
j(Zn0/Zn2+)<j(2H2O/H2, OH–)Þ реакция возможна
3. Взаимодействует с щелочами:
– при взаимодействии с водным раствором щелочи образуется комплексная соль цинковой кислоты ( гидроксоцинкат натрия ).
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Zn0 – 2e– = 2Zn2+
2H2O + 2e– = H20 + 2OH–
j(Zn0/Zn2+) = -0,763 В
j(2H2O/H2, OH–) = -0,414 В
j(Zn0/Zn2+)<j(2H2O/H2, OH–)Þ реакция возможна
5. Взаимодействует с кислотами:
– с соляной кислотой с образованием хлорида цинка:
Zn + 2HCl = ZnCl2 + H2
2H+ + 2e– = H2
Zn - 2e– = Zn2+
j(Zn0/Zn2+) = -0,763 В
j(H+/H2)=0
j(H+/H2)> j(Zn0/Zn2+)Þ реакция возможна
– с серной кислотой с образование различных веществ в зависимости от концентрации кислоты:
Zn + 2H2SO4 конц.= ZnSO4 + SO2 + 2H2O
SO42- + 4H+ + 2e–® SO2 + 2H2O
Zn0 - 2e– = Zn2+
j(Zn0/Zn2+) = -0,763 В
j(SO42-,H+/SO2) = 0,438 В
jОК < jВОССТ Þ реакция возможна
3Zn + 4H2SO4 разб. = 3ZnSO4 + S + 4H2O
HSO4- + 7H+ + 6e- = S + 4H2O
Zn0 – 2e- = Zn2+
j(Zn0/Zn2+) = -0,763 В
j(SO4-, H+/S) = 0,35 В
jОК < jВОССТ Þ реакция возможна
– с азотной кислотой с образованием различным веществ в зависимости от концентрации кислоты:
Zn + 4HNO3 конц. = Zn(NO3)2 + 2NO2 + 2H2O
Zn0 – 2e- = Zn2+
NO3- + 2H+ + e- = NO2 + H2O
j(Zn0/Zn2+) = -0,763 В
j(NO3-/NO2) = 0,80 В
jОК < jВОССТ Þ реакция возможна
4Zn + 10HNO3 РАЗБ. = 4Zn(NO3)2 + N2O + 5H2O
j(Zn0/Zn2+) = -0,763 В
j(NO3-,H/NH4NO3) = 0,94 В
jОК < jВОССТ Þ реакция возможна
Похожие работы
... много вариантов ТХИТ, в которых механическое соединение элементов не применяется, а сборка получается просто при прессовании всех ее компонентов. 3. Конструктивное исполнение электродов во вторичных химических источниках тока 3.1. Свинцовые аккумуляторы и батареи Стартерные батареи. Конструкция и параметры. Конструктивно стартерные АБ различаются незначительно. Схема их устройства ...
... разгерметировать элемент. При завальцовке корпуса обеспечивают такое сжатие резины, чтобы исключить вытекание электролита и в то же время дать возможность водороду медленно диффундировать в атмосферу. Ртутно-цинковые элементы используют не только индивидуально, но и в составе батарей. Для этого их комплектуют в секции по 2-10 шт., соединяя последовательно с помощью никелевой ленты. Корпусом ...
... техническому совершенству, боевым и эксплуатационным качествам не уступали лучшим зарубежным образцам, а нередко и превосходили их. Большинство из созданных в эти годы образцов в большей или меньшей степени представляли собой высокоточное оружие. В них использовались высокоточные инерциальные системы, системы коррекции и телеуправления движением на траектории и системы самонаведения на конечном ...
... нейтрализации сбрасываются на городские очистные сооружения на дополнительную очистку. Выводы На основе изученного нами обширного материала и собственных исследований можно сделать вывод, что электрический ток в жидких проводниках – важнейшее открытие в истории человечества, которое находит свое применение в разных средах: биологии, медицине, химии, промышленном производстве и т. д. Без ...

0 комментариев