Навигация
Нитрозные газы
3. Нитрозные газы
а) в колонне 1/2 количества (1,5%) HNO3 разлагается до NO2 по реакции (3)
242,3х0,015 = 3,64 кг.
При этом образуются газообразные вещества:
NO2=![]() =2,65 кг
=2,65 кг
H2O =![]() =0,52 кг
=0,52 кг
O2 = ![]() =0,46 кг.
=0,46 кг.
б) по реакции (4) разлагается ½ количества (1,5%) HNO3 до N2:
N2=![]() =0,81 кг.
=0,81 кг.
H2O = ![]() =0,52 кг.
=0,52 кг.
O2 = ![]() =2,3 кг
=2,3 кг
в) при разложении N2O3 по реакции (5):
NO2=![]() =5,45 кг
=5,45 кг
NO = ![]() = 3,55 кг
= 3,55 кг
г) при разложении HNSO5 по реакции (2):
NO2=![]() =5,43 кг
=5,43 кг
NO = ![]() = 3,54 кг
= 3,54 кг
Выделившаяся в процессе реакции серная кислота вновь войдет в состав отработанной кислотной смеси и доля ее в последней составит 450кг.
д) с нитрозными газами уносится 1% HNO3:
242,3х0,01 = 2,42 кг.
В результате гидролиза получается следующее количество сухих нитрозных газов (без учета подсоса воздуха):
| g, кг | u, нм3 | |
| NO2 | 13,5 | 6,87 |
| NO | 7,09 | 5,29 |
| N2 | 0,81 | 0,65 |
| O2 | 2,76 | 1,93 |
| HNO3 | 2,42 | 0,86 |
| Всего | 26,58 | 15,6 |
Подсос воздуха uпод через неплотности соединений царг колонны принимаем равным 100% объема сухих газов
uпод= 15.6 нм3, в том числе:
N2=0,78*15,6=12,17 нм3;
O2=0,21*15,6=3,28 нм3;
или
N2=![]() =15,21 кг;
=15,21 кг;
O2=![]() =4,68 кг;
=4,68 кг;
Итого: uпод=19,89 кг.
Принимаем, что подсасываемый воздух поступает при t=20 ОС, относительная влажность 80%
Количество водяных паров, поступающих в колонну с воздухом (14,61*0,8)10-3*19,89=0,23 кг, где
d0 = 14.61 ![]() - влагосодержание
- влагосодержание
Всего воздуха: 19,89+0,23=20,12 кг.
Количество и состав сухих газов, выходящих из колонны с учетом подсоса воздуха:
| g, кг | u, нм3 | |
| NO2 | 13,5 | 6,87 |
| NO | 7,09 | 5,29 |
| HNO3 | 2,42 | 0,86 |
| N2 | 16,02 | 12,82 |
| O2 | 7,44 | 5,21 |
| Всего | 46,47 | 31,11 |
Количество паров воды, уходящих из колонны (за конденсатом) с нитрозными газами при t=35 ОС
H2O =  , для
, для
v= 30 нм3
p=1,8 мм. Рт. Ст – парциальное давление воды над 98% HNO3 при t=35 ОС
p=133.3*1.8=239.9 Па
H2O = 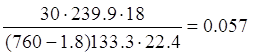 кг
кг
в объеме v= нм3
нм3
Общий состав газов, поступающих на поглощение:
| g, кг | u, нм3 | |
| NO2 | 13,5 | 6,87 |
| NO | 7,09 | 5,29 |
| N2 | 16,02 | 12,82 |
| O2 | 7,44 | 5,21 |
| H2O | 0,07 | 0,057 |
| HNO3 | 2,42 | 0,86 |
| Всего | 46,54 | 31,12 |
Таблица №10 - Сводный материальный баланс отделения концентрирования HNO3
| Приход: | |
| 1. Отработанная кислота | 1000 кг. |
| 2. Купоросное масло | х кг. |
| 3. Перегретый пар | у кг. |
| 4. Воздух через неплотности | 19,89 кг. |
| Итого: | 1019,89+х+у |
| Расход: | |
| 1. Слабая H2SO4 70% | (450+х)/0,7 кг. |
| 2. Крепкая HNO3 98% | 242,3 кг. |
| 3. Нитрозные газы | 46,54 кг. |
| Итого: | (931,70+х)/0,7 |
Приравнивая приход к расходу, получаем уравнение материального баланса
1019,89+х+у=931,7+![]()
у=0,43х-88,19
2.7. Расчет теплового баланса [1]Так как в уравнении материального баланса входит распад пара (у), то будем определять его с помощью уравнения теплового расчета.
Исходные данные:
1. Температура отработанной кислоты, поступающей в колонну - 90 ОС
2. Температура H2SO4 91% - 20 ОС
3. Температура отработанной кислоты H2SO4 70% - 170 ОС
4. Температура выходящих из колонны HNO3 и нитрозных газов – 85 ОС
5. Температура HNO3 98% из конденсатора, поступающей в колонну - 40 ОС
Температура крепкой HNO3 98%, выходящей из колонны в холодильник 85 ОС
6. Температура подсасываемого воздуха 20 ОС
Приход тепла:
1) С отработанной кислотой
Q=q1*c1*t1=1000*2.22*90=119800 кДж; (47732.2 ккал)
c1=2,22![]() - удельная теплоемкость отработанный кислоты при температуре 90 ОС
- удельная теплоемкость отработанный кислоты при температуре 90 ОС
2) С перегретым паром, теплосодержание которого при t=220 ОС равно 700.8 кДж; Q2=700,8*у
3) Теплота от H2SO4 состоит из физической теплоты ![]() и теплоты разбавления
и теплоты разбавления ![]()
![]() =
=![]() +
+![]()
Физическая теплота определяется по формуле
![]() =
=![]() =
=![]() х кДж/(8.4x ккал)
х кДж/(8.4x ккал)
![]() =1,759 кДж/кг град – удельная теплоемкость H2SO4 91% при t=20 ОС
=1,759 кДж/кг град – удельная теплоемкость H2SO4 91% при t=20 ОС
Теплота разбавления H2SO4![]() определяется разницей теплот разбавления до 70% и 91%.
определяется разницей теплот разбавления до 70% и 91%.
Удельная теплота разбавления g= (
(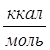 ); n=H2O/H2SO4
); n=H2O/H2SO4
В H2SO4 с массовой долей 91%, моль:
H2SO4 = х 0,91/98 = 0,0094 х
H2O = х 0,09/18 = 0,005 х
n = 0,005 х/0,0094 х =0,53
В H2SO4 70% моль:
Примем (450+х)/0,7=z
H2SO4=z 0.7/98 = 0,007 z
H2O = z 0.3/18 = 0,016 z
n = 0,016 z/0.007 z = 2.38
Удельная теплота разбавления ![]() H2SO4 с массовой долей 100% до 91%:
H2SO4 с массовой долей 100% до 91%:
![]() =
=![]() =4066,1
=4066,1 ![]() (17036,8
(17036,8 ![]() )
)
Уд теплота разбавления ![]() H2SO4 с 100% до 70%
H2SO4 с 100% до 70%
![]() =
= ![]()
![]() =10174
=10174![]() (42628,9
(42628,9 ![]() )
)
Удельная теплота разбавления с 91% до 70%:
![]() =42628.9-17036.8=25592.1
=42628.9-17036.8=25592.1![]() (6107.9 ккал)
(6107.9 ккал)
![]() =17,8*25592,1=455539,4 кДж (108720,6 ккал)
=17,8*25592,1=455539,4 кДж (108720,6 ккал)
![]() =35,18х + 455539,4 кДж (8,4*х + 108720,6 ккал)
=35,18х + 455539,4 кДж (8,4*х + 108720,6 ккал)
4) С HNO3 98%, поступающей из конденсатора в колонну с t=40 ОС
![]() =
=![]() = 242,3*40*1,93=18705,56 кДж (4464,3 ккал)
= 242,3*40*1,93=18705,56 кДж (4464,3 ккал)
5) С воздухом, подсасываемым из помещения с t=20 ОС
![]() =
=![]() =19,89*1*20=397,8 кДж (94,94 ккал)
=19,89*1*20=397,8 кДж (94,94 ккал)
![]() = 1 кДж/кг град – удельная теплоемкость воздуха
= 1 кДж/кг град – удельная теплоемкость воздуха
Всего в колонну приход тепла, кДж
![]() +
+![]() +
+![]() +
+![]() +
+![]() =199800 + 700,8 у + 35,18х + 455539,4 + 18705,56 + 397,8 = 674442,76 + 35,18х + 700,8у
=199800 + 700,8 у + 35,18х + 455539,4 + 18705,56 + 397,8 = 674442,76 + 35,18х + 700,8у
Расход тепла
1) С парами HNO3 98%, выходящих из колонны:
![]() =
=![]() =0.98*242.3*1.936*85=39075.43 кДж=9325,9 ккал
=0.98*242.3*1.936*85=39075.43 кДж=9325,9 ккал
2) На испарение HNO3:
![]() =0,98*242,3*i=0,98*242,3*483=114690,28 кДж=27372,38 ккал,
=0,98*242,3*i=0,98*242,3*483=114690,28 кДж=27372,38 ккал,
где i=483кДж/кг – теплота испарения 1 кг кислоты.
На испарение 4% H2O , содержащихся в HNO3:
![]() =
=![]() *0,98*242,3*i=
*0,98*242,3*i=![]() *0.98*242.3*2259=22350.36 кДж, где
*0.98*242.3*2259=22350.36 кДж, где
i=2259 кДж/кг – теплота парообразования воды
![]() =
=![]() +
+![]() =114690,28+22350,36=137040,64 кДж = 32706,6 ккал
=114690,28+22350,36=137040,64 кДж = 32706,6 ккал
3) Теплота, уносимая с 70% H2SO4 при t=150 ОС
![]() =(
=(![]() )*2,09*150=201535,71+447,86х кДж
)*2,09*150=201535,71+447,86х кДж
![]() =2,09 кДж/кг град – удельная теплоемкость H2SO4 70%
=2,09 кДж/кг град – удельная теплоемкость H2SO4 70%
4) С HNO3 98%, уносимой из колонны с t=85 ОС в холодильник:
![]() =
=![]() =242,3*1,93*85=39749,32 кДж = 9486,71 ккал
=242,3*1,93*85=39749,32 кДж = 9486,71 ккал
5) На нагрев подсасываемого воздуха из помещения в среднем до t=90 ОС
![]() =19.89(90-20)=1392.3 кДж
=19.89(90-20)=1392.3 кДж
6) На закрепление содержащихся в отработанной кислоте слабой HNO3 при ее массовой доле в смеси:
![]() *100%=49%
*100%=49%
Удельная теплота для HNO3:
g=n*8974/(n+1.737) ккал/моль
В кислоте с массовой долей 49%, моль:
HNO3=250*0,49/63=1,94; H2O =250*0,51/18=7,08
n=7.08/1.94=3.65
Удельная теплота разбавления для HNO3 98%:
![]() ккал/моль=25476,86 кДж/моль
ккал/моль=25476,86 кДж/моль
В кислоте с массовой долей HNO3 98%, моль:
HNO3=0,98/63=0,016; H2O =0,02/18=0,001
n=0.001/0.016=0.069
Удельная теплота разбавления для HNO3 98%
![]() ккал/моль=1436,59 кДж/моль
ккал/моль=1436,59 кДж/моль
Теплота закрепления HNO3, находящейся в отработанной кислоте с 49% до 98%: ![]() =(25476,86-1436,59)
=(25476,86-1436,59)![]() =89017,7 кДж=21245,27 ккал
=89017,7 кДж=21245,27 ккал
7) Теплота, уносимая с нитрозными газами:
![]() =
=![]() q7*c7*t, где
q7*c7*t, где
c- удельные теплоемкости газов с t=85 ОС
| NO2 | 13,5*0,75*85=865,92 кДж |
| NO | 7,09*0,996*85=600,2 кДж |
| N2 | 16,02*1,04*85=1416,17 кДж |
| O2 | 7,44*0,923*85=583,71 кДж |
H2O 0,07*1,373*85 = 8,17 кДж
HNO3 2,42*1,8*85 = 370,26 кДж
Всего: 3843.73 кДж
8) В окружающую среду колонна ГБХ в течение 1 часа теряет порядка 800 ккал (33520 кДж). При условии подачи в колонну 92 кг/мин тройной смеси и выработки колонны 60 тиг в сутки.
Потери тепла в окружающую среду:
![]() =
=![]() =6072,46 кДж
=6072,46 кДж
Всего расход тепла, кДж:
![]() +
+![]() +
+![]() +
+![]() +
+![]() +
+![]() +
+![]() +
+![]() =39075,43+137040,64+201535,71+447,86х+39749,32+1392,3+89017,7+3843,73+6072,46=517727,29+447,86х
=39075,43+137040,64+201535,71+447,86х+39749,32+1392,3+89017,7+3843,73+6072,46=517727,29+447,86х
Приход приравним к расходу:
674442,76+35,18х+700,8у=517727,28+447,86х
у=0,59х-223,62
Решаем совместно уравнение материального и теплового балансов:
0,43х-88,19=0,59х-223,62
х=847
у=276,11
Таблица №11 - Материальный баланс денитрации и концентрирования HNO3
Расчет составлен на 1 тонну отработанной кислоты
| Приход | Расход | ||||
| статьи прихода | кг | % | статьи расхода | кг | % |
| 1. Отработанная кислота | 900 | 42 | 1. Крепкая HNO3 98% | 242,3 | 11,3 |
| 2. 50% HNO3 | 100 | 4,7 | 2. Слабая HNO3 70% | 1852,86 | 86,5 |
| 3. Купоросное масло | 847 | 39,52 | 3. Нитрозные газы | 46,54 | 2,2 |
| 4. Перегретый пар | 276,11 | 12,88 | |||
| 5. Воздух через неплотности | 19,89 | 0,93 | |||
| Всего: | 2143 | 100 | Всего: | 2143 | 100 |
Таблица №12 - Тепловой баланс концентрирования азотной кислоты
| Приход | Расход | ||
| статьи прихода | КДж | статьи расхода | кДж |
| 1. С отработанной кислотой | 199800 | 1. С парами HNO3 98% | 39075,43 |
| 2. С перегретым паром | 193497,89 | 2. На испарении HNO3 | 137040,64 |
| 3. Теплота от H2SO4 91% | 485336,86 | 3. С H2SO4 70% | 581546,53 |
| 4. С HNO3 50% из конденсатора | 18705,56 | 4. С HNO3 98% | 39749,32 |
| 5. С воздухом | 397,8 | 5. На нагрев воздуха | 1392,3 |
| 6. На закрепление слабой HNO3 | 89017,7 | ||
| 7. С нитрозными газами | 3843,73 | ||
| 8. В окружающую среду | 6072,46 | ||
| Всего: | 897738,11 | Всего: | 897738,11 |
На 1 тонну отработанной кислоты приходится в 4.127 раза больше крепкой 98% HNO3. Пересчитаем на 1 тонну готового продукта 98% HNO3
Таблица №13 - Нормы расхода сырья для производства 1 тонны готового продукта 98% HNO3
| Приход | Расход | ||||
| статьи прихода | кг | % | статьи расхода | кг | % |
| 1. Отработанная кислота | 3714,3 | 41,97 | 1. Крепкая HNO3 98% | 1000 | 11,3 |
| 2. 50% HNO3 | 412,7 | 4,73 | 2. Слабая HNO3 70% | 7654,87 | 86,5 |
| 3. Купоросное масло | 3492,48 | 39,52 | 3. Нитрозные газы | 194,69 | 2,2 |
| 4. Перегретый пар | 1138,24 | 12,88 | |||
| 5. Воздух через неплотности | 79,54 | 0,9 | |||
| Всего: | 8849,6 | 100 | Всего: | 8849,6 | 100 |
2.8 Расчет материального баланса концентрирования H2SO4
Исходные данные:
1. Температура кислоты на входе 150 ОС
2. Температура кислоты на выходе 250 ОС
3. Температура дымовых газов на входе 900 ОС
4. Температура дымовых газов на выходе 130 ОС
1. Потери при концентрировании составляют 0,06%, из них 50% на разложение SO2 и 50% - теряется в виде паров серной кислоты
В вихревую колонну поступает разбавленная серная кислота (с учетом потерь):
Gразб = G(1-0,0006) = 7654,87*0,9994 = 7650,28 кг.
в том числе воды:
![]() = Gразб(1-
= Gразб(1-![]() ) = 7650,28(1-0,7) = 2295,08 кг.
) = 7650,28(1-0,7) = 2295,08 кг.
В колонну подается кислота ( в пересчете на моногидрат):
Gпр = G(1-0.0006)![]() = 7650,28*0,7 = 5355,2 кг.
= 7650,28*0,7 = 5355,2 кг.
2. При концентрировании серная кислота разлагается по формуле:
H2SO4 = SO2 + H2O + 1/2O2
Qразл = 228900 кДж/кмоль – теплота разложения H2SO4. Потери от разложения составляют 50% общих потерь или 0,03%:
Gпот = Gт*0,03/100 = 7650,28*0,0003 = 2,3 кг.
3. Потери вследствие уноса серной кислоты с дымовыми газами составляют также 50% общих потерь (0,03%)
Gун = 0,0003*7650,28 = 2,3 кг.
4. Общие потери составляют:
Gпот = Gун + Gразл = 2.3*2 = 4.6 кг.
5. При разложении серной кислоты образуется:
H2SO4 = SO2 + H2O + 1/2O2
![]() = 98;
= 98; ![]() = 64
= 64
SO2 = ![]() = 1,5 кг.
= 1,5 кг.
O2 = ![]() = 0,38 кг.
= 0,38 кг.
H2O = ![]() = 0,42 кг.
= 0,42 кг.
6. В колонне выпариваются воды:
Gвых = Gразл[(1-Gисх/100)-( 1-Gк/100)] = 7650.28[(1-70/100)-(1-91/100)] = 1606,56 кг.
7. Выход 91% продукционной H2SO4:
Gкон= Gразл- Gразл[(1-Gисх/100)-( 1-Gк/100)] ] = 7650.28-1606.56=6043.76 кг.
8. Приход кислоты по моногидрату:
Gпр = Gисх![]() = 7650,28*0,7 = 5355,2 кг.
= 7650,28*0,7 = 5355,2 кг.
Приход тепла:
1. с разбавленной серной кислотой 70% при t = 150 ОС
Q1 = QпрHпр = 7654.87*342 = 2617934.76 кДж = 624805,43 ккал.
Hпр = 342 кДж/кг – энтальпия исходной кислоты
2. С дымовыми газами, поступившими из топки:
Q2 = ![]() = 31,37х*1,45*900 = 40937,85х кДж = 9770,37 ккал.
= 31,37х*1,45*900 = 40937,85х кДж = 9770,37 ккал.
V2 = 31,37 м3 – объем газов
С2 = 1,450 кДж/м3 град
Общий приход тепла: Qобщ = Q1+ Q2 = 2617934,76+40937,85х кДж
Расход тепла
1. С продукционной кислотой при 250 ОС:
Q1 = Ck*Hk = 5355.2*458 = 2452681.6 кДж = 585365,54 ккал
Hк = 458 кДж/кг – энтальпия серной кислоты 91%
2. С водяным паром выделяется при выпаривании и разложении:
Q2 = Cвп*Hвп = 1606.98*2737.7 = 4399429.15 кДж = 1049983.09 ккал
Gвп = Gуп + Gразл = 1606,56 + 0,42 = 1606,98 кг.
Hвп = 2737,7 кДж/кг – энтальпия водяного пара
Gуп и Gразл – из материального баланса.
3. С дымовыми газами, уходящими с t = 30 ОС:
Q3 = ![]() = 31,37х*1,336*130 = 5448,34х кДж = 1300,32 ккал.
= 31,37х*1,336*130 = 5448,34х кДж = 1300,32 ккал.
V2 – объем дымовых газов на м3 сжигаемого газа
С2 = удельная теплоемкость дымовых газов при t=130 ОС
С2 = 1,336 кДж/м3 град
4. На испарение серной кислоты:
Q4 = Gисп+ Hисп=2,3*511,2=1175,76 кДж=280,61 ккал
Нисп=511.2 кДж/кг - удельная теплота парообразования серной кислоты
5. С парами серной кислоты:
Q5 = Gисп+ H = 2,3*201,4=463,22 кДж=110,55 ккал
Н – энтальпия 100% серной кислоты при температуре отходящих газов 130 ОС.
6. На разложение серной кислоты:
Q6 = 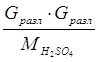 =
= ![]() =5372,14 кДж = 1282 ккал.
=5372,14 кДж = 1282 ккал.
7. С продуктами разложения серной кислоты в результате разложения серной кислоты при температуре отходящих газов 130 ОС образуются:
![]() =1,5 кг.; =0,38 кг.;
=1,5 кг.; =0,38 кг.; ![]() =2,3 кг
=2,3 кг
Q7 = (![]() *
*![]() +
+ ![]() *
*![]() )t=(0.963 + 0.353)130 = 171.08 кДж = 40,83 ккал
)t=(0.963 + 0.353)130 = 171.08 кДж = 40,83 ккал
8. При концентрировании серной кислоты (дегидратации) от 70% до 91% расходуется тепла:
Q8=Gуп(Q70%- Q91%)
Q70% = 427,4 кДж/кг – теплота разбавления до 70%
Q91% = 157,3 кДж/кг – теплота разбавления до 91%
Q8 = 5355,2(427,4-157,3)=1446439,52 кДж = 345212,3 ккал
9. Потери тепла в окружающую среду примем 1% от общего количества расхода тепла на концентрировании серной кислоты:
Q= 2452681,6 + 4399429,15 + 5448,34х + 463,22 + 1175,76 + 5372,14 + 171,08 + 1446439,52 = 5853050,87 + 5448,34 х кДж
Qд = 58530,51 + 54,48 х к`Дж
Qрасх = 5911581,38 + 5502,82 х кДж
10. Для определения расхода топлива ^приравниваеме приход тепла к расходу:
Qобщ = Qрасх
2617934,76+40937,85х=5911581,38+5502,88х
35435,03х=3293646,62
х=92.95
11. Определяем часовое количество и состав газов, поступающих на установку из топки.
Таблица №14 - Количество и состав газов из топки
| газы | м3 | кг. |
| CO2 : 1,27*92,95 | 118,5 | 231,87 |
| N2: 24,43*92,95 | 2270,77 | 2838,46 |
| O2: 4,03*92,95 | 374,59 | 535,13 |
| H2O: 2,68*92,95 | 249,11 | 200,17 |
| Всего | 3012,52 | 3805,63 |
12. Определяем часовое количество газов, уходящих с установки:
Таблица №15 - Часовое количество газов
| газы | м3 | кг. |
| CO2: | 118.05 | 231.87 |
| N2: | 2270.77 | 2838.46 |
| O2: | 374.86 | 535.51 |
| SO2: | 0,53 | 1,5 |
| H2O: | 2249,43 | 1807,58 |
| H2SO4: | 0,53 | 2,3 |
|
| ||
| Всего | 5014,7 | 5417,22 |
Таблица №16 - Материальный баланс концентрирования серной кислоты
| Приход | Расход | ||||
| статьи прихода | кг | % | статьи расхода | кг | % |
| 1. Газы из топки | 3805,63 | 33,2 | 1. Газы в аотмосферу | 5417,22 | 46,26 |
| 2. Серная кислота 70% | 7654,87 | 66,8 | 2. серная кислота 91% | 6043,72 | 52,72 |
| 3. Пары серной кислоты | 2,3 | 0,02 | |||
| Всего: | 11460,5 | 100 | Всего: | 11460,5 | 100 |
Таблица №17 - Тепловой баланс концентрирования серной кислоты
| Приход | Расход | ||
| статьи прихода | КДж | Статьи расхода | кДж |
| 1. С серной кислотой 70% | 2617934,76 | 1. С серной кислотой 91% | 2452681,6 |
| 2. С дымовыми газами | 6423107,92 | 2. С водяным паром | 4399429,15 |
| 3. С дымовыми газами | 672179,0 | ||
| 4. На испарение серной кислоты | 1175,76 | ||
| 5. Теплота разложения | 5372,14 | ||
| 6. С продуктами разложения | 171,08 | ||
| 7. Теплота дегидратации | 1446439,52 | ||
| 8. Потери в окружающую среду | 63594,43 | ||
| Всего: | 9041042,68 | Всего: | 9041042,68 |
3. Технико-технологическая часть 3.1. Выбор и расчет производительности основного и вспомогательного оборудования технологической схемы
Исходя из заданной производительности проектируемого производства по готовой продукции (98% HNO3) определяем суточную и часовую производительность основного аппарата цеха-колонны ГБХ.
Псут=![]() , где
, где
Пгод-10000 т/год
n – время на ремонт и простои оборудования
Псут=![]() =29,85 т/сут
=29,85 т/сут
Пчас=![]() =1,24 т/час
=1,24 т/час
При отгонке концентрированной HNO3 определенного состава расход безводной H2SO4 зависит от массовой доли H2SO4 в разбавленной HNO3, при этом расход H2SO4 будет тем больше, чем сильнее разбавлена HNO3. Для одной и той же исходной разбавленнной HNO3 удельный расход H2SO4 обратно пропорционален ее степени концентрации. В соответствии с расчетом по треугольным диаграммам (услович – Температура кипения смеси на палках) при массовой доле HNO3 48-50% и технической H2SO4 91-92% соотношение HNO3:H2SO4 составляет 1:32 при исходной HNO3 50% и H2SO4 92%. Исходя из сказанного выше, годовая производительность по H2SO4 будет равна 32000 т/год.
![]() =
=![]()
Рассчитаем суточную и часовую производительность вихревой колонны:
Псут=![]() =95.52 т/сут
=95.52 т/сут
Пчас=![]() =3,98 т/час
=3,98 т/час
n=![]()
Пгод – годовая производительность
Пчас – часовая производительность
КИО – коэффициент использования оборудования
Тэф – эффективный фонд времени работы аппарата, ч
Денитрационная колонна ГБХ
Тэф=8040 час/год
КИО=0,95
Пгод=10000 т/год
Пчас=1,24 т/час
n=![]() =1.1 шт
=1.1 шт
Выбираем 1 аппарат
Вихревая колонна
Тэф=8040 ч/год
КИО=0,9
Пгод=32000 т/год
Пчас=3,98 т/час
n=![]() =1.1 шт
=1.1 шт
Выбираем 1 аппарат
Абсорбер для улова паров азотной кислоты и окислов азота:
Тэф=8760-1404 =7365 ч
КИО=0,86
Пгод=5337000 т/год
Пчас=5337000/7356 =725,5 т/час
n= =3,8 шт
=3,8 шт
Выбираем 4 абсорбера
4. Конструктивно-механические расчеты 4.1 Расчет числа ступеней контакта фаз концентратора [5]Определение числа ступеней концентратора серной кислоты при концентрировании от 70% масс до 91-92% масс H2SO4 проводим аналитическим методом. При нагреве серной кислоты до 260-280 ОС продукционную 92% H2SO4 можно получить в одной ступени. Однако при этом содержание серной кислоты в парах достигает 30-50 г/м3 , что приводит к значительному газовому выбросу. Для уменьшения содержания в парах, серную кислоту концентрируют в 2-3 ступенчатых аппаратах, однако, если при этом пересыщение паров H2SO4 во второй ступени превышает критическое значение более, чем в 30 раз: Sкр>![]() =3,3, то происходит образование тумана серной кислоты. Концентрация кислот во второй ступени для работы концентратора в режиме без образования тумана серной кислоты должна составлять 85-90% масс, температура 240 ОС.
=3,3, то происходит образование тумана серной кислоты. Концентрация кислот во второй ступени для работы концентратора в режиме без образования тумана серной кислоты должна составлять 85-90% масс, температура 240 ОС.
Аналитическое определение числа ступеней, концентрации и температур H2SO4 на ступенях концентратора, работающего без образования тумана, представлено в таблице .
Таблица №18 - Число ступеней, концентрации и температуры серной кислоты на ступенях концентратора.
| Ступени концентратора | |||||
| 1 | 2 | 3 | 4 | 5 | |
| 1. Температура газа, ОС | |||||
| на входе | 850 | 230 | 210 | 190 | 175 |
| на выходе | 230 | 210 | 190 | 175 | 160 |
| 2. Концентрация H2SO4, % | |||||
| на входе | 88 | 84 | 80 | 75 | 70 |
| на выходе | 92 | 88 | 84 | 80 | 75 |
| 3. Температура H2SO4, ОС | 220 | 200 | 180 | 165 | 150 |
| Давление насыщенных паров H2SO4, Па | |||||
| на входе | 200 | 56 | 16 | 2,2 | 0,47 |
| на выходе | 960 | 200 | 56 | 16 | 2,2 |
| 5. Пересыщение, S | 4,8 | 3,57 | 3,5 | 7,3 | |
| 6. Критическое состояние, Sкр | 4,5 | 6 | 7,1 | 12,27 | |
| 7. Отношение: S : Sкр | 1,07 | 0,6 | 0,5 | 0,6 | |
Принимая равными эффективности ступеней вихревой колонны по температуре, массоотдаче в газовой и жидкой фазах для процессов десорбции паров воды и абсорбции паров серной кислоты, задаемся распределением концентрации (xi) и температур (ti) серной кислоты.
Таблица №19
| Ступени концентратора | |||||
| 1 | 2 | 3 | 4 | 5 | |
| 1. Температура газа, ОС | |||||
| на входе | 850 | 250 | 210 | 190 | 175 |
| на выходе | 250 | 210 | 190 | 175 | 170 |
| 2. Концентрация H2SO4, % масс. | |||||
| на входе | 89 | 85 | 81 | 76 | 70 |
| на выходе | 92 | 89 | 85 | 81 | 76 |
| 3. Давление насыщенных паров H2SO4, Па | |||||
| на входе | 250 | 56 | 16 | 2,2 | 0,47 |
| на выходе | 980 | 250 | 56 | 16 | 2,2 |
| 4. Пересыщение, S | 3,8 | 4,5 | 3,5 | 7,3 | |
| 5. Критическое пересыщение, Sкр | 4,3 | 6 | 7,1 | 12,27 | |
| 6. Отношение: S : Sкр | 0,88 | 0,75 | 0,49 | 0,59 | |
| 7. Брызгоунос на 1 кг подаваемой на ступень кислоты | 0,319 | 0,318 | 0,317 | - | - |
Похожие работы
... в зимнее время (25 ºС)Глубина промерзания грунта 4,5 мСкоростной напор ветра 35 кг/м3Уровень грунтовых вод 6 м 2. Характеристика производственного процесса: фаза концентрирования серной кислоты относится к В - Iа /3/ группе производственных процессов,категория взрывопожароопасности – А; режим работы – трехсменный, непрерывный.Здание концентрирования имеет в плане прямоугольную форму.Длина ...
... (ОР) на кг осадка. Промывку проводят из расчета 5 л воды на 1 кг ОСВ, после чего в промывную воду добавляют концентрированный отработанный травильный раствор и свежую серную кислоту и полученный раствор используют на последней стадии кислотной обработки. Отмывка ОСВ водой позволяет также сократить расход щелочного реагента на нейтрализацию ОСВ. Нейтрализация ОСВ необходима, т.к. кислые осадки ...
... , а также при дроблении горячих слитков, разгрузке и ремонте доменных печей и т.п. 2. Методическая разработка факультативных занятий по химии На основе дипломной работы были разработаны факультативные занятия в виде лекций по теме Бризантные взрывчатые вещества для учащихся старших классов средней общеобразовательной школы. Задачи факультативных занятий: 1. Повысить познавательный ...
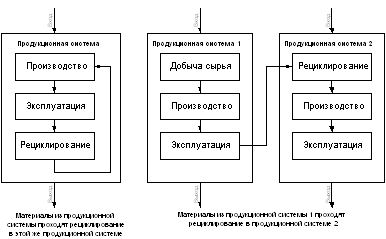
... - Примеры продукционных систем с рециклированием материалов Оценка воздействия на окружающую среду за полный жизненный цикл. Этап оценки воздействий направлен на определение значимости потенциальных воздействий на окружающую среду по результатам инвентаризационного анализа стадий жизненного цикла. В широком смысле этот процесс включает в себя увязывание между собой инвентаризационных данных с ...



0 комментариев