Навигация
Применение прямоточного взаимодействия газовой и жидкой фаз в зоне контакта при сохранении противоточного движения потока по аппарату в целом
1. Применение прямоточного взаимодействия газовой и жидкой фаз в зоне контакта при сохранении противоточного движения потока по аппарату в целом.
2. Использование вихревого движения газожидкостного потока в зоне контакта фаз, обеспечивающего максимальную турбулизацию потока, обновление метафазной поверхности, широкий диапазон устойчивости работы контактных ступеней, а также эффективную сепарацию жидкости в поле центробежных сил.
3. Применение восходящего движения фаз в зоне контакта, обеспечивающего максимальный диаметр многоступенчатых аппаратов.
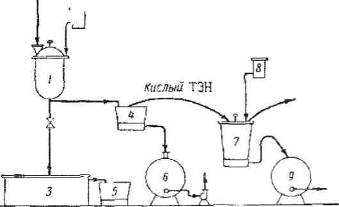
Принцип прямоточного движения газовой и жидкой фаз осуществляется в вихревом контактном устройстве (рис. 2.2.), состоящем из тарелки 3, на которую установлен завихритель 5, и контактного патрубка 4.
Завихритель газового потока расположен внутри контактного патрубка и изготовлен в виде цилиндра, имеющего 8 тангенциально расположенных лопаток 6, образующих между собой тангенциальные щели для прохода газа.
В нижней части контактного патрубка 4 имеются прорези для прохода жидкости.. Завихритель расположен на нижней царге 1, а контактный патрубок – на верхней царге 2 ступени. Подача жидкости на ступень осуществляется в нижнюю царгу, а ее выход из верхней царги.
Контактирующий газ входит в щель между лопатками завихрителя и приобретает вращающее движение. Серная кислота из вышележащей ступени по линии перетока поступает в нижнюю царгу ступени, протекает через прорези контактного патрубка во внутреннюю полость между завихрителем и внутренней стенкой контактного патрубка. Поток кислоты разделяется на 2 части. Часть кислоты эжектируется внутрь завихрителя и вылетает из него в виде капель и струй. Основная доля жидкости раскручивается газожидкостным потоком и движется по спирали вверх по внутренней стенке контактного патрубка. При этом жидкостная пленка непрерывно бомбардируется каплями и струями кислоты, вылетевшими из завихрителя и непрерывно многократно обновляет свою поверхность. Выходящий из щелей завихрителя свежий газовый поток образует вихри жидкости, которые сливаются и движутся по спирали в выходящем потоке в виде высокотурбулированного слоя жидкости, основная часть которого отсекается от газового потока под вышележащей царгой, служащей отбойником. Часть серной кислоты уносится газовым потоком на вышележащую ступень.
Количество уносимой кислоты определяется расходами газовой и жидкой фаз, поступающих на ступень. За счет уноса определенного количества H2SO4 со ступени на ступень осуществляется такое распределение концентраций серной кислоты на ступенях, при которой величины пересыщения паров серной кислоты на ступенях не достигают критического значения и исключаются условия образования тумана серной кислоты. Отсепарированная в верхней царге серная кислота перетекает через внешний гидрозатвор на нижнюю царгу нижележащей ступени. Серная кислота перетекает со ступени на ступень вниз, концентрируется и поступает в нижнюю часть колонны. На первой ступени кислота газовым потоком в виде капель и струй по тангенциальному каналу поступает в днище колонны, где раскручивается газовым потоком и поднимается в виде высокотурбулированного слоя жидкости, струй, брызг по внутренней стенке днища колонны вверх, в зону сепарации, расположенную между первой и второй ступенями. Отсепарированная крепкая (91-93%) серная кислота перетекает через штуцер из зоны сепарации по трубопроводу в холодильник.
Газовый поток, контактируя на ступенях с кислотой, отдает ей свое тепло, освобождается от брызг кислоты в брызгоуловительных ступенях и с содержанием кислых компонентов в пределах санитарной нормы выбрасывается через трубу выброса газов в атмосферу.
2.3. Стандартизация. Технологическая характеристика сырья, полуфабрикатов, готового продукта. ГОСТ и технические требования.Технологический процесс регенерации отработанных кислот позволяет получить концентрированную HNO3 и H2SO4, от вещающие требованиям соответствующих стандартов.
1. Азотная кислота концентрированная
Таблица №3 - Технические характеристики на HNO3 по ГОСТ 701-78
| № | Наименование показателей | Нормы | ||
| Высший сорт | I сорт | II сорт | ||
| 1. | Содержание HNO3, в %, не менее | 98,9 | 98,2 | 97,5 |
| 2. | Содержание H2SO4, в %, не менее | 0,04 | 0,05 | 0,06 |
| 3. | Содержание окислов азота N2O4, в %, не более | 0,2 | 0,3 | 0,3 |
| 4. | Содержание прокаленного остатка, в % | 0,005 | 0,015 | 0,03 |
2. Кислота серная техническая регенерированная (купоросное масло)
Таблица №4 - Технические условия на H2SO4 по ГОСТ 2184-77
| № | Наименование показателей | нормы |
| 1. | Содержание H2SO4, в %, не менее | 91,0 |
| 2. | Содержание нитросоединений, в %, не менее | 0,2 |
| 3. | Содержание прокаленного остатка, в % | 0,4 |
| 4. | Содержание окислов азота N2O3, в %, не более | 0,01 |
| 5. | Содержание железа, в %, не более | 0,2 |
3. Отработанные и вытесненные кислоты представляют собой тройную смесь азотной и серной кислот, а также воды.
Таблица №5 - Состав тройных смесей
| № | Наименование составных частей | Отработанной кислоты | Вытесненной кислоты |
| 1. | Азотная кислота, в % | 15-22 | 15-22 |
| 2. | Серная кислота, в % | 35-40 | 35-40 |
| 3. | Окислы азота, в % | 4-5 | 0,5-1,0 |
| 4. | Вода, в % | 33-46 | 37-49,5 |
4. Слабая серная кислота
Таблица №6 Состав слабой H2SO4 должен удовлетворять условиям ГОСТа 1500-78
| № | Наименование составных частей | Нормы |
| 1. | Содержание серной кислоты, в % | 67-70 |
| 2. | Содержание азотной кислоты, в % | 0,03 |
Топливо (природный газ)
Природный газ должен соответствовать требованиям по ГОСТ 5542-70
Таблица №7 Технические условия на природный газ
| № | Наименование показателей на 100 гр. Газа | Нормы |
| 1. | 2. | 3. |
| 1. | Содержание сероводорода в гр., не более | 2 |
| 2. | Содержание аммиака в гр., не более | 2 |
| 3. | Содержание синильной кислоты в гр., не более | 5 |
| 4. | Содержание смол и пыли в гр., не более | 0,1 |
| 5. | Содержание нафталина в гр., не более | 10 |
| 6. | Содержание кислорода в гр., не более | 1 |
Природный газ используется для получения тепла при концентрировании кислот.
Серная кислота концентрированная должна быть изготовлена в соответствии с требованиями настоящего стандарта по технологическому регламенту, утвержденному в установленном порядке. По физико-техническим показателям СК должна соответствовать нормам, указанным в таблице 8 по ГОСТ 2184-77.
Таблица №8
| № | Наименование показателей | норма | |||||
| Контактная | Олеум высший | ||||||
| высший сорт | I сорт | высший сорт | I сорт | ||||
| 1 | Внешний вид | Не нормируется | Маслянистая жидкость без механических примесей | ||||
| 2 | Массовая доля моногидрата (H2SO4), в % | 92,5 | 94 | 92,5 | 94 | ||
| 3 | Массовая доля свободного серного ангидрида (SO3) в %, не менее | - | - | 24 | 24 | ||
| 4 | Массовая доля железа, не более | 0,006 | 0,015 | 0,006 | 0,01 | ||
| 5 | Массовая доля остатка после прокаливания, %, не более | 0,02 | 0,03 | 0,02 | 0,03 | ||
| 6 | Массовая доля нитросоединений, %, не более | Не нормируется | Не нормируется | ||||
| 7 | Массовая доля окислов азота (N2O3), %, не более | 0,00005 | 0,0001 | 0,0002 | 0,0005 | ||
| 8 | Массовая доля мышьяка (As), %,не более | 0,00008 | 0,00001 | 0,00008 | 0,00001 | ||
| 9 | Массовая доля хлористых соединений, в %,не более | 0,0001 | 0,0005 | Не нормируется | |||
| 10 | Массовая доля свинца (Pb), %,не более | 0,001 | 0,01 | 0,0001 | 0,001 | ||
| 11 | Прозрачность | Не нормируется | Разбавление | ||||
| 12 | Цвет в мл. раствора, сравнение | 1 | 2 | Не нормируется | |||
1. Азотная кислота концентрированная HNO3 в чистом виде – бесцветная жидкость с едким, удушливым запахом; имеет удельный вес 1,5 гр/см3 ; 100% HNO3 плавится при температуре –42 ОС; кипит при температуре +86 ОС. HNO3 действует на все металлы, кроме серебра и платины. Хранится и транспортируется в алюминиевых цистернах. На свету медленно разлагается с выделением кислорода и двуокиси азота NO2. Туман азотной кислоты и окиси азота в виде NO2, N2O3 вызывает тяжелые отравления. ПДК в рабочей зоне – до 5 мг/м3 .
2. H2SO4 техническая, регенерированная. H2SO4 в чистом виде – прозрачная бесцветная жидкость. Удельный вес – 1,81-1,84 гр/см3 . Температура кипения безводной серной кислоты 275 ОС, Температура плавления 10,45 ОС.
Концентрированная СК на холоде не действует на металлы, поэтому ее можно хранить в емкостях из черного металла. ПДК туманообразной кислоты в воздухе рабочей зоны 1мг/м3 .[ ]
2.4. Химизм основных и побочных реакций [4]При установившемся в денитрационной колонне ГБХ равновесном процессе, HNO3 из смеси кислот, поступающий в колонну на тарелку испарения, частично уходит на нижележащие тарелки, откуда снова отгоняется на тарелку испарения. В процессе дистилляции, то есть отгонки HNO3 из тройной смеси, поднимающиеся вверх пары обогащаются более летучим компонентом – HNO3, а в движущуюся вниз жидкость преходит менее летучий компонент – вода.
Процесс испарения HNO3 происходит главным образом в средней части колонны. H2SO4, пройдя эту зону, содержит в себе растворенные окислы азота, переходящие из тройной смеси. Даже если в тройной смеси не было бы растворенных окислов азота, то при частичном разложении HNO3 происходит выделение окислов, которые взаимодействуя с H2SO4, образуют нитрозилсерную кислоту:
2H2SO4 + N2O3 = 2HNSO5 + H2O + 86250 Дж.
Диоксид или четырехоксид азота, реагируя с концентрированной H2SO4, образует нитрозилсерную кислоту и азотную кислоту:
2NO2 + H2SO4 = HNSO5 + HNO3
Процесс разложения нитрозилсерной кислоты с выделением окислов азота характеризуется как процесс денитрации. Однако термин "денитрация" служит для обозначения процесса, обратного этерификации. В данном случае более правильно процесс разложения нитрозилсерной кислоты называть процессом гидролиза:
2HNSO5 + 2H2O = 2H2SO4 + 2HNO2
2HNO2 = H2O + N2O3 (жид)
N2O3 (жид) = N2O3 (газ)
N2O3 (газ) = NO(газ) + NO2(газ)
Азотистая кислота (HNO2), образующаяся при гидролизе нейстойчива и распадается:
2HNO2 = H2O + HNO3 + 2NO
Нитрозилсерная кислота является довольно стойким соединением, которое при концентрациях H2SO4 выше 70% не разлагается полностью даже при температуре кипения. При разбавлении H2SO4 водой происходит гидролиз нитрозилсерной кислоты, степень которой увеличивается с понижением концентрации H2SO4 и повышением температуры .
Таблица №9 - Зависимость степени разложения HNSO5 от концентрации H2SO4 при 15-20 ОС
| Концентрация H2SO4, % | Степень разложения HNSO5 , % | Концентрация H2SO4, % | Степень разложения HNSO5 , % |
| 98 | 1,1 | 81 | 19,4 |
| 95 | 4,0 | 80 | 27,7 |
| 92 | 7,3 | 70 | 49,8 |
| 90 | 12,4 | 57,5 | 100,0 |
Как видно из зависимости, начиная с концентрации 57,5% H2SO4, нитрозилсерная кислота совершенно отсутствует. Отработанная H2SO4, выходящая из колонны, должна содержать минимально возможное количество окислов азота. Это необходимо не только для исключения потерь N2O3 , но и устранения нитрозилсерной кислоты, обладающей сильно разрушающими свойствами.
Поэтому гидролиз HNSO5 в колонне ГБХ является важной стадией процесса. С увеличением температуры, степень гидролиза HNSO5 увеличивается. Образующийся при разложении азотистой кислоты монооксид азота незначительно растворяется в разбавленной H2SO4. Гидролиз нитрозилсерной кислоты ведут с помощью перегретого пара до 250 ОС водяного пара, который подается с таким расчетом, чтобы разбавление кислоты конденсатом соответствовало массовой доли H2SO4 68-70%. В отработанной H2SO4 содержится до 0,03% HNO3 и растворенных окислов азота. Последние образуют с H2SO4 до 0,01% HNSO5.
После стадии денитрации слабая H2SO4 отправляется на стадию концентрирования. В процессе концентрирования разбавленной H2SO4, имеющиеся в ней примеси, в частности, продукты неполного сгорания топлива (когда концентрирование ведется непосредственным соприкосновением упариваемой кислоты с топочными газами), вызывает разложение H2SO4 вследствие ее восстановления до SO4. Восстановление в основном идет за счет углерода, содержащегося в примесях и в топливе по уравнению:
2H2SO4 + С = СО2 + 2SO2 + 2 H2O
За счет этого происходят некоторые потери кислоты при ее упаривании. В процессе разгонки тройной смеси в колонне образуются нитрозные газы, которые поступают на поглощение в абсорберы. Наиболее распространенный способ поглощения нитрозных газов водой с образованием слабой HNO3. На поглощение поступают нитрозные газы различной степени окисления. Окислы азота, содержащиеся в нитрозных газах NO2, N2O4, N2O3 реагируют с водой, но монооксид NO не может реагировать с водой и для перевода его в HNO3 следует предварительно окислить его до диоксида азота:
2NO2 + H2O = HNO3 + HNO2 + 116 кДж.
N2O4 + H2O = HNO3 + HNO2 + 59,2 кДж.
N2O3 + H2O = 2HNO3 + 55,6 кДж.
Процесс поглощения нитрозных газов водой связан с растворением в ней диоксида азота, четырехоксида и трикосида азота с образованием HNO3 и азотистой кислоты.
В газовой среде вследствии взаимодействия паров воды с нитрозными газами, также получается HNO3 и азотистая кислота, но в значительном количестве. Образовавшаяся при помощи нитрозных газов азатитсая кислота – малоустойчивое соединение.
2HNO2 = HNO3 + 2NO + H2O - 75,8 кДж
Суммарная реакция образования HNO3:
2NO2 + H2O = HNO2 + HNO3
3HNO2 = HNO3 + 2NO+ 2H2O
____________________________________
3NO2 + H2O = 2HNO3 + NO
N2O3 + H2O = 2HNO2
3HNO2 = HNO3 + H2O + 2NO
_______________________
3N2O3 + H2O = 2HNO3 + 4NO
Так как в нитрозных газах содержится незначительное количество триоксида азота, обычно технологические расчеты производят по NO2. Как видно из формул 2/3 поглощенного диоксида азота идет на образование HNO3, 1/3 его выделяется в виде монооксида азота.
Отсюда следует, что при поглощении водой нитрозных газов невозможно все количество NO2 превратить в HNO3, так как в каждом цикле всегда 1/3 NOх будет выделяться в газовую фазу. Монооксид азота для дальнейшей переработки должен быть окислен кислородом до двуокиси азота по уравнению:
2NO + O2 = 2 NO2
Получающаяся двуокись азота опять реагирует с водой, превращаясь на 2/3 в HNO3, а выделившаяся окись азота снова должна быть окислена. Таким образом, весь процесс поглощения распадается на ряд последовательно протекающих реакций окисления NO в NO2 и образования HNO3 из NO2.
Однако указанные поглощения не являются совершенными и нитрозные газы перед выбросом в атмосферу следует дополнительно очистить от окислов азота. Отсюда следует, что в последнем абсорбере орошение ведется не водой, а концентрированной серной кислотой, которая до 0,003% поглощает окислы азоты, выбрасываемые в атмосферу газы соответствуют санитарным нормам.
В результате поглощения получается нитрозилсерная кислота:
2 H2SO4 +N2O3 = 2 NHSO5 + H2O + 20611 кал.
H2SO4 + 2 NO2 = NHSO5 + HNO3 + 5709 кал.
2.5 Инженерные решенияВ данный дипломный проект вводится ряд изменений, направленных на улучшение технологии переработки кислот и очистки отходящих газов.
1. На фазе улова окислов азота и паров азотной кислоты предусматривается внедрение дополнительной абсорбции отходящих газов концентрированной H2SO4. серная кислота реагирует с окислами азота, образуя нитрозилсерную кислоту, которая затем снова направляется в колонну ГБХ для переработки. Отходящие газы с небольшим содержанием окислов азота, выбрасываются в атмосферу.
2. Процесс регенерации отработанной кислоты переведен на автоматизированное управление с применением УВМ, что значительно снижает опасность технологического процесса и повышает качество продукции. Подача кислот в колонну ГБХ автоматизирована. Предусмотрено автоматическое отключение подачи компонентов в случае аварии.
2.6. Расчет материального баланса отделения концентрирования HNO3 [1]Отделение денитрации и концентрирования азотной кислоты.
Состав отработанных кислот, поступающих на денитрацию:
а) от нитрации HNO3 16-26%
H2SO4 46-66%
H2O 18-28%
б) от абсорбционной установки
HNO3 50%
H2O 50%
Исходные данные для расчета
- концентрация крепкой азотной кислоты – 98%
- концентрация серной кислоты, поступающей в колонну – 91%
- концентрация отработанной кислоты, выходящей из колонны – 70%
Расчет составлен на 1 тонну условной отработанной кислоты, поступающей в колонну ГБХ, учитывая, что ОК – 80%, а смесь азотной кислоты и воды – 20%.
Выбираем средний состав кислот:
HNO3 27%
H2SO4 45%
H2O 28%
Принимаем, что в отработанной кислоте 3% АК в виде окислов азота связаны в нитрозилсерную кислоту по реакции (1):
2H2SO4 + N2O3![]() 2HNSO5 + H2O (1)
2HNSO5 + H2O (1)
Пересчитав состав кислот, получим:
HNO3 - 25%
H2SO4 - 45%
H2O - 26,1%
N2O3 - 0,9%
HNSO5 - 3%
Всего - 100%
В процессе разгонки кислотных смесей и гидролиза HNSO5 в колонне протекают следующие реакции:
- разложение HNSO5
2HNSO5 + H2O = 2H2SO4 + NO2 (2)
- разложение HNO3
2HNO3![]() 2NO2 + H2O + 1/2O2 (3)
2NO2 + H2O + 1/2O2 (3)
2HNO3![]() N2 + H2O + 2*1/2 O2 (4)
N2 + H2O + 2*1/2 O2 (4)
- разложение N2O3
N2O3(газ) ![]() NO (газ) + NO2 (газ) (5)
NO (газ) + NO2 (газ) (5)
В колонну ГБХ поступает:
1. Отработанная кислота в количестве 1000 кг,
В том числе:
HNO3 - 250 кг
H2SO4 - 450 кг.
H2O - 261 кг.
N2O3 - 9 кг.
HNSO5 - 30 кг.
2. Купоросное масло 91% - х кг.
3. Перегретый пар – у кг.
4. Воздух, подсасываемый из помещения
Из колонны выходит:
1. Разбавленная 70% H2SO4=![]() кг
кг
2. Крепкая 98% HNO3 = ![]() =242,3 кг
=242,3 кг
Похожие работы
... в зимнее время (25 ºС)Глубина промерзания грунта 4,5 мСкоростной напор ветра 35 кг/м3Уровень грунтовых вод 6 м 2. Характеристика производственного процесса: фаза концентрирования серной кислоты относится к В - Iа /3/ группе производственных процессов,категория взрывопожароопасности – А; режим работы – трехсменный, непрерывный.Здание концентрирования имеет в плане прямоугольную форму.Длина ...
... (ОР) на кг осадка. Промывку проводят из расчета 5 л воды на 1 кг ОСВ, после чего в промывную воду добавляют концентрированный отработанный травильный раствор и свежую серную кислоту и полученный раствор используют на последней стадии кислотной обработки. Отмывка ОСВ водой позволяет также сократить расход щелочного реагента на нейтрализацию ОСВ. Нейтрализация ОСВ необходима, т.к. кислые осадки ...
... , а также при дроблении горячих слитков, разгрузке и ремонте доменных печей и т.п. 2. Методическая разработка факультативных занятий по химии На основе дипломной работы были разработаны факультативные занятия в виде лекций по теме Бризантные взрывчатые вещества для учащихся старших классов средней общеобразовательной школы. Задачи факультативных занятий: 1. Повысить познавательный ...
... - Примеры продукционных систем с рециклированием материалов Оценка воздействия на окружающую среду за полный жизненный цикл. Этап оценки воздействий направлен на определение значимости потенциальных воздействий на окружающую среду по результатам инвентаризационного анализа стадий жизненного цикла. В широком смысле этот процесс включает в себя увязывание между собой инвентаризационных данных с ...



0 комментариев