Навигация
Методы разделения иммуноглобулинов
КАЗАХСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ
Кафедра биохимии
РЕФЕРАТ
«Методы выделения иммуноглобулинов»
Выполнила Сулемейнова Г.
Руководитель: доктор биологических наук,
профессор Жумашев Ж.Ж.
Алматы, 1999 год
ВВЕДЕНИЕ
Иммуноглобулины - основные защитные белки организма, так как они обладают свойствами различных антител. Они содержатся в крови, молозиве и молоке, слюне и других жидкостях. С их количеством и активностью связаны жизнестойкость, физиологическое состояние и продуктивность животных.
В работе описаны свойства иммуноглобулинов, как белков, а также способы разделения иммуноглобулинов сельскохозяйственных животных.
Представленные данные по характеристике, выделению иммуноглобулинов, могут дать современные представления о защитных белках животных.
ИММУНОГЛОБУЛИНЫ - СПЕЦИФИЧЕСКИЕ ФАКТОРЫ ГУМОРАЛЬНОГО ИММУНИТЕТА
Важнейшие факторы специфического иммунитета - иммуноглобулины, осуществляют гуморальную защиту организма.
Дж.Хереманс (1959), изучая активность иммунной сыворотки человека, обнаружил, что антитела содержатся, по меньшей мере, в трех фракциях сыворотки: в - и в двух фракциях - глобулинов, называемых 2А и 2М - глобулинами. Эти фракции, активные в иммунологическом отношении, Хереманс предложил назвать иммуноглобулинами (Ig). Предложение Дж.Хереманса легло в основу международной номенклатуры, принятой в 1664 г. специальной комиссией ВОЗ. По этой номенклатуре -глобулин называется IgG, B2A-глобулин - IgA и В2М - IgM. Иммуноглобулин состоит из двух легких (L) и двух тяжелых (Н) полипептидных целей. Причем каждый класс иммуноглобулинов характеризуется особым типом тяжелых цепей , , , d, .
Легкие цепи бывают двух типов - или , каждвй из которых отличается С- концевой последовательностью аминокислот. Как тяжелые, так и легкие цепи состоят ив двух различных участков (областей) - вариабельной (V) и постоянной (С). С-концевая половина полипептидной цепи имеет постоянную аминокислотную последовательность, а ее N - концевая часть - вариабельную. Каждый постоянный (Сl) и вариабельный (Vl) участок легкой цепи включает 107-110 аминокислотных остатков.
Тяжелые цепи построены их четырех участков - VH, C1H, C2H, C3H. Вариабельные участки их состоят приблизительно из 110-114 аминокислотных остатков, постоянные - 330.
В вариабельной части полипептидных цепей находятся определенные, так называемые "гипервариабельные участки", с наибольшим числом аминокислотных замен. В легких цепях они расположены между 24-34; 52-55; 89-97 аминокислотными остатками. Гипервариабельные участки тяжелых цепей занимают аналогичные положения, но точная локализация их пока не установлена (Кульберг, 1975; Поляк 1981).
Наличие вариабельных участков дает молекулам антител возможность приспосабливаться к разнообразным антигенным детерминантам. Строение постоянных областей тяжелых цепей определяет эффекторные функции молекул к поверхностям макрофагов. В-лимфоцитов, тучных клеток, а также проникновение через плацентарную мембрану (Егоров , 1972; Leslie, Cohen, 1973).
Гибкость молекул иммуноглобулинов, обеспечивающая приспособляемость к различным конфигурациям молекул антигена, обусловливается также наличием особого "шарнирного участка" в середине тяжелых цепей, содержащего много остатков аминокислоты пролина и препятствующего образованию вторичной структуры.
В настоящее время на основании изучения первичной структуры полипептидных цепей выдвинута так называемая "доменная" гипотеза строения иммуноглобулинов, согласно которой молекулу иммуноглобулинов можно разбить на участки с относительно независимыми конфигурациями в виде глобул. Каждый домен состоит приблизительно из 100-110 аминокислотных остатков и имеет одну дксудьфидную связь, которая связывает участки цепей, образуя петлю из 60 аминокислотных остатков (Еdelman, 1970; Незлин, Рохлин, 1970; Роljak, 1972).
Молекула иммуноглобулина G состоит из 12 доменов: по 4 в тяжелых и по 2 в легких полипептидных цепях (рис.1). Используя молекулярные модели и ряд общих термодинамических принципов укладки третичной структуры белков, установлено, что конформации всех 12 доменов иммуноглобулина G характеризуются большим количеством - складок и наличием одно-двух витков - спиральной структуры (Завьялов, Троицкий, 1973).
На основании изучения воздействия протеолитических ферментов сделан вывод, что молекулы иммуноглобулинов состоят из в трех фрагментов двух типов, связанных гибкими участками полипептидных цепей: два из них названы Fab- и один Fc- фрагментами (Рогtег, 1959, 1960; Utsumi Karush, 1955, 1967).
В состав FAB- фрагментов входят целая легкая цепь и N - концевая половина тяжелой цепи. Структурная особенность FAB- фрагмента наличие двух глобулярных субъединиц - V и С. V построена из двух доменов VH и V1L, а С- из CL и C1H. Fc-фрагмент содержит по два домена - C2H и Сн3 (Роljak, 1972).
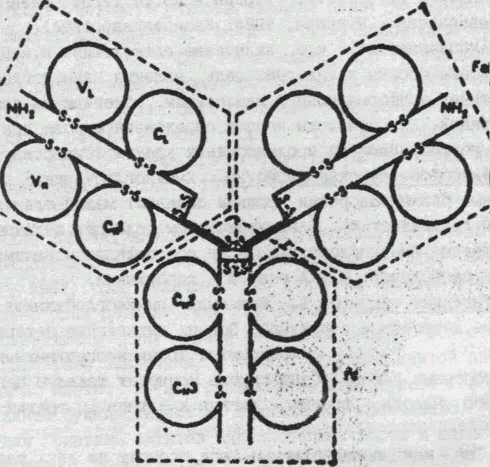
Рис. 1. Схема строения молекулы IgG1 человека (из книги Иммуноглобулины".- М.: Мир., 1981).
L- цепи разделены на две гомологичные области VI. (вариабельная) и СL (константная). Утолщенные линии Н-цепей соответствуют шарнирному участку. Показаны 4 гомологичные области Н-цепей (VF, С1Н, С2Н, С3Н), внутри - и межцепочные дисульфидные связи, N- концевые участки обоих цепей и основные фрагменты (FAB, FAB' и Fc).
В состав молекул некоторых классов иммуноглобулинов входят дополнительно полипептидные цепи. В молекуле сывороточного и секреторного иммуноглобулина А она названа J- цепочкой. (НАLPERN, KOSHLAND, 1970). Выяснено, что аналогичные полипептиды содержатся также и в молекулах иммуноглобулина М (Меstresky et al., 1971). J-цепочки иммуноглобулинов М и А имеют одинаковые молекулярную массу, электрофоретическую подвижность, антигенную специфичность и аминокислотный состав (Меtresky et al, 1971; Моrrison, Коshland, 1972). В полимерных молекулах иммуноглобулинов различных видов животных также содержится полипептид, аналогичный полипептиду J- цепочки иммуноглобулинов человека (Kobajashi et al, 1973).
Молекулярная масса J- цепи колеблется от 14 000- 27000. Такое расхождение объясняется, по-видимому, склонностью J цепей образовать димеры (Коshland, 1975). Содержание углеводов в них около 7,5 моль %. Определен аминокислотный состав J- цепей выделенных из IgA и IgМ человека, а также животных. Изолированные цепи отличаются высоким содержанием аспарагиновой, глутаминовой кислот и цистеина и почти полным отсутствием трипто-фана (Morrison, Коshland, 1972; Zikand 1972; Kehoe et al, 1972; Mestesky et al 1975).
Предполагается, что J цепи необходимы для присоединения секреторного компонента к IgA и облегчают димеризацию IgA b и полимеризацию IgМ. По мнению Л.В.Часовниковой и др. (1983), большая информационная стабильность молекул IgA, по сравнению с IgM обусловлена наличием J- цепи, объединяющей молекулу IgA в димерную форму.
В состав секреторного IgА входит еще один полипептид, названный секреторным компонентом (Brandtzaeg, 1968, 1974; Fomasi et al, 1968). Секреторный компонент обнаружен у всех видов сельскохозяйственных животных, коров (Mashetal, 19б9; Butler et al, 1972); свиней (Bourle, 1969); кроликов (Halperl, Koshland, 1970); овец и коз (Pahud Mach, 1970); лошадей (Pahud Mach, 1972). Он существует как в связанном с секреторным IgA - (сСК), так и в свободном виде - (нСК). Молекулярная масса связанного и свободного секторного компонентов у человека колеблется от 50 000 до 90 000, у овец, коз и лошадей молекулярная масса нСК 80 000- 85 000 (Pahud Mach, 1970, 1972). Содержание углеводов - 15,9 - 22,8%. Определен также аминокислотный состав свободного секреторного компонента у человека, крупного рогатого скота и собаки (O’Daily, Cerba, 1971; Fomasi, Jrey, 1972; Mestesky, 1972; Fhopson et al, 1975).
Секреторный компонент связан о шарнирной областью молекулы IgА в зоне расположения углеводов (Winkelhanke, 1979). Полагают, что его функция заключается в защите секреторного IgА от воздействия протеолитических ферментов, что очень важно (Стефани, 1973; Чернохвостова, 1974).
Активные центры - участки молекул, от которых зависит способность антител специфически связываться с антигеном. Обычно они занимают небольшой участок (приблизительно 2% от всей поверхности целой молекулы антитела), который , находясь в Fab- фрагментах, придает молекуле иммуноглобулина уникальные изменчивость и специфичность (Носсел, 1973).
Известно, что в построении активного центра участвуют только гипервариабельные участки как тяжелых, так и легких цепей Fab-фрагмента (Poljak et al, 1973, Padlan et al, 1973; Leslie et al, 1973). При этом основная роль принадлежит тяжелым цепям, а легкие участвуют в пространственной организаций тяжелых, препятствуя их агрегации.
Углеводные компоненты. Все классы иммуноглобулинов отличаются друг от друга количественным содержанием углеводного компонента. Наиболее богаты углеводами иммуноглобулины М, А, Е и Д (7,5 - 12,0%). В молекулах IgG содержится около 2,9% углеводов. В составе иммуноглобулинов обнаружены манноза, галактоза, галактозамин, глюкозамин, фукоза и сиаловая кислота.
Изучение углеводных групп представляет большой интерес, обусловленный их участием в самосборке молекулы иммуноглобулина М из полимеризующихся субъединиц ( Каверзнева и др., 1975; Лапук и др., 1975; Хургин и др., 1975; Каверзнева , 1981; Каверзнева , Чухрова, 1984; Каверзнева, 1984).
Предполагается, что включение глюкозомина и маннозы на раннем этапе сборки в тяжелую цепь молекул иммуноглобулинов способствует конформационным изменениям, облегчающим замыкание S-S- связей. Эти углеводы играют определенную роль при секреции иммуноглобулинов из продуцируемых клеток (Сидорова, 1971).
Электрофоретические свойства. Иммуноглобулины - наименее заряженные белки сыворотки крови и обладают малой электрофоретической подвижностью. В электрическом поле при щелочных значениях среды иммуноглобулины G и его подклассы занимают область - гдобулинов, М и А зону - глобулинов.
Антигенные свойства. 1. Молекулы иммуноглобулинов имеют различные антигенные структуры. Все их антигенные детерминанты кодируются тремя несцепленными группами аутосомных генов. Одна группа кодирует тяжелую цепь того или иного класса, другая - легкую k- типа, третья - легкую -типа.
2. Так как полипептидные цепи состоят из двух различных участков- вариабельного (V) и постоянного (С), каждая из трех групп генов включает набор генов вариабельной - V и постоянной областей -С-гены. Таким образом, синтез каждой полипептидной цепи молекулы иммуноглобулина контролируется двумя структурными генами, а не одним, как при синтезе других белков. Один ген кодирует вариабельную область цепи, другой- постоянную. Этот факт дополняет существующее правило "один ген - одна полипептидная цепь" (Фуденберг и др., 1975). Причем существуют многие гены для вариабельных областей полипептидной цепи, что связано с многообразием специфических активных центров.
3. Выяснилось, что V-гены тесно сцеплены c С-генами и располагаются не только на одной хромосоме», но и в непосредственной близости. Сборка целой молекулы иммуноглобулина происходит из двух тяжелых и двух легких цепей ( 2Н2Lк или 2Н2L), синтезированных по генетическим матрицам, расположенным в двух разных хромосомах. По некоторым представлениям (Кульберг, 1985; Петров, 1987), вначале соединяется одна из легкой и тяжелой цепей, а затем обе части собираются в целую молекулу.
4. Показано, что в одной хромосоме расположены гены, детерминирующие синтез V- участка тяжелой цепи, а также гены С-участка иммуноглобулинов G, М, А , т.е. в одной цепочке находятся гены V, С, С, С. Установлено, чтоVH участок цепи, кодируемый одним геном, может быть обнаружен в составе IgМ, IgG и IgA, т.е. может быть соединен с постоянными участками тяжелых цепей разных классов - С, С, С. Вопрос о выборе клеткой V- или С- гена при синтезе иммуноглобулина изучался многими авторами.(Незлин, 1972, Рохлин , 1976, Петров, 1982, 1987).
Каждая индивидуальная клетка вырабатывает антитела только одной специфичности по правилу "одна клетка " одно антитело" (Петров , 1987). Это означает, что в клетке активно функционируют только один вариант гена VH, один - гена СH и по одному соответствующему гену одной из легких цепей. Все остальные структурные гены выключены. В каждой отдельно взятой антитело-образующей клетке из всего множества структурных генов иммуноглобулинов функционирует их минимальное количество, необходимое для синтеза антител одной специфичности и одного типа. Таким образом, в основе многообразия специфичности антител лежит функционирование в лимфоидной системе большого количества клеток и их потомков -клонов клеток- продуцентов одного вида антител. Следовательно, количество специфичностей антител соответствует количеству клонов клеток- антителопродуцентов, различающихся генами, функционирующими в них.
Установлено, что V-ген данной специфичности способен поо^ чередно ассоциировать с генами, кодирующими С, С, С, т.е.антителообразующие клетки способны переключать синтез иммуноглобулина М на IgG и на IgA, не изменяя антительной специфичности. Таким образом, антитела против альбумина быка могут находиться как во фракции IgG, так и во фракциях: иммуноглобулинов М и А.
КЛАССЫ И ПОДКЛАССЫ ИММУНОГЛОБУЛИНОВ
Как уже указывалось, иммуноглобулины имеют общие характерные свойства. Однако их отдельные классы и подклассы отличаются первичной структурой, антигенными и физико-химическими свойствами и биологической активностью.
а) Иммуноглобулины класса G. IgG представляет собой наиболее изученное антитело, в большом количестве присутствующее в сыворотках крови всех млекопитающих и птиц. IgG составляет около 70-80% от общего содержания иммуноглобулинов. Молекулярная масса - 150 000 - 160 000 (Незлин, 1972).
Молекула иммуноглобулина G- построена из двух тяжелых и двух легких полипептидных цепей, соединенных дисульфидными связями. Характерны тяжелые полипептидные цепи. IgG человека существует в виде 4 подклассов (G1, G2, G3, G4, отличающихся строением постоянных участков тяжелых цепей, а следовательно, и антигенными и биологическими свойствами (Незлин, 1972, Герман и др., 1977, Басова, Стефани, 1977). Подклассы различаются 2 количеством дисульфидных связей, соединяющих тяжелые цепи: в молекулах G1 и G4 их по 2, в G2, - 4, а в G3, -5. IgG1 составляет 70% от общего содержания IgG, а IgG2, IgG3, IgG1 18, 8 и 3%, соответственно.
У всех изученных видов животных найдены два подкласса IgG: относительно медленно передвигающиеся в электрическом поле G2 и более подвижные G1. Их молекулы имеют различные антигенные и биологические свойства, а также способность к перевариванию протеолитическими ферментами (Незлин, 1972).
Расшифрована первичная структура обеих цепей иммуноглобулина G1 (Edelman, 1973). Тяжелые цепи его состоят из одной вариабельной области - VH и 3 постоянных участков - Сн1, Сн2 и Сн3. Длину вариабельных областей составляют 114, а постоянных - 330 аминокислотных остатков, легкие из областей V1, СL.
С помощью электронной микроскопии (Valentine, Jreen, 1967), выяснено, что молекула иммуноглобулина G имеет V-образную форму, при этом Fab фрагменты образуют "лапки" молекулы , а Fc- фрагмент - ее "хвост". Она имеет два активных центра, находящихся в вариабельной части молекулы, а именно на кончиках Fab фрагментов.
При электрофорезе в щелочных значениях рН IgG передвигается медленнее всех сывороточных белков. При иммуноэлектрофорезе он образует вытянутую в дугу линию преципитации, прокрывающую зону расположения - глобулинов (Незлин, 1972). Нативная молекула IgG1 обычно не содержит свободных сульфгидрильных групп (Троицкий и др., 1965, Cristian, 1965). IgG содержит около 2,9% углеводов, которые находятся в тяжелых цепях (Незлин , 1968).
У человека только IgG способен проникать через плаценту и попадать в кровеносную систему плода, обеспечивая тем самым пассивный иммунитет новорожденных в ранний постнатальный период (Брондэ, Рохлин, 1978).
б) Иммуноглобулины класса М. IgМ - один из высокомолекулярных белков сыворотки крови и имеет молекулярную массу около 1 млн, константу седиментации 19 Se. Молекула IgМ состоит из 5 субъединиц, каждая из которых напоминает молекулу IgG (рис. 2). Субъединица состоит из двух тяжелых и двух легких цепей с молекулярными массами 23 000 и 60 000 соответственно, - цепь состоит из 5 доменов VH, С1- С4, легкая - изVL, и СL. Молекула 1IgM имеет 10 активных центров, расположенных в Fab областях ( Прокопенко, Равич-Щербо, 1974, Литмен , Гуд, 1981).
IgМ содержит около 10% углеводов., функция которых обусловлена с образованием макромолекулы IgM из 7 S субъединиц к формированием пространственной структуры молекулы (Каверзнева, 1984). IgМ по рваному реагирует на восстановление 2- меркаптоэтанолом: при мягком он распадается на 5-7 S субъединиц, а при более глубоком на тяжелые и легкие полипептидные цепи.
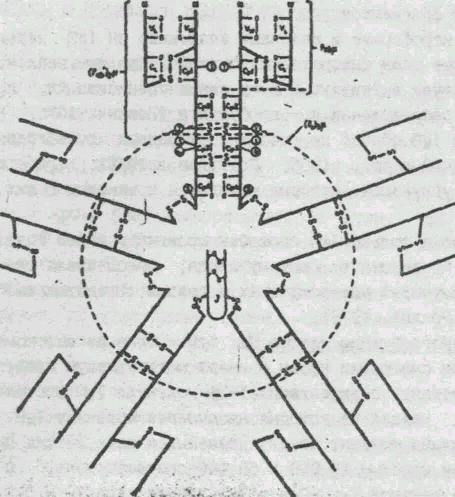
Рис. 2. Схема строения молекулы IgМ
( из книги "Иммуноглобулины". -М.: Мир, 1981).
Радиальная упаковка субъедикиц IgМ, на одной из которых расположение гомологичных областей (доменов) L- (VL .и СL) и H--цепей (VH, С1, С4). Показаны наиболее важные продукты ферментативной фрагментации IgМ и предполагаемое положение J- цепи.
Важнейшее свойство молекулы IgМ, необходимое для ее функционирования - конформационная подвижность при изменении условий внешней среды (Каюшина и др., 1985, Свергун и др., 1585). При электрофорезе IgМ передвигается быстрее иммуноглобулинов класса G во фракции 2- глобулинов. Найдено 2 подкласса IgМ, с различными антигенными свойствами (Гауровец, 1969, Бернет, 1971, Незлин , 1972, Кульберг , 1975).
Не менее значительно нахождение его на поверхности -лимфоцитов в качестве их основных рецепторов (Петров, 1987). IgM обнаружен у всех исследованных позвоночных (Koshland, 1975). У человека после 45 лет содержится 1,71 мг/мл IgМ или около 10% от общего количества иммуноглобулинов (Стефани, Вальтищев, 1977). IgM- антитело первичного иммунного ответа, так как синтезируется первым после антигенной стимуляции. Через несколько дней синтез IgМ переключается на IgG, а позже -на IgА (Петров , 1987).
IgM в основном имеет внутрисосудистую локализацию, небольшое количество его обнаружено в тканевых жидкостях, но в слизистых выделениях он обычно отсутствует (Jonas, 1972). У большинства же животных (кроме кроликов) IgM через плаценту проходить не может ( Маслянко , 1973).
в) Иммуноглобулины класса А. IgA впервые идентифицирован в сыворотке крови человека иммуноэлектрофорезом как 2А-глобулин (Burtin et al, 1957, Грабар, Буртэн, 1963).
Иммуноглобулин А- один из наименее изученных защитных белков человека и животных. Это объясняется исключительно низким его содержанием в нормальной сыворотке крови, трудностями выделения, а также некоторым сходством с иммуноглобулинами класса 6 и другими белками неиммуноглобулиновой природы.
Существуют компоненты IgА с константами седиментации 7S, 11S, 13S, 15S5, 17S. В полимерных формах иммуноглобулина А (рис. 3) обнаружен дополнительный полипептид J цепь (Halpern, Koshland, 1970).
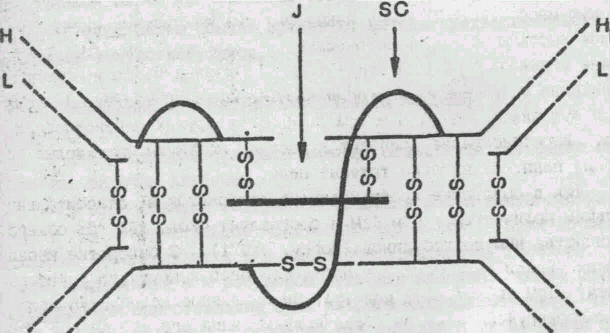
Рис.3 Строение молекулы IgA
(из книги Р. В. Петрова "Иммунология". -М.: Медицина, 1987).
SС- секреторный компонент; j- соединяющая; H-тяжелые; L-легкие цепи
В нормальной человеческой сыворотке найдены два антигенно различающихся подкласса IgA - А1 и А2 (Vaerman, Hereman, 1966, Kunkel, Prentergast, 1966, Feinstein, Franklin, 1966, Fomasi, Yrey, 1972). IgA2 существует в виде димеров, соединенных дисульфидной связью, а тяжелые и легкие цепи связаны нековалентными связями (Yrey et al, 1968, Незлин, 1982). Оба подкласса IgA обладают активностью антител (Dorrington, Fanford, 1970, Бернет, 1971). Молекулы IgА, содержащиеся в различных секретах - молоке, молозиве, пищеварительных соках, слюне, моче и т.д., имеют константу седиментации 11S и содержат дополнительную полипептидную цепочку- секреторный компонент с молекулярной массой 50 000 - 60 000 (Brandt et al, 1968, 1975, Fomasi et al, 1965, 1968).
Иммуноглобулины А слюны и пищеварительного тракта устойчивы к действию протеолитических ферментов - пепсина и трипсина (Ballierex et al, 1969, Porter, Noakes, 1970). Эта резистентность связана с присутствием секреторного компонента синтезированного в выделяющей секрет железе и затем присоединенного к молекуле IgA с образованием димеров из двух его молекул (Стефани, 1973, Чернохвостова, 1974, Першин, 1980).
Поэтому в секретах IgA обычно находится в виде димеров или тримеров Гаврилова , 1976). Мономеры IgА имеют молекулярную массу 160 000. IgА у некоторых видов животных имеет более высокую электрофоретическую подвижность, чем IgМ. Содержание углеводов высокое -10%. Молекулярная масса в основном, одинакова с IgG1, а у некоторой части популяции молекул IgA она промежуточная между IgA и IgM. Как и у других иммуноглобулинов, восстановление приводит к распаду молекулы на тяжелые и легкие цепи. Характерны тяжелые цепи.
IgA в сыворотке крови человека содержится в относительно большем количестве, чем IgМ и составляет около 19% от общего количества иммуноглобулинов (Hobby, 1971). В сыворотке крови многих видов животных, в частности овец и крупного рогатого скота, IgM преобладает над IgA. Значительное количество этого белка обнаружено в лимфе, где концентрация его в 2-18 раз выше, чем в крови (Стефани, 1971). Антитела найдены и в содержимом кишечника и фекалиях, 80% которых приходится на долю IgА. Антитела, выделяющиеся в кишечник в устойчивой к гидролизу форме, играют важную роль в защите организма от кишечных инфекций (Fomsi, Yrey, 1972). IgА находится на поверхности слизистых оболочек и активно участвует в местной иммунологической защите (Герберт, 1974).
г) Иммуноглобулины класса D. IgD также изучен недостаточно. Впервые он охарактеризован как четвертый класс иммуноглобулинов D.Rowe, G.Fahey (1965). Его молекулярная масса около 180000. Молекула IgD состоит из двух легких и двух тяжелых полипептидных цепей, связанных дисульфидными мостиками (Vunnar, Fohansson, 1969, Spiegelberg, 1977, Ruddick, Leslie, 1977). Роль в организме человека почти не изучена. Полагают, что он - секреторный иммуноглобулин. Сывороточный IgD обнаружен только у человека и приматов. При электрофорезе в агаровом геле подвижность IgD соответствует подвижностям и глобулинов. Точных экспериментальных данных о присутствии IgD у животных пока не имеется.
д) Иммуноглобулины класса Е. IgE впервые идентифицирован K. Ishisaka, F. Fshisaka (1966). Молекулярная масса IgЕ 190 000, константы седиментации 8 S. Молекула IgE также состоит из двух легких и двух тяжелых полипептидных цепей, молекулярная масса которых 22 600 и 72 500 соответственно. Содержание углеводов свыше 12% (Шаханина, Стоев, 1981). IgE играют важную роль в патогенезе аллергии (Isgizaka, Ishizaka, 1976, Dorrington, Bennich, 1978). К.Г.Стоев (1979) разработал методы выделения и количественного определения D и Е иммуноглобулинов в сыворотке крови здоровых и больных людей.
ПРЕПАРАТИВНОЕ ВЫДЕЛЕНИЕ ИММУНОГЛОБУЛИНОВ
Для выделения иммуноглобулинов из сыворотки крови животных, особенно G1, М и А, применяют различные методы получения предварительно очищенных белков, обогащенных соответствующими иммуноглобулинами. Дальнейшую очистку проводят ионообменной хроматографией на ДЭАЭ- сефадексе А-50, ДЭАЭ- целлюлозе ДЕ-52, гель-фильтрацией на сефедексе G-200 или препаратным электрофорезом.
ПРИГОТОВЛЕНИЕ ПРЕДВАРИТЕЛЬНО ОЧИЩЕННЫХ
ПРЕПАРАТОВ ИММУНОГЛОБУЛИНОВ
С этой целью обычно применяют методы предварительного выделения иммуноглобулинов.
ОСАЖДЕНИЕ 4 М РАСТВОРОМ СУЛЬФАТА АММОНИЯ
Похожие работы
... на его течение профессиональные вредности и стрессовые ситуации. Все это необходимо учитывать при диагностике и лечении атопического дерматита у пациентов разных возрастных группК л и н и ч е с к и е ф о р м ы а т о п и ч е с к о г о д е р м а т и т а. Единой классификации форм атопического дерматита в литературе нет. Многие авторы, в зависимости от возраста больных выделяют несколько форм ...
... удовлетворительного фракционирования белков объем наносимого раствора не должен превышать 3-5% общего объема колонки. Ввиду этого к гель-хроматографии обычно прибегают в середине или на завершающих этапах выделения белка. Разумеется, при отделении низкомолекулярных примесей, в частности при обессоливании, объем образца может быть значительно большим, поскольку не требуется высокого разрешения. В ...
... ориентация V генов у них изменена. Следует отметить, что сомовые и лососевые являются довольно специализированной группой, возникшей в эволюции относительно недавно (Рис. 8). Особенности организации генов легких цепей у этих таксонов могут представлять собой новоприобретенные признаки (Romer, 1966). В связи с этим особый интерес представляет изучение структры и организации генов L-цепей ИГ у ...
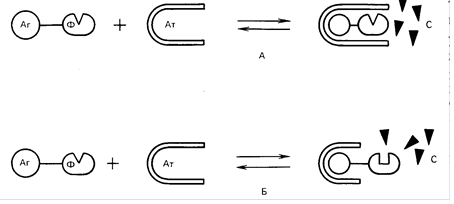
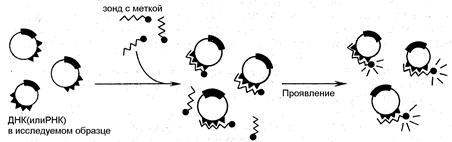
... зондирование нельзя отнести к методам иммунохимического анализа, основной его принцип (взаимодействие комплементарных структур) методически реализуется теми же способами, что и индикаторные методы иммунодиагностики. Кроме того, методы генного зондирования позволяют восполнить информацию об инфекционном агенте в отсутствии его фенотипической экспрессии (вирусы, встроенные в геном, «молчащие» гены ...



0 комментариев