Навигация
Определение энергии активации
2.1 Определение энергии активации
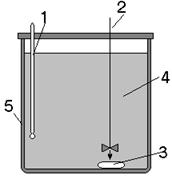
При проведении кинетических исследований следует убедиться в безградиентности процесса: повышение интенсивности перемешивания не приводит к росту константы скорости реакции.
Для определения энергии активации необходимо провести не менее двух периодических опытов при различных температурах. В каждом из опытов при фиксированных температурах ![]() и
и ![]() (
(![]() должно быть не менее 100 С для уменьшения погрешности в численном значении энергии активации Е) определяют зависимость доли нерастворившегося компонента от продолжительности растворения:
должно быть не менее 100 С для уменьшения погрешности в численном значении энергии активации Е) определяют зависимость доли нерастворившегося компонента от продолжительности растворения: ![]() и
и ![]() ,
, ![]() (
(![]() - степень растворения вещества). При этом время растворения вещества
- степень растворения вещества). При этом время растворения вещества ![]() и концентрация растворителя во всех опытах должно быть одинаковым или необходимо фиксировать время достижения одинаковых степеней растворения вещества, а все остальные параметры системы должны остаться неизменными.
и концентрация растворителя во всех опытах должно быть одинаковым или необходимо фиксировать время достижения одинаковых степеней растворения вещества, а все остальные параметры системы должны остаться неизменными.
Кинетические функции растворения могут быть представлены в виде:
 (12)
(12)
Если сравнить скорость растворения при равных значениях ![]() , то
, то ![]() и
и ![]() (т.к. начальные концентрации одинаковы исходя из начально заданных условий, а изменение концентрации в ходе растворения стехиометрически связано с долей растворившегося продукта). Поэтому для равных значений
(т.к. начальные концентрации одинаковы исходя из начально заданных условий, а изменение концентрации в ходе растворения стехиометрически связано с долей растворившегося продукта). Поэтому для равных значений ![]() можно записать:
можно записать:
 (13)
(13)
Отношение, стоящее в правой части уравнения (13), не зависит от времени.
Интегрируя это уравнение и подставляя вместо ![]() и
и ![]() их значения, равные
их значения, равные ![]() и
и ![]() , получим окончательно:
, получим окончательно:
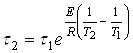 (14)
(14)
Необходимо подчеркнуть, что ![]() и
и ![]() означают время, необходимое для достижения одного и того же значения
означают время, необходимое для достижения одного и того же значения ![]() в первом и втором опытах.
в первом и втором опытах.
Уравнение (14) показывает, что зависимость ![]() от
от ![]() выражается аппроксимирующей линией, тангенс угла наклона которой к оси абсцисс численно равен энергии активации Е/R.
выражается аппроксимирующей линией, тангенс угла наклона которой к оси абсцисс численно равен энергии активации Е/R.
Вместо определения углового коэффициента прямой, энергию активации можно вычислить по формуле:
 (15)
(15)
Вычисления по формуле (15) в других интервалах ![]() дадут набор значений Е, из которого легко получить наиболее достоверное (среднее) значение энергии активации и среднюю ошибку её определения, которая не должна быть более 10%. В противном случае необходимо искать ошибку в постановке эксперимента или в расчетах. Возможно также изменение механизма процесса растворения. В последнем случае необходимо сузить температурные интервалы и увеличить количество экспериментов.
дадут набор значений Е, из которого легко получить наиболее достоверное (среднее) значение энергии активации и среднюю ошибку её определения, которая не должна быть более 10%. В противном случае необходимо искать ошибку в постановке эксперимента или в расчетах. Возможно также изменение механизма процесса растворения. В последнем случае необходимо сузить температурные интервалы и увеличить количество экспериментов.
2.2 Определение порядка реакции
химический процесс растворение
Для определения порядка реакции нужно провести не менее двух периодических опытов при одной и той же температуре, но при различных начальных концентрациях активного реагента ![]() ≠
≠![]() . В этих опытах определяют зависимости доли нерастворившегося компонента от продолжительности растворения
. В этих опытах определяют зависимости доли нерастворившегося компонента от продолжительности растворения ![]() и
и ![]() . Кроме того, необходима информация об изменении концентрации активного реагента в ходе растворения, т.е. зависимости
. Кроме того, необходима информация об изменении концентрации активного реагента в ходе растворения, т.е. зависимости ![]() и
и ![]() , где
, где ![]() и
и ![]() - текущие концентрации активного реагента в первом и втором опытах. Эти зависимости могут быть получены либо прямыми измерениями (в тех же опытах), либо расчетным путем, исходя из стехиометрических соотношений. При этом необходимо учитывать, что данные полученные расчетным путем дают, как правило большую ошибку, чем экспериментальные данные (при условии грамотной постановки эксперимента). Затем по экспериментальным данным строят зависимость
- текущие концентрации активного реагента в первом и втором опытах. Эти зависимости могут быть получены либо прямыми измерениями (в тех же опытах), либо расчетным путем, исходя из стехиометрических соотношений. При этом необходимо учитывать, что данные полученные расчетным путем дают, как правило большую ошибку, чем экспериментальные данные (при условии грамотной постановки эксперимента). Затем по экспериментальным данным строят зависимость ![]() от
от ![]() , где
, где ![]() и
и ![]() отвечают равным значениям
отвечают равным значениям ![]() и
и ![]() . Из уравнений для скорости растворения (12) при равных значениях
. Из уравнений для скорости растворения (12) при равных значениях ![]() следует соотношение:
следует соотношение:
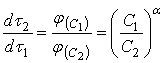 (16)
(16)
откуда
 (16а)
(16а)
Уравнение (16) относится к произвольному, но фиксированному значению ![]() . Отношение приращений
. Отношение приращений ![]() и текущие концентрации активного реагента
и текущие концентрации активного реагента ![]() и
и ![]() должны быть определены в точках, отвечающих этим значениям. Как и в случае определения энергии активации по уравнениям (14) и (15) вычисления по уравнению (16) или (16а) можно выполнить для целого ряда значений
должны быть определены в точках, отвечающих этим значениям. Как и в случае определения энергии активации по уравнениям (14) и (15) вычисления по уравнению (16) или (16а) можно выполнить для целого ряда значений ![]() и за тем усреднить полученные результаты. При этом необходимо помнить, что расхождения результатов параллельных изменений не должны превышать 10%.
и за тем усреднить полученные результаты. При этом необходимо помнить, что расхождения результатов параллельных изменений не должны превышать 10%.
Из изложенного выше следует, что определение порядка реакции много сложнее чем определение энергии активации, так как требует численного или графического дифференцирования полученной из опытов зависимости ![]() . Причина этого усложнения ясна: концентрация активного реагента в периодическом опыте, как правило, может изменяться в больших интервалах. В тоже время температуру в ходе опыта можно легко поддерживать постоянной, в пределах
. Причина этого усложнения ясна: концентрация активного реагента в периодическом опыте, как правило, может изменяться в больших интервалах. В тоже время температуру в ходе опыта можно легко поддерживать постоянной, в пределах ![]() . Определение порядка реакции можно упростить, если концентрацию активного реагента в ходе периодического опыта не изменять. Это достигается путем восполнения убыли реагента в ходе растворения (периодическое дозирование), или сделать это изменение пренебрежимо малым, проводя опыт с очень большим избытком активного реагента. Этого можно достичь предварительным расчетом, чтобы даже при полном растворении твердого растворяющегося вещества, концентрация растворителя не снизилась более, чем на 5-10% от исходной. Во всех выше описанных случаях правая часть уравнения (16) или (16а) должна являться постоянной величиной, поэтому
. Определение порядка реакции можно упростить, если концентрацию активного реагента в ходе периодического опыта не изменять. Это достигается путем восполнения убыли реагента в ходе растворения (периодическое дозирование), или сделать это изменение пренебрежимо малым, проводя опыт с очень большим избытком активного реагента. Этого можно достичь предварительным расчетом, чтобы даже при полном растворении твердого растворяющегося вещества, концентрация растворителя не снизилась более, чем на 5-10% от исходной. Во всех выше описанных случаях правая часть уравнения (16) или (16а) должна являться постоянной величиной, поэтому 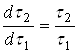 , и зависимость
, и зависимость ![]() является линейной.
является линейной.
Поэтому необходимость в дифференцировании отпадает, и расчетная формула для ![]() принимает вид:
принимает вид:
 (17)
(17)
причем ![]() и
и ![]() - теперь уже постоянные величины.
- теперь уже постоянные величины.
Похожие работы
... циклов. Как уже было отмечено, калориметрия используется для определения тепловых эффектов реакций, в частности она используется и для определения теплот растворения солей или других соединений в воде или других растворителях. Это является одной из самых интересных задач термохимии, так как выделение теплоты при растворении солей может быть использовано для разогрева или охлаждения тех или иных ...
... или кислот; так получают, например, золь гидроксида железа(III), имеющий следующее строение: {[Fe(OH)3]m n FeO+ · (n–x)Cl–}x+ x Cl– 4.2.2 Агрегативная устойчивость лиофобных коллоидов. Строение коллоидной мицеллы Лиофобные коллоиды обладают очень высокой поверхностной энергией и являются поэтому термодинамически неустойчивыми; это делает возможным самопроизвольный процесс уменьшения ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... реакции на альдегидную группу – окисляется оксидом серебра (1), присоединяет синильную кислоту (4): Химические свойства: 1. 2. 3. 4. 5. 6. 7. 8. Спиртовое брожение. Эта реакция характерна для гексоз. Она осуществляется с помощью биологических катализаторов – ферментов. При сбраживании гексозы превращаются в этиловый спирт. Для пентоз брожение ...

0 комментариев