Навигация
Уравнения кинетики растворения
1.2 Уравнения кинетики растворения
Общие уравнения диффузионно-кинетического режима получены Д.А. Франк-Каменецким в предположении, что условия диффузионного транспорта вещества могут приближенно считаться не зависящими от условий протекания химической реакции на поверхности. Это предположение справедливо в том случае, когда все участки поверхности можно считать одинаково доступными в диффузионном отношении (так называемая равнодоступная поверхность). Скорость реакции на поверхности ![]() пропорциональна концентрации активного реагента С у поверхности в некоторой степени
пропорциональна концентрации активного реагента С у поверхности в некоторой степени ![]() , определяющей формальный порядок реакции:
, определяющей формальный порядок реакции:
![]() (1)
(1)
Диффузионный поток к поверхности можно определить с помощью коэффициента массоотдачи ![]() :
:
![]() (2)
(2)
где ![]() - концентрация реагента в объеме.
- концентрация реагента в объеме.
В стационарном состоянии количество вещества, вступающее в реакцию на поверхности, равно диффузионному потоку:
![]() (3)
(3)
Уравнение (3) является общим уравнением диффузионно-кинетического режима. При ![]() , т.е. когда реакция имеет первый порядок, получаем:
, т.е. когда реакция имеет первый порядок, получаем:
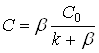 (4)
(4)
Для квазистационарной скорости реакции получим при ![]() :
:
![]() (5)
(5)
где 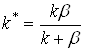 . (6)
. (6)
Это соотношение принимает особенно наглядный вид, если вместо константы скорости реакции и коэффициента массоотдачи рассматривать обратные им величины:
 (7)
(7)
Таким образом, полное сопротивление диффузионно-кинетического процесса равно сумме кинетического и диффузионного сопротивлений.
В случае обратимой реакции у поверхности устанавливается концентрация, соответствующая термодинамическому равновесию. Поэтому для простых реакций растворения, сводящихся лишь к образованию на поверхности сольватов и отводу их в раствор, предельный диффузионный поток определяется выражением:
![]()
где ![]() - концентрация насыщенного раствора,
- концентрация насыщенного раствора,
![]() - концентрация растворяемого компонента в объеме.
- концентрация растворяемого компонента в объеме.
Следовательно, в диффузионной области роль константы скорости реакции играет коэффициент массоотдачи ![]() , и наблюдаемая скорость процесса не имеет ничего общего с истинной кинетикой химической реакции.
, и наблюдаемая скорость процесса не имеет ничего общего с истинной кинетикой химической реакции.
Коэффициент массоотдачи ![]() зависит не только от физических свойств раствора, но и от гидродинамических условий взаимодействия частицы с окружающей её сплошной средой. К сожалению, даже в тех случаях, когда межфазовая поверхность может приблизительно рассматриваться как равнодоступная, количественная оценка с помощью уравнений (3) и (4) не может быть дана. Во - первых, мы не располагаем надежными данными для того, чтобы судить об интенсивности конвективной диффузии к частицам, взвешенным в растворе с помощью перемешивающего устройства. Во – вторых, межфазная поверхность совокупности растворяющихся полидисперсных частиц произвольной формы может быть оценена весьма приблизительно, особенно при степени растворения выше 10-20%. Кроме того, в процессе растворения удельная внешняя поверхность также является переменной величиной: функционально уменьшается во времени в зависимости от геометрического размера (диаметра) растворяющихся частиц.
зависит не только от физических свойств раствора, но и от гидродинамических условий взаимодействия частицы с окружающей её сплошной средой. К сожалению, даже в тех случаях, когда межфазовая поверхность может приблизительно рассматриваться как равнодоступная, количественная оценка с помощью уравнений (3) и (4) не может быть дана. Во - первых, мы не располагаем надежными данными для того, чтобы судить об интенсивности конвективной диффузии к частицам, взвешенным в растворе с помощью перемешивающего устройства. Во – вторых, межфазная поверхность совокупности растворяющихся полидисперсных частиц произвольной формы может быть оценена весьма приблизительно, особенно при степени растворения выше 10-20%. Кроме того, в процессе растворения удельная внешняя поверхность также является переменной величиной: функционально уменьшается во времени в зависимости от геометрического размера (диаметра) растворяющихся частиц.
К реакциям, происходящим в пористом материале выводы, полученные для равнодоступной поверхности, совершенно неприменимы.
Рассмотрение диффузионной кинетики дано в работах Я.Б. Зельдовича.
Для стационарного процесса макроскопическая скорость реакции определяется уравнением:
 (8)
(8)
С точностью до безразмерного множителя порядка единицы глубину проникновения реакции L можно определить так:
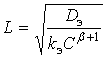 (9)
(9)
Для квазистационарного процесса диффузионный поток равен наблюдаемой скорости реакции. Поэтому:
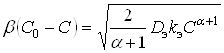 , (10)
, (10)
где ![]() - диффузионный поток активного реагента из объема жидкой фазы к поверхности твердого вещества.
- диффузионный поток активного реагента из объема жидкой фазы к поверхности твердого вещества.
Решая уравнение (10) относительно С и подставляя полученное значение в (8) при ![]() , получим:
, получим:
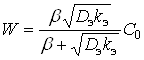 (11)
(11)
При растворении пористого материала или в случае, когда один из компонентов твердого тела не растворяется, а второй - растворяется возможны четыре предельные области:
1. При ![]() скорость суммарного процесса определяется диффузией в объеме и совпадает с предельным диффузионным потоком к равнодоступной поверхности, равной внешней поверхности пористого материала:
скорость суммарного процесса определяется диффузией в объеме и совпадает с предельным диффузионным потоком к равнодоступной поверхности, равной внешней поверхности пористого материала: ![]() . Концентрация активного реагента даже на поверхности пористого материала, а тем более внутри пор растворяющегося вещества, гораздо меньше, чем в объеме. Эту предельную область называют внешней диффузионной.
. Концентрация активного реагента даже на поверхности пористого материала, а тем более внутри пор растворяющегося вещества, гораздо меньше, чем в объеме. Эту предельную область называют внешней диффузионной.
2. При ![]() и
и ![]() (Н – полная толщина пористого слоя; L – глубина проникновения реакции, вычисленная по формуле (9); rn - средний диаметр пор) определяющей стадией является диффузия в порах. Концентрация активного реагента на поверхности растворяющегося вещества близка к концентрации в объеме жидкой фазы, но по мере удаления от поверхности пористого материала в глубину пор она снижается практически до нуля. Эта область называется внутридиффузионной.
(Н – полная толщина пористого слоя; L – глубина проникновения реакции, вычисленная по формуле (9); rn - средний диаметр пор) определяющей стадией является диффузия в порах. Концентрация активного реагента на поверхности растворяющегося вещества близка к концентрации в объеме жидкой фазы, но по мере удаления от поверхности пористого материала в глубину пор она снижается практически до нуля. Эта область называется внутридиффузионной.
3. ![]() и
и ![]() концентрация активного реагента в порах твердого вещества совпадает с концентрацией в объеме жидкой фазы. Такая ситуация возникает, если пористый материал черезвычайно доступен в диффузионном отношении (вещества с большим диаметром пор, а коэффициент диффузии в объеме жидкой фазы имеет тот же порядок, что и коэффициент диффузии в порах) и в то же время обладает относительно низкой химической активностью по отношению к растворителю.
концентрация активного реагента в порах твердого вещества совпадает с концентрацией в объеме жидкой фазы. Такая ситуация возникает, если пористый материал черезвычайно доступен в диффузионном отношении (вещества с большим диаметром пор, а коэффициент диффузии в объеме жидкой фазы имеет тот же порядок, что и коэффициент диффузии в порах) и в то же время обладает относительно низкой химической активностью по отношению к растворителю.
В этой внутрикинетической области вся поверхность пористого материала взаимодействует с активным реагентом при одной и той же концентрации ![]() и микроскопическая скорость реакции пропорциональна объему пористого материала.
и микроскопическая скорость реакции пропорциональна объему пористого материала.
4. При ![]() и
и ![]() реакция протекает только на внешней поверхности пористого материала. Это означает, что вследствие относительно высокой химической активности или малой пористости (вещества с очень малым диаметром пор, т.е когда диаметр пор и диаметр молекул растворителя или растворенного вещества имеют один порядок) реагент не проникает в глубь пористого материала. В то же время предельный диффузионный поток из объема к внешней поверхности твердого вещества во много раз больше скорости химической реакции. Такая область называется внешнекинетической. Микроскопическая скорость в этой области пропорциональна внешней поверхности пористого материала.
реакция протекает только на внешней поверхности пористого материала. Это означает, что вследствие относительно высокой химической активности или малой пористости (вещества с очень малым диаметром пор, т.е когда диаметр пор и диаметр молекул растворителя или растворенного вещества имеют один порядок) реагент не проникает в глубь пористого материала. В то же время предельный диффузионный поток из объема к внешней поверхности твердого вещества во много раз больше скорости химической реакции. Такая область называется внешнекинетической. Микроскопическая скорость в этой области пропорциональна внешней поверхности пористого материала.
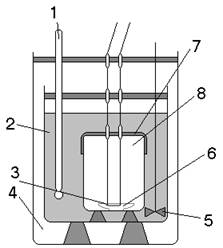
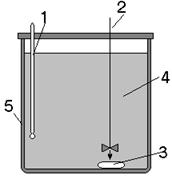
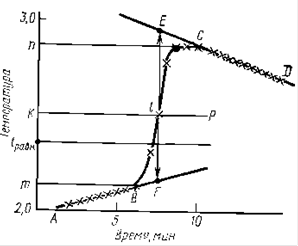
II. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ КИНЕТИЧЕСКИХ ХАРАКТЕРИСТИК
Похожие работы
... циклов. Как уже было отмечено, калориметрия используется для определения тепловых эффектов реакций, в частности она используется и для определения теплот растворения солей или других соединений в воде или других растворителях. Это является одной из самых интересных задач термохимии, так как выделение теплоты при растворении солей может быть использовано для разогрева или охлаждения тех или иных ...
... или кислот; так получают, например, золь гидроксида железа(III), имеющий следующее строение: {[Fe(OH)3]m n FeO+ · (n–x)Cl–}x+ x Cl– 4.2.2 Агрегативная устойчивость лиофобных коллоидов. Строение коллоидной мицеллы Лиофобные коллоиды обладают очень высокой поверхностной энергией и являются поэтому термодинамически неустойчивыми; это делает возможным самопроизвольный процесс уменьшения ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... реакции на альдегидную группу – окисляется оксидом серебра (1), присоединяет синильную кислоту (4): Химические свойства: 1. 2. 3. 4. 5. 6. 7. 8. Спиртовое брожение. Эта реакция характерна для гексоз. Она осуществляется с помощью биологических катализаторов – ферментов. При сбраживании гексозы превращаются в этиловый спирт. Для пентоз брожение ...

0 комментариев