Навигация
Поляризационные диаграммы потенциал – pH
1.6 Поляризационные диаграммы потенциал – pH
Теория коррозии – это не рядовое приложение кинетики и термодинамики электродных реакций, а одно из самых сложных направлений электрохимии. В настоящее время рождается новый метод исследования коррозии с помощью поляризационных диаграмм потенциал – pH.
Экспериментальное определение координат поляризационной диаграммы потенциал – pH можно осуществить, используя методику Марселя Пурбе.
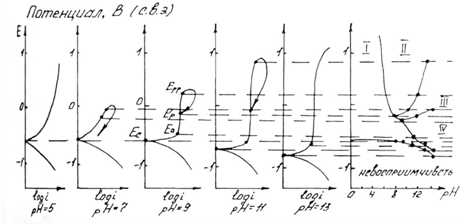
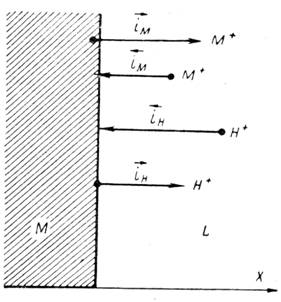
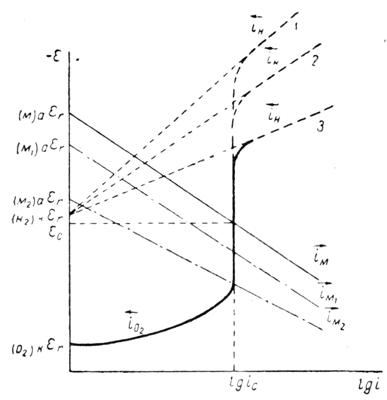
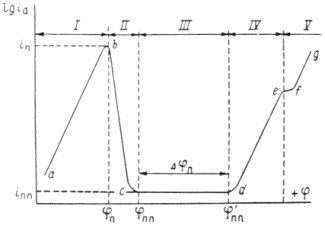
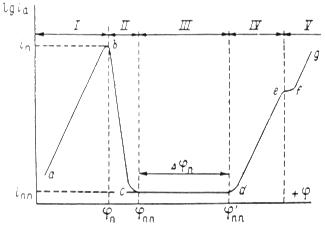
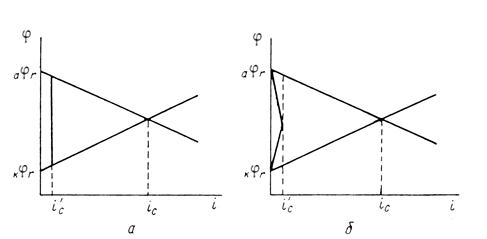
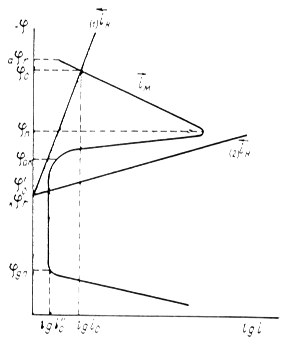
Рис. 1.6.1 - Метод построение экспериментальных диаграмм потенциал – pH: I – общая коррозия, II – питтинговая коррозия, III – неустойчивая пассивность, IV – пассивность
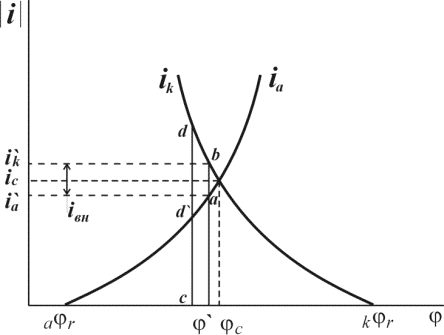
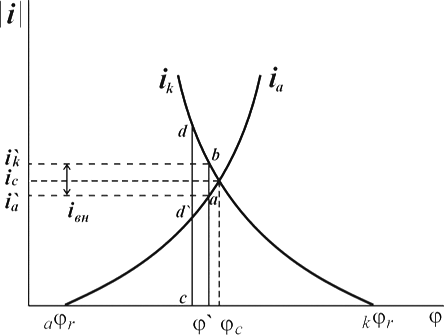
На рис. 1.6.1. схематически показаны пять потенциодинамических поляризационных кривых для железа в растворе хлорида при pH 5, 7, 9, 11 и 13 соответственно. Совмещением особых точек этих кривых справа можно получить поляризационную диаграмму железа, на которой отображены экспериментальные условия иммунности (невосприимчивости), общей коррозии, питтинговой коррозии, пассивности и неустойчивой пассивности, как функцию потенциала и pH. Потенциал, разделяющий области невосприимчивости и общей коррозии, - стационарный или коррозионный (Ec) потенциал. Потенциал, разделяющий область общей коррозии и пассивности, - потенциал пассивации (Ea). При потенциалах положительнее Ea на металле образуется защитная пленка окислов. Потенциал Epp (потенциал питтингообразования) – потенциал, выше которого металл подвергается питтинговой коррозии. При питтинге наблюдается очень быстрое активное растворение металла на определенных участках его поверхности (в коррозионных язвах, или питтингах), в то время как другие участки поверхности металла остаются в пассивном состоянии. Ep – критический защитный потенциал (потенциал репассивации питтингов). При потенциалах отрицательнее Ep уже имеющиеся питтинги не будут расти дальше и поврежденная пассивационная пленка будет восстановлена. Линия, отвечающая потенциалам репассивации питтингов Ep, разделяет область пассивности на две части: верхнюю – область неустойчивой пассивности, в которой уже имеющиеся язвы продолжают расти, и нижняя- полной (устойчивой) пассивности, в которой ранее образовавшиеся питтинги восстанавливают свою пассивность.
Поляризационная диаграмма потенциал – pH реагирует на электродные потенциалы появления новых фаз и фазовые переходы на поверхности металлов, указывая границы начала и конца фазовых превращений. Поэтому поляризационные диаграммы имеют все признаки диаграммы фазового равновесия. Для идентификации фазовых превращений на поляризационных диаграммах их совмещают с соответствующими равновесными диаграммами потенциал – pH [6].
2. Расчет и построение равновесной диаграммы потенциал – pH для системы Cu – H2O
В системе Cu – H2O присутствуют Cu, Cu2+, Cu2O, CuO и Cu2O3.
Реакции окисления меди до оксидов приведены ниже:
(1) Cu0 + 0,5O2 = CuO ![]() = - 129 365 Дж/моль
= - 129 365 Дж/моль
(2) 2Cu0 + 0,5O2 = Cu2O ![]() = - 150 548 Дж/моль
= - 150 548 Дж/моль
(3) 2Cu0 + 1,5O2 = Cu2O3![]() = ?
= ?
Для (3) реакции:
![]() = 100 Дж/моль·К для Cu2O3
= 100 Дж/моль·К для Cu2O3
![]() = 33,149 Дж/моль·К для Cu
= 33,149 Дж/моль·К для Cu
![]() = 205,036 Дж/моль·К для O2
= 205,036 Дж/моль·К для O2
![]() = - 355 000 Дж/моль·К
= - 355 000 Дж/моль·К
Отсюда по уравнению ![]() находим
находим ![]() = - 273 392 Дж/моль
= - 273 392 Дж/моль
(4) Cu2O + 0,5O2 = 2CuO ![]() = ?
= ?
(5) 2CuO + 0,5O2 = Cu2O3![]() = ?
= ?
Для (4) и (5) реакций по закону Гесса находим:
![]() = 2·
= 2·![]() -
- ![]() = - 106 182 Дж/моль
= - 106 182 Дж/моль
![]() =
=![]() - 2·
- 2·![]() = - 14 662 Дж/моль
= - 14 662 Дж/моль
Для некоторого процесса ![]() энергию Гиббса можно рассчитать как:
энергию Гиббса можно рассчитать как:
![]() (2.1)
(2.1)
Здесь ![]() - это минимальное значение давления кислорода в газовой фазе, при котором в среде начнется окисление. Соответственно, чем меньше
- это минимальное значение давления кислорода в газовой фазе, при котором в среде начнется окисление. Соответственно, чем меньше ![]() , тем легче окисление Me.
, тем легче окисление Me.
Исходя из уравнения (2.1) найдем значения ![]() для реакций (1), (3) и (4):
для реакций (1), (3) и (4):
![]() = 4,57·10-46 атм.
= 4,57·10-46 атм.
![]() = 1,18·10-38 атм.
= 1,18·10-38 атм.
![]() = 7,28·10-6 атм.
= 7,28·10-6 атм.
В системе может протекать выделение кислорода:
(6) O2 + 4ē + 4H+ = 2H2O ![]() = - 470 461 Дж/моль
= - 470 461 Дж/моль
Фазовые переходы Cu в данной системе описываются следующими уравнениями:
(I) Cu2+ + 2ē = Cu0 φ = 0,337 B ![]() = - 65 031 Дж/моль
= - 65 031 Дж/моль
(II) Cu2O + 2H+ + 2ē = 2Cu0 + H2O φ = ? ![]() = - 84 682 Дж/моль
= - 84 682 Дж/моль
(III) 2Cu2+ + H2O + 2ē = Cu2O + 2H+ φ = ?
(IV) 2CuO + 2H+ + 2ē = Cu2O + H2O φ = ?
(V) CuO + 2H+ = Cu2+ + H2O φ = ?
(VI) Cu2O3 + 6H+ + 2ē = 3H2O + 2Cu2+ φ = ?
(VII) Cu2O3 + 2H+ + 2ē = 2CuO + H2O φ = ?
По закону Гесса для реакций (III) – (VII):
![]() = 2·
= 2·![]() -
- ![]() = - 45 380 Дж/моль
= - 45 380 Дж/моль
![]() =
= ![]() + 0,5·
+ 0,5·![]() - 2·
- 2·![]() = -127 049 Дж/моль
= -127 049 Дж/моль
![]() = 0,5·
= 0,5·![]() -
- ![]() -
- ![]() = - 40 835 Дж/моль
= - 40 835 Дж/моль
![]() = 1,5·
= 1,5·![]() - 2·
- 2·![]() -
- ![]() = - 302 238 Дж/моль
= - 302 238 Дж/моль
![]() = 0,5·
= 0,5·![]() + 2·
+ 2·![]() -
- ![]() = - 220 569 Дж/моль
= - 220 569 Дж/моль
В общем виде электродный процесс можно записать как:
![]()
По основному закону термодинамики электрохимических систем:
![]() (2.2)
(2.2)
Свободная энергия Гиббса определяется по следующей формуле:
Δ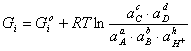 (2.3)
(2.3)
Подставляя (2.3) в (2.4), переходя от натуральных логарифмов к десятичным и с учетом того, что ![]() , получаем:
, получаем:
![]() (2.4)
(2.4)
Для линий чисто химических равновесий энергия Гиббса вычисляется по формуле:
![]() (2.5)
(2.5)
Подставляя уравнение (2.5) в (2.2) и проводя соответствующие преобразования, получаем:
![]() (2.6)
(2.6)
Исходя из приведенных выше формул, ведется расчет линий зависимости φ от pH для реакций (I) – (VII):
| № линии | Электродная реакция | Равновесный потенциал, В (н. в. э.) или рН раствора |
| I |
|
|
| II |
|
|
| III |
|
|
| IV |
|
|
| V |
|
|
| VI |
|
|
| VII |
|
|
Для линий I, III, V и VI величину активности ионов Cu2+ можно варьировать. В данном случае берутся значения ![]() = 0, 10-2, 10-4 и 10-6. Тогда:
= 0, 10-2, 10-4 и 10-6. Тогда:
Для I:
φ1 = 0,337 В
φ2 = 0,278 В
φ3 = 0,219 В
φ4 = 0,160 В
Для III:
φ1 = 0,235 + 0,0591pH
φ2 = 0,117 + 0,0591pH
φ3 = - 0,001 + 0,0591pH
φ4 = - 0,120 + 0,0591pH
Для V:
pH1 = 3,58
pH2 = 4,58
pH3 = 5,58
pH4 = 6,58
Для VI:
φ1 = 1,566 – 0,1773pH
φ2 = 1,684 – 0,1773pH
φ3 = 1,802 – 0,1773pH
φ4 = 1,921 – 0,1773pH
Для данной системы построена равновесная диаграмма потенциал – pH:
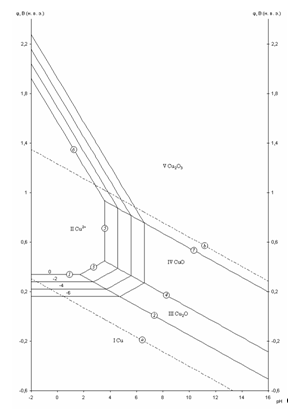
Рис. 2.1 - Равновесная диаграмма потенциал – pH для системы Cu – H2O
На диаграмме можно выделить 5 областей преобладания фаз различного состава. Область I – область иммунности меди, при данных значениях потенциалов и рН медь коррозии не подвергается. Область II – область активной коррозии, в которой медь переходит в раствор в виде катионов Cu2+. Области III, IV – области пассивации, на поверхности меди образуется защитная пассивирующая плёнка, состоящая из оксида Cu2O (область III) и CuO (область IV) Область V – область перепассивации. Линии a и b на диаграмме определяют область электрохимической устойчивости воды.
Данная диаграмма построена без учета существования Cu в данной системе в виде анионов.
Ниже приведены дополняющие картину системы уравнений реакций:
(VIII) HCuO2- + H+ = CuO + H2O pH = 18,83 + lg![]()
(IX) Cu2O3 +H2O + 2ē = 2HCuO2- φ = ?
(X) 2HCuO2- + 4H+ + 2ē = Cu2O +3H2O φ = 1,783 – 0,1182pH + 0,0591·lg![]()
(XI) CuO22- + H+ = HCuO2- pH = 13,15 + lg![]()
(XII) 2CuO22- + 6H+ + 2ē = Cu2O + 3H2O φ = 2,560 – 0,1773pH + 0,0591·lg![]()
(XIII) Cu2O3 + H2O + 2ē = 2CuO22- + 2H+ φ = ?
(XIV) CuO22- + 4H+ + 2ē = Cu + 2H2O φ = 1,515 – 0,1182pH + 0,0295·lg![]()
Аналогично расчетам для уравнений реакций (I) – (VII) для реакций (IX) и (XIII) получаем:
φ(IX) = 0,0309 –0,0591·lg![]()
φ(XIII) = –0,759 + 0,0591pH + 0,0591·lg![]()
Для системы Cu – H2O построена дополненная диаграмма потенциал – pH:
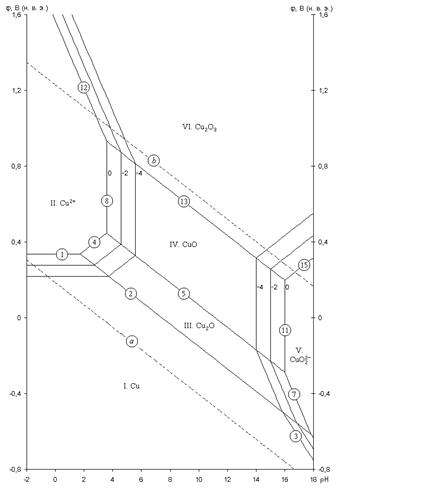
Рис. 2.2 - Равновесная диаграмма потенциал – pH для системы Cu – H2O с учетом существования Cu в виде анионов
На данной диаграмме показаны все условия перехода меди из одних состояний в другие. Можно заметить, что в очень кислой среде пассивирующая пленка меди разрешается, вследствие чего медь вновь переходит в раствор, но на этот раз уже в виде анионов HCuO2- и CuO22-. Отсюда можно сделать вывод, что медь неустойчивак коррозии при высоких значениях pH.
Выводы
1) В работе изучены основные представления о электрохимических системах, рассмотрены классификация электродов и классификация самих систем.
2) Рассмотрены равновесные диаграммы потенциал-pH, изучены основные принципы их построения и анализа.
3) Изучены поляризационные кривые и поляризационные диаграммы потенциал-pH, принципы их построения, перехода от кривых к диаграммам.
4) В работе рассчитаны основные химические и электрохимические равновесия в системе Cu – H2O при 298 К и 1 атм. На основе этих данных построена диаграмма электрохимического равновесия данной системы.
5) Были проанализированы термодинамические особенности окисления меди на воздухе. Показано принципиальная возможность образования оксида Cu2O3 в стандартных условиях.
СПИСОК ЛИТЕРАТУРЫ
1. Герасимов Я.И. Курс физической химии [Текст] / Я.И. Герасимов, В.П. Древинг, Е.Н. Еремин, А.В. Киселев, В.П. Лебедев, Г.М. Панченков, А.И. Шлыгин // – 2-е изд., знач. доп. – М: Химия, 1973. Т. 2 – 624 с.
2. Дамаскин Б.Б. Электрохимия: учебное пособие для хим. фак. ун-тов [Текст] / Б.Б. Дамаскин, О.А. Петрий // М: Высшая школа, 1987. – 295 с.
3. Термодинамика химической и электрохимической устойчивости сплавов: учебное пособие [Текст] / авт.-сост. А.Г. Тюрин. Ч.I. – Челябинск: ЧелГУ, 2004.
4. Киш Л. Кинетика электрохимического растворения металлов [Текст] / пер. с англ. Е.В. Овсянниковой; под ред. А.М. Скундина // – М: Мир, 1990. – 272 с.
5. Скорчеллетти В.В. Теоретическая электрохимия. – Л: Государственное Научно-техническое издательство химической литературы, 1963. – 608 с.
6. Тюрин А.Г. Термодинамика химической и электрохимической устойчивости сплавов: [Текст]: дис. докт. хим. наук / Тюрин Александр Георгиевич – Челябинск: 2007.
7. Дамаскин Б.Б. Введение в электрохимическую кинетику: Учеб. пособие для студентов хим. спец. ун-тов [Текст] / Б.Б. Дамаскин, О.А. Петрий // – 2-е изд., перераб. и доп. – М: Высшая школа, 1983.
Похожие работы
... составов, застойные воды и некоторые органические продукты. Электрохимическая коррозия подчиняется законам электрохимической кинетики. Скорость ее можно определить на основе законов Фарадея. Электрохимическая коррозия встречается чаще всего и наиболее опасна для металлов. Она может протекать в газовой атмосфере, когда на поверхности металла возможна конденсация влаги (атмосферная коррозия), в ...
... и их содержимым. Способ изящен, и его применение, по-видимому, будет расширяться, как только будут преодолены сложности измерения и контроля. Покрытия, как метод защиты металлов от коррозии. Защита металлов, основанная на изменение их свойств, осуществляется или специальной обработкой их поверхности, или легированием. Обработка поверхности металла с целью уменьшения коррозии проводится одним ...
... обратимых потенциалов кислородного электрода при различных рН среды и Р P (атм) V ,B, при рН среды рН=0 рН=7 рН=14 0,21 +1,218 +0,805 +0,381 1 +1,229 +0,815 +0,400 Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой ...
... калькуляции представлены в табл.4.2. Ленточный график работ 5. Безопасность жизнедеятельности и охрана труда Дипломная работа посвящена анализу погрешностей волоконно-оптического гироскопа. В ходе ее выполнения были проведены необходимые расчеты и сделаны выводы, которые могут послужить материалом для ...



0 комментариев