Навигация
Равновесные диаграммы потенциал-pH (диаграммы Пурбе или диаграммы электрохимического равновесия). Принципы построения. Использование диаграмм Пурбе
1.3 Равновесные диаграммы потенциал-pH (диаграммы Пурбе или диаграммы электрохимического равновесия). Принципы построения. Использование диаграмм Пурбе
Одним из наиболее значительных достижений электрохимии 60-х годов является построение диаграмм pH-потенциал для всех важных металлов, названных в честь автора диаграммами Пурбе.
Диаграммы характеризуют, прежде всего, состав водного раствора и термодинамическую устойчивость твердой фазы (металла, оксидов, гидрооксидов и других соединений) в зависимости от двух переменных – электродного потенциала φ и pH. Каждая диаграмма построена в предположении, что все другие переменные заданы, но изменение состава водного раствора по еще одной переменной, например по концентрации иона металла, можно отобразить семейством линий. На полных диаграммах pH-потенциал наносят семейства линий при активностях ионов в растворе, равных 100, 10-2, 10-4, 10-6М. Эти линии обозначают соответственно числами 0, -2, -4 и -6. Для характеристики коррозионных процессов используют упрощенные диаграммы Ph=-потенциал. Для этого или объединяют кривые, соответствующие разным активностям ионов в водном растворе, проводя усредненную кривую, или строят диаграмму только при ![]() =10-6М.
=10-6М.
Для расчета и построения диаграмм pH-потенциал необходимо располагать сведениями о химических и электрохимических реакциях, возможных в данной системе, об их количественных термодинамических характеристиках (энергиях Гиббса, стандартных электродных потенциалах, их температурных коэффициентах).
В области низких температур (0 – 100°С) энергию Гиббса реакции достаточно рассчитывать в приближении Улига:
![]() (1.3.1)
(1.3.1)
Величину стандартного электродного потенциала можно определить по уравнению
![]() (1.3.2)
(1.3.2)
В справочной литературе стандартные потенциалы отнесены к температуре 298К, их величины при других температурах могут быть найдены из уравнения (1.3.2) или по соответствующим изотермическим температурным коэффициентам. Первый изотермический коэффициент отражает изменение стандартной энтропии электродной реакции:
![]() (1.3.3)
(1.3.3)
а второй – изменение изобарных теплоемкостей
![]() (1.3.4)
(1.3.4)
Если известны температурные коэффициенты, то стандартный потенциал любого электрода по температуре, отличной от 298К, можно рассчитать по уравнению
![]() (1.3.5)
(1.3.5)
Приближение Улига (![]() =0) соответствует уравнению (1.3.5) с учетом лишь первого температурного коэффициента.
=0) соответствует уравнению (1.3.5) с учетом лишь первого температурного коэффициента.
Линии на диаграммах pH-потенциал рассчитывают по равновесию, представленному в общем виде:
![]() (1.3.6)
(1.3.6)
для которого можно записать уравнение равновесного потенциала
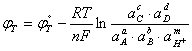 (1.3.7)
(1.3.7)
Где ![]() - активности компонентов в конденсированных фазах. Если один из реагентов или продуктов реакции (1.3.6) находится в газовой фазе, то вместо термодинамической активности в уравнение (1.3.7) подставляется соответствующее парциальное давление (летучесть). Вводя общепринятое обозначение
- активности компонентов в конденсированных фазах. Если один из реагентов или продуктов реакции (1.3.6) находится в газовой фазе, то вместо термодинамической активности в уравнение (1.3.7) подставляется соответствующее парциальное давление (летучесть). Вводя общепринятое обозначение ![]() ,получим
,получим
![]() (1.3.8)
(1.3.8)
Для того, чтобы по уравнению (1.3.8) построить линию на диаграмме pH-потенциал, из условий равновесия устанавливают значения ![]() и
и ![]() так, чтобы последний член имел определенную величину. Затем строят прямую линию с ординатой
так, чтобы последний член имел определенную величину. Затем строят прямую линию с ординатой ![]() при pH=0 и наклоном
при pH=0 и наклоном ![]() . При 298К значение
. При 298К значение ![]() равно 0,0591 В, тогда наклон составит
равно 0,0591 В, тогда наклон составит ![]() .
.
Наклонные линии (m≠0, n≠0) отображают равновесия, в которых участвуют ионы H+ или OH- совместно с электронами; горизонтальные линии (m=0, n≠0) – равновесия, в которых участвуют электроны, но не принимают участия ионы H+ и OH-; вертикальные линии (m≠0, n=0) – равновесия, в которых принимают участие ионы H+ и OH-, но не участвуют электроны. Последнее равновесие является химическим, поэтому не может быть рассчитано по формуле (1.3.7). Вместо него применяют
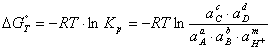 (1.3.9)
(1.3.9)
Затем определяют pH для вертикальной линии:
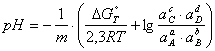 (1.3.10)
(1.3.10)
М. Пурбе описал пять основных приложений равновесных диаграмм pH-потенциал чистых металлов:
1) теоретическое обоснование областей или условий коррозии (самопроизвольного растворения), иммунности (термодинамической устойчивости) и пассивации (условий, при которых термодинамически неустойчивые металлы практически не подвергаются растворению вследствие кинетических затруднений);
2) оценка стойкости металлов в воде;
3) установление металлов, которые находятся в активном или пассивном состоянии в определенной коррозионной среде;
4) оценка возможностей использования окисляющих ингибиторов коррозии (хроматов, молибдатов и т.д.);
5) классификация металлов по степени их благородности (термодинамической устойчивости) [3].
Вследствие диссоциации воды в водных растворах всегда присутствуют ионы водорода и гидроксила. Поэтому на всех электродах может протекать не только собственно электродная реакция, но и реакции, проходящие на водородном и кислородном электродах. Таким образом, теоретически в водных растворах электроды всегда рассматриваются как смешанные.
Диаграмма равновесия воды.
На простейшей, но, как указано выше, очень важной в практическом отношении диаграмме равновесия потенциалы электродных реакций, протекающих на водородном [εР(Н+/H2)] и кислородном [εР(О2/ОН-)] электродах, приведены в и зависимости от рН раствора. Эта диаграмма, кроме того, дает сведения об электрохимической устойчивости воды.
Потенциал реакции водородного электрода при 25°С можно представить в виде
 (1.3.11)
(1.3.11)
учитывая, что -lg![]() = pH. В этом уравнении
= pH. В этом уравнении ![]() =
=![]() /
/![]() , где
, где ![]() - давление газообразного водорода в системе, а
- давление газообразного водорода в системе, а ![]() - давление газа, выбранное в качестве стандартной величины (1,01325·105 Па).
- давление газа, выбранное в качестве стандартной величины (1,01325·105 Па).
На кислородном электроде реализуется следующая реакция:
O2 + 2H2O + 4ē = 4OH- (1.3.12)
Потенциал электродной реакции равен
 (1.3.13)
(1.3.13)
где ![]() (
(![]() – давление газообразного кислорода в системе); εР (O2/OH-) – стандартный потенциал электродной реакции (1.3.12), равный 0,401 В при 25°С.
– давление газообразного кислорода в системе); εР (O2/OH-) – стандартный потенциал электродной реакции (1.3.12), равный 0,401 В при 25°С.
С учетом ионного произведения воды ![]() получаем выражение
получаем выражение
![]() (1.3.14)
(1.3.14)
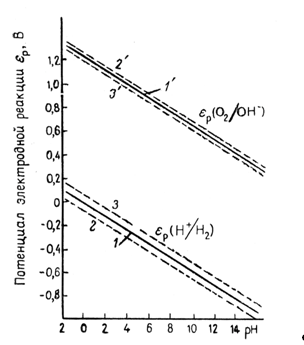
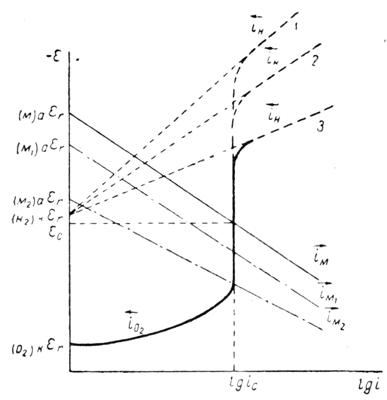
Рис. 1.3.1 - Диаграмма равновесия воды
На рис. 1.3.1. величины ![]() и
и ![]() , рассчитанные по уравнениям (1.3.11) и (1.3.14), приведены как функции pH. Сплошные прямые отвечают
, рассчитанные по уравнениям (1.3.11) и (1.3.14), приведены как функции pH. Сплошные прямые отвечают ![]() . При уменьшении pH на единицу потенциалы обоих электродов уменьшаются на 0,0591 В. Штриховые линии получают при уменьшении и увеличении давления водорода и кислорода на два порядка. В этом случае потенциал реакции водородного электрода (при постоянном pH) изменяется на 0,0591 В, а потенциал кислородного электрода – на 0,0295В. Следовательно, если построить график зависимости величин
. При уменьшении pH на единицу потенциалы обоих электродов уменьшаются на 0,0591 В. Штриховые линии получают при уменьшении и увеличении давления водорода и кислорода на два порядка. В этом случае потенциал реакции водородного электрода (при постоянном pH) изменяется на 0,0591 В, а потенциал кислородного электрода – на 0,0295В. Следовательно, если построить график зависимости величин ![]() и
и ![]() от pH, то получаются две параллельные прямые, причем их истинное расположение зависит от давления газа. В интервале между двумя прямыми вода устойчива, т.е. при обычных условиях на электродах, работающих при потенциалах в пределах указанного интервала, не происходит выделения водорода или кислорода (это «интервал устойчивости» воды). За пределами этого интервала (т.е. при электродных потенциалах более отрицательных, чем
от pH, то получаются две параллельные прямые, причем их истинное расположение зависит от давления газа. В интервале между двумя прямыми вода устойчива, т.е. при обычных условиях на электродах, работающих при потенциалах в пределах указанного интервала, не происходит выделения водорода или кислорода (это «интервал устойчивости» воды). За пределами этого интервала (т.е. при электродных потенциалах более отрицательных, чем ![]() , и более положительных, чем
, и более положительных, чем ![]() ) вода разлагается соответственно с выделением водорода и кислорода.
) вода разлагается соответственно с выделением водорода и кислорода.
Поэтому в водных растворах можно достаточно надежно изучать равновесие и электродную реакцию на простых электродах, если потенциал данной реакции находится в пределах интервала устойчивости воды, а электролит не содержит растворенных газов H2 и O2. Если потенциал электродной реакции находится за пределами интервала устойчивости воды, то нельзя достичь равновесия исследуемой реакции [4].
1.4 Механизм и скорость электродной реакции. Равновесный и стационарный потенциалы. Ток обмена. Простые и смешанные электроды. Поляризация и перенапряжение. Их типы
Скорость электродных процессов следует рассматривать, используя общие закономерности обычных гетерогенных химических реакций, совершающихся на поверхности раздела твердой и жидкой фаз.
Назовем электродным процессом сумму всех изменений, происходящих во времени на поверхности электрода при потенциале, отличном от равновесного. Легко видеть, что электродный процесс, являясь процессом сложным, может быть расчленен на несколько стадий.
Из химической кинетики известно, что скорость наиболее медленной стадии оказывает решающее влияние на скорость процесса в целом. Если взять в пример двустадийный процесс (стадия 1 – диффузия иона из раствора к границе двойного слоя и далее к поверхности электрода; стадия 2 – электродная реакция, в которой участвуют ионы плотной части двойного слоя), то в стационарном состоянии обе стадии процесса будут протекать с одинаковой скоростью. При этом одна из них (в данном примере диффузия) имеет наибольшую возможную в данных условиях скорость; скорость второй стадии снижена недостатком реагирующего вещества, т.е. очень низкой концентрацией его у наружной границы двойного слоя.
В случае медленной электродной реакции и быстрой диффузии скорость последней оказывается снижена, так как медленный расход реагирующего вещества не создает достаточно большой разности концентраций, необходимой для развития диффузии.
В зависимости от того, какая из стадий является более медленной, можно различать электрохимическую или диффузионную кинетику электрохимического процесса.
Скорость диффузии зависит от температуры, от природы растворенного вещества и растворителя и от движения раствора, омывающего электрод. Чтобы избавиться от случайных причин, влияющих на скорость диффузии, и сделать ее постоянной, часто ведут исследование кинетики при перемешивании раствора с постоянной скоростью. Меняя скорость перемешивания раствора, т.е. скорость диффузии, иногда можно один и тот же процесс перевести из области диффузионной кинетики в область электрохимическую, и наоборот.
Рассмотрим электрохимическую кинетику, предполагая, что диффузия может протекать значительно быстрее, чем электродная реакция. Данного условия можно добиться за счет достаточно быстрого перемешивания раствора.
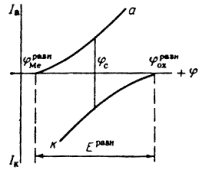
Для примера рассмотрим скорость электрохимической реакции, происходящей на металлическом электроде, погруженном в раствор его собственной соли.
При равновесном потенциале не прекращается протекание реакций окисления и восстановления. Ионы металла переходят с поверхности электрода в раствор и из раствора возвращаются на поверхность электрода. Но скорости этих двух противоположных процессов равны. При этом не происходит макроскопических изменений состава и массы отдельных фаз системы. Протекание процесса, приводящего к макроскопическим изменениям, возможно лишь при потенциале, отличном от равновесного, когда скорости окисления и восстановления не равны друг другу. Разность этих скоростей и будет общей скоростью процесса, которая тем больше, чем больше смещен потенциал от равновесного значения [5].
При установлении равновесия состав фаз, образующихся на электродах, остается неизменным во времени. Однако такое равновесие является динамическим, т.е. абсолютные значения анодного (![]() ) и катодного (
) и катодного (![]() ) плотностей тока равны и представляют собой ток обмена
) плотностей тока равны и представляют собой ток обмена ![]() . Измеряемый при этом электродный потенциал соответствует равновесному потенциалу (
. Измеряемый при этом электродный потенциал соответствует равновесному потенциалу (![]() ). В случае простых электродов условие равновесия можно представить в виде
). В случае простых электродов условие равновесия можно представить в виде
![]() (1.4.1)
(1.4.1)
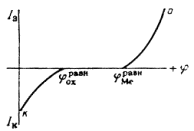
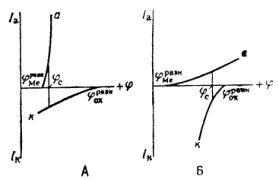
Однако очень часто на металле, погруженном в раствор электролита, протекает несколько самопроизвольных электродных реакций, т.е. речь идет о смешанном электроде. В таких случаях на электроде устанавливается более или менее постоянный во времени компромиссный потенциал ![]() (равновесный и компромиссный потенциалы часто называют стационарным потенциалом, указывая тем самым на отсутствие тока от внешнего источника). В этом случае суммы катодных и анодных токов отдельных реакций (т.е. скорости этих реакций) также равны друг другу:
(равновесный и компромиссный потенциалы часто называют стационарным потенциалом, указывая тем самым на отсутствие тока от внешнего источника). В этом случае суммы катодных и анодных токов отдельных реакций (т.е. скорости этих реакций) также равны друг другу:
![]() (1.4.2)
(1.4.2)
где n>1.
Равенство (1.4.2) может быть выполнено при условии, что 1) ![]() или 2)
или 2) ![]() .
.
При условии 1 состав образующихся на электроде фаз меняется во времени, т.е. в системе отсутствует равновесие. При условии 2 на смешанном электроде устанавливается равновесие.
Для того чтобы скорости анодных и катодных процессов на электроде различались, необходимо изменить значение стационарного потенциала. При таком изменении через электрод начинает протекать электрический ток. Это можно сделать, замкнув каким-либо проводником два электрода гальванического элемента или включив исследуемый электрод в соответствующую цепь с помощью вспомогательного электрода. При этом стационарный потенциал электрода начинает изменяться под действием электрического тока. Такое явление называется поляризацией.
Разность между электродным потенциалом поляризованного электрода (![]() ) и равновесным потенциалом (
) и равновесным потенциалом (![]() ) называется перенапряжением
) называется перенапряжением ![]() :
:
![]() (1.4.3)
(1.4.3)
Отсюда перенапряжение – это разность между потенциалом электрода и равновесным потенциалом, необходимая для протекания заданного тока через электрод. Когда рассматривают смешанный электрод, стационарный потенциал которого не совпадает с равновесным, разность между потенциалом поляризованного электрода и компромиссным потенциалом (![]() ) называют потенциалом поляризации
) называют потенциалом поляризации ![]() электрода:
электрода:
![]() (1.4.4)
(1.4.4)
Если процесс окисления является единственной или преобладающей электродной реакцией на поляризованном электроде, то электрод называют анодом, а соответствующую поляризацию – анодной. Если же единственной или преобладающей реакцией является процесс восстановления, то электрод считается катодом, а поляризация называется катодной. В первом случае ![]() и
и ![]() положительны, во втором – отрицательны.
положительны, во втором – отрицательны.
В соответствии с выдвинутыми ранее положениями, когда ![]() и
и ![]() не равны нулю, анодная и катодная плотности тока (
не равны нулю, анодная и катодная плотности тока (![]() и
и ![]() соответственно) также неодинаковы и суммарная плотность тока
соответственно) также неодинаковы и суммарная плотность тока ![]() , протекающего через электрод, будет равна
, протекающего через электрод, будет равна
![]() (1.4.5)
(1.4.5)
где ![]() - положительная, а
- положительная, а ![]() - отрицательная величина.
- отрицательная величина.
Поляризация, как правило, бывает обусловлена затруднением («замедленностью») одной из последовательных стадий электродного процесса. Некоторые стадии представляют собой физические процессы (диффузия, образование новой фазы), а другие являются химическими или электрохимическими реакциями (например, стадия переноса заряда).
Основываясь на характере лимитирующей стадии процесса, обычно выделяют следующие типы поляризации и перенапряжения.
Диффузионное перенапряжение (концентрационная или диффузионная поляризация) возникает в том случае, когда затрудненной оказывается диффузия к электроду участвующего в электродной реакции исходного вещества (веществ) или диффузия продукта (продуктов) электродной реакции от электрода в объем раствора. Вследствие медленной диффузии при протекании тока происходит обеднение приэлектродного слоя исходными компонентами, а концентрация продуктов возрастает в сравнении с объемной (т.е. в отсутствие тока) концентрацией. Поскольку диффузия всегда участвует в электродных процессах, часто возникает и диффузионная поляризация. В таких случаях кинетика суммарного электродного процесса определяется законами диффузии (диффузионной кинетикой, диффузионным режимом).
Перенапряжение кристаллизации (кристаллизационная поляризация) также по существу обусловлено диффузионными затруднениями. Это явление возникает в том случае, когда продуктом электродной реакции является металл, а его ион не может встроиться в кристаллическую решетку металла, превратившись в соответствующий атом. Следовательно, ион металла вынужден мигрировать до места, энергетически выгодного для встраивания в решетку. При этом кристаллизация оказывается наиболее затрудненным процессом.
Перенапряжение образования центров кристаллизации, или зародышей (поляризация зародышеобразования), как правило, возникает в начальный момент пропускания тока, поскольку для образования новой фазы необходимо затратить некоторую избыточную энергию. Новая фаза образуется при осаждении металла (сплава) на электрод из другого материала или, например, при электролитическом выделении ртути или газа. В последних двух случаях, когда ртуть не смачивает электрод или когда выделяется газ, зародыши должны формироваться непрерывно: в этих условиях перенапряжение образования зародышей существует только в начальный момент пропускания тока. При выделении металла на электроде в микрокристаллическом или аморфном состоянии перенапряжение образования зародышей новой фазы может быть постоянным.
Перенапряжение переноса заряда (поляризация переноса заряда) наблюдают в том случае, когда лимитирующей стадией оказывается перенос заряда, т.е. электрохимическая реакция. При этом перенапряжение переноса можно рассматривать как разность электрических потенциалов, уменьшающую энергию активации переноса заряда до такой степени, что этот процесс становится возможным при заданной плотности тока. Поэтому такой вид поляризации часто называют активационной поляризацией.
Перенапряжение реакции (поляризация реакции) обнаруживают в том случае, когда в электродную реакцию кроме электрохимических стадий (перенос заряда) последовательно включается замедленная химическая реакция (реакции). Если последняя протекает до электрохимической стадии, то при пропускании тока концентрации участвующих в электрохимической стадии исходных компонентов окажутся ниже их равновесных значений. Если замедленная химическая реакция протекает после электрохимической стадии, то последнюю можно считать равновесной. Необходимо указать, что сложные электродные реакции состоят из нескольких стадий, среди которых может быть ряд химических и электрохимических.
Диффузионную поляризацию и поляризацию реакции часто объединяют под общим названием «концентрационная поляризация», поскольку появление этих типов поляризации сопровождается изменением концентрации участвующих в электрохимической реакции частиц относительно их равновесных концентраций. Однако электрохимическую стадию можно считать по-прежнему равновесной, но уже с изменившимися концентрациями.
Все упомянутые выше типы перенапряжения обусловлены наличием в электродном процессе лимитирующей стадии. В литературе еще имеется термин «омическое перенапряжение». Последнее, как правило, связано с измерением электродного потенциала относительно электрода сравнения с помощью солевого мостика. При протекании тока в слое жидкого электролита (или в другом поверхностном слое) между концом солевого мостика и поверхностью электрода происходит омическое падение потенциала, которое складывается с измеренным значением электродного потенциала. Таким образом, омическое перенапряжение обусловлено просто ошибкой при измерении. Эту ошибку можно уменьшить, выполнив мостик в виде капилляра, конец которого вплотную подходит к исследуемому электроду (так называемый капилляр Луггина). При этом также возможно искажение величины электродного потенциала вследствие экранирования доли поверхности электрода концом капилляра. Во избежание омического перенапряжения (когда оно весьма вероятно, например, в случае раствором с высоким сопротивлением или при образовании поверхностного слоя) в электрохимических измерениях используют потенциостаты с компенсацией омического падения напряжения.
Кинетика процесса растворения металла обычно определяется диффузионной, электрохимической и химической стадиями реакции и соответствующими типами поляризации. На практике на кинетику электродных процессов может оказывать влияние одновременно каждая из этих стадий реакции [4].
Похожие работы
... составов, застойные воды и некоторые органические продукты. Электрохимическая коррозия подчиняется законам электрохимической кинетики. Скорость ее можно определить на основе законов Фарадея. Электрохимическая коррозия встречается чаще всего и наиболее опасна для металлов. Она может протекать в газовой атмосфере, когда на поверхности металла возможна конденсация влаги (атмосферная коррозия), в ...
... и их содержимым. Способ изящен, и его применение, по-видимому, будет расширяться, как только будут преодолены сложности измерения и контроля. Покрытия, как метод защиты металлов от коррозии. Защита металлов, основанная на изменение их свойств, осуществляется или специальной обработкой их поверхности, или легированием. Обработка поверхности металла с целью уменьшения коррозии проводится одним ...
... обратимых потенциалов кислородного электрода при различных рН среды и Р P (атм) V ,B, при рН среды рН=0 рН=7 рН=14 0,21 +1,218 +0,805 +0,381 1 +1,229 +0,815 +0,400 Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой ...
... калькуляции представлены в табл.4.2. Ленточный график работ 5. Безопасность жизнедеятельности и охрана труда Дипломная работа посвящена анализу погрешностей волоконно-оптического гироскопа. В ходе ее выполнения были проведены необходимые расчеты и сделаны выводы, которые могут послужить материалом для ...



0 комментариев