Навигация
2. Экспериментальная часть
2.1 Карбонил никеля: получение и свойства
Карбонил никеля, тетракарбонил никеля Ni(CO)4, открытый в 1888 г. Лангером, образуется при пропускании оксида углерода (ІІ) при 50 – 100о над мелкораздробленным никелем (полученным, например, восстановлением оксида никеля водородом при 400о С):
Ni + 4CO = Ni(CO)4.
Также Ni(CO)4 можно получить действием оксида углерода (ІІ) под давлением 50 – 100 ат. на концентрированный раствор хлорида гексаммина никеля, нагретого до 80о:
[Ni(NH3)6]Cl2+ 5CO + 2H2O = Ni(CO)4 + (NH4)2CO3 + 4NH4Cl + 2NH3;
обработкой соединения K2[Ni(CO)(CN)3] кислотами:
4K2[Ni(CO)(CN)3] + 2HCl = Ni(CO)4 + 3K2[Ni(CN)4] + 2KCl + H2;
или действием угарного газа и фенилмагнийбромида на хлорид никеля(ІІ):
NiCl2 + 2C6H5MgBr + 4CO = Ni(CO)4 + MgCl2 + MgBr2 + 2C6H5 .
Это бесцветная жидкость, закипающая при 43оС, затвердевающая при -25оС, имеет плотность 1,356 г/см3. Критическая температура Ni(CO)4 лежит около 200оС, а критическое давление равно примерно 30 атм. Полностью разлагается на металлический никель и окись углерода при нагревании до 180 – 200оС или под действием ультрафиолетовых лучей. Карбонил никеля диамагнитен, очень летучий и сильно токсичен. Обнаруживает значительную дисперсию.
Тетракарбонил никеля плохо растворим в воде, растворяется в эфире, бензоле, хлороформе, толуоле. Не взаимодействует с разбавленными кислотами и щелочами.
При действии хлора, брома или иода на Ni(CO)4 образуются дигалогениды никеля, например:
Ni(CO)4 + Br2 = NiBr2 + 4CO.
Кислород или воздух окисляют карбонил никеля до NiO и CO2:
2Ni(CO)4 + 5O2 = 2NiO + 8CO2.
Реакция сопровождается воспламенением. Смесь паров Ni(CO)4 с воздухом взрывчата.
Концентрированная серная кислота бурно (со взрывом) реагирует с карбонилом:
Ni(CO)4 + 2H2SO4(конц.) = NiSO4 + SO2 + 4CO2 + 2H2O.
Сильные окислители, например, азотная кислота, царская водка или газообразный хлор превращают Ni(CO)4 в соли никеля(ІІ):
Ni(CO)4 + 12HNO3(конц.) = Ni(NO3)2 + 10NO2 + 4CO2 + 6H2O.
При действии PF3, PCl3, или PBr3 на карбонил никеля образуются соответственно Ni(PF3)4, Ni(PCl3)4 илиNi(PBr3)4
Тетракарбонил никеля при взаимодействии с различными органическими соединениями образует металлоорганические производные никеля, например: [H2Ni(CO)3]2, Ni(С5Н5)2, C5H5NiNO, Ni(CO)2[P(C6H5)3]2 .
Карбонил никеля при температуре 180-200о разлагается на свободный металл и оксид углерода(ІІ):
Ni(CO)4 =t Ni + 4CO.
Эта реакция нашла применение в промышленности при производстве чистого никеля. В результате получается металл, не требующий какой-либо другой очистки. Таким способом отделяют черновой никель от примесей других металлов, в особенности при разделении меди и никеля.
Ni(CO)4 также служит для никелирования стекол и для приготовления коллоидных растворов никеля путём растворения в толуоле и последующим нагреванием.
2.2 Применение карбонила никеля в промышленности
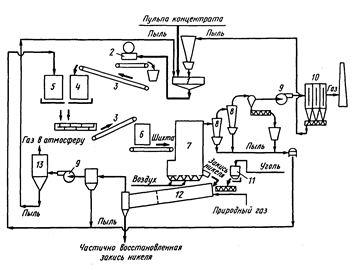
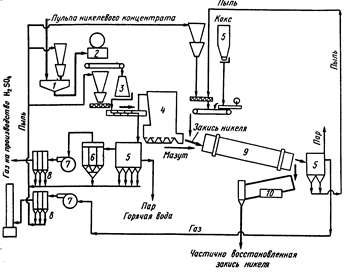
Ni(CO)4 применим в так называемом процессе Монда для отделения никеля от меди из конвекторного пека. Никелевомедный пек, измельченный и промытый горячей водой (с целью удаления солей натрия), превращается в оксиды прокаливанием при 800о. Если над сплавом, полученным восстановлением оксидов меди и никеля водяным газом (56% Н2 и 25% СО) при 350 – 400оС пропускать оксид углерода (ІІ), нагретый до 50 – 60оС, при атмосферном давлении, образуется тетракарбонил никеля Ni(CO)4. Его отгоняют, и при 180 – 200оС разлагают на металлический никель и оксид углерода (ІІ) . Последний снова вводится в процесс. Никель, полученный по процессу Монда, содержит 99,8% Ni, очень небольшие количества железа и углерода, следы серы и кремния; медь и кобальт отсутствуют. Процесс Монда применим при давлении 200 ат. когда образующийся в жидком состоянии Ni(CO)4 отделяют от Fe(CO)5 дробной перегонкой.
Похожие работы
... медно-никелевые руды часто сопровождаются минералами не только кобальта, но и некоторых других ценных металлов, в том число платины и ее аналогов. ОБЩИЕ СВЕДЕНИЯ О ПРОИЗВОДСТВЕ НИКЕЛЯ НА РАЗНЫХ ПРЕДПРИЯТИЯХ. Производство никеля из руд включает несколько стадий переработки сырья с получением на каждой из них соответствующего полупродукта. В мировой практике на большинстве предприятий, ...
... ), выполненных за последние годы, отмечены новые области применения никеля и приводится большой список литературы. Ряд справочников и статей посвящен применению никеля в качестве легирующего элемента в сталях и сплавах с особыми физическими, химическими и механическими свойствами; много работ посвящено разработке новых никелевых жаропрочных сплавов и их применению в реактивной, газотурбинной ...
... , стимулирует синтез гемоглобина, повышает усвоение доступного железа). Преобразование и распределение: Из органов человека наиболее богаты никелем печень, поджелудочная железа и гипофиз. Никель избирательно концентрируется в substancia nigra головного мозга. Клинические проявления и влияние на структуры организма. Избыток никеля и его проявления: Токсическое действие никеля проявляется при ...
... коробки противогаза на 45 г, после чего она уже непригодна. В случае резко повышенных концентрации применяют шланговые противогазы. Применяют также специальную одежду и перчатки. 2 Гигиеническое нормирование содержания тяжелых металлов в объектах окружающей среды Ниже приведены основные сведения по нормированию содержания тяжелых металлов в воздухе, воде, почве, пищевых продуктах и кормах ...
0 комментариев