Навигация
Активность карбоксипептидазы М в тканях самцов крыс
3.2.3. Активность карбоксипептидазы М в тканях самцов крыс
а) Определение активности карбоксипептидазы М у интактных самцов крыс
Полученные данные о распределении активности КПМ в тканях самцов крыс представлены в таблице 17.
Таблица 17. Активность КПМ в тканях самцов в норме (нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка, M±m, n=6¸8).
| Гипоталамус | Стриатум |
| 0,131±0,014 | 0,069±0,014 |
Половых отличий в активности КПМ в гипоталамусе и стриатуме в норме не обнаружено. Вероятно, КПМ в исследованных отделах не вовлекается в формирование половых отличий в уровне нейропептидов.
б) Активность карбоксипептидазы М при внутрибрюшинном введении физиологического раствора в тканях самцов
Влияние внутрибрюшинного введения физраствора обнаружено только через 0,5 часа после воздействия в гипоталамусе, где активность КПМ была на 24% ниже, чем у интактных животных (рис. 6).
У самок через 0,5 часа после инъекции, в отличие от самцов активность КПМ в гипоталамусе относительно нормы не менялась. Однако в стриатуме у самок на стадии диэструса наблюдалось увеличение активности фермента, а в проэструсе – снижение активности, в то время как у самцов и самок на стадии эструса активность КПМ не менялась по сравнению с интактной группой животных.
Через 4 часа после введения физиологического раствора происходит уменьшение активности фермента в гипоталамусе у самок на стадии проэструса и эструса, в стриатуме уменьшение наблюдается на стадии диэструса, у самцов и самок в проэструсе и эструсе такие изменения отсутствуют относительно нормы.
Через 18 часов после инъекции физраствора изменений в активности КПМ у самцов и самок не было обнаружено.
Таким образом, введение физраствора приводит к более существенным изменениям в активности фермента у самок по сравнению с самцами. Кроме того, характер этих изменений различен: у самцов введение физраствора приводило к уменьшению активности КПМ только через 0,5 часа в гипоталамусе, в то время как у самок наблюдались изменения в активности фермента как в гипоталамусе, так и в стриатуме через 0,5 и 4 часа после инъекции. Однако через 18 часов после воздействия активность КПМ не изменялась у крыс обоего пола. Отличия в изменении активности фермента у самцов и самок, вероятно, свидетельствуют о различной устойчивости к стрессу особей разного пола [33].
в) Исследование активности карбоксипептидазы М при внутрибрюшинном введении этанола в тканях самцов крыс
Через 0,5 часа после введения этанола в дозе 1 г/кг в гипоталамусе активность КПМ была на 21% выше, чем в контроле. Через 18 часов после инъекции этилового спирта в дозе 4 г/кг активность фермента в гипоталамусе и стриатуме была на 18-19% ниже, чем в контроле. Интересно отметить, что достоверных отличий во влиянии разных доз этанола на активность КПМ не выявлено (рис. 6).
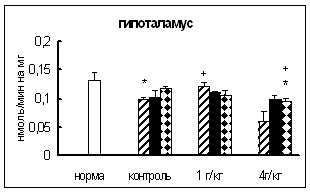 | 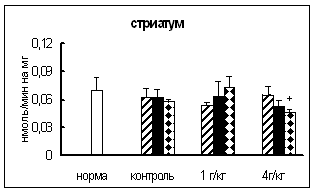 |
Рис. 6. Активность КПМ при введении физраствора и этанола в тканях самцов крыс (нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка, M±m, n=6¸8).
Влияния времени на активность КПМ не обнаружено (табл. 18).
Таким образом, введение этанола вызывало примерно одинаковые изменения активности КПМ в гипоталамусе и стриатуме. Интересно отметить, что в стриатуме и гипоталамусе отсутствовала зависимость активности фермента от дозы вводимого этанола.
У самцов и самок в диэструсе через 0,5 часа после введения этанола происходит увеличение активности КПМ в гипоталамусе, а в проэструсе –
Таблица 18. Дисперсионный анализ влияние времени на активность КПМ (значения отношения Фишера FФ и баллы экспериментальных (временных) подгрупп).
| Отдел | Воздействие | Fф |
| Гипоталамус | Физраствор | 1,49 |
| Этанол 1г/кг | 0,74 | |
| Этанол 4 г/кг | 1,33 | |
| Стриатум | Физраствор | 0,21 |
| Этанол 1г/кг | 0,33 | |
| Этанол 4 г/кг | 1,13 |
снижение активности фермента относительно контрольной группы животных. В стриатуме только у самок на стадии эструса наблюдается уменьшение активности КПМ, в остальных случаях изменений в активности фермента не происходит.
Через 4 часа после инъекции этанола в дозе 1 г/кг активность КПМ в гипоталамусе и стриатуме у самцов и в гипоталамусе у самок оставалась неизменной. В стриатуме у самок на стадии диэструса введение этанола вызывало увеличение, а в проэструсе уменьшение активности КПМ по отношению к контрольным животным.
Через 18 часов после введения этанола в дозе 1 г/кг у самцов активность КПМ в гипоталамусе и стриатуме не изменялась, у самок в стриатуме и гипоталамусе на стадии диэструса, а в последнем отделе и в эструсе активность фермента уменьшалась относительно контроля.
Через 0,5 и 4 часа после внутрибрюшинного введения этилового спирта (доза 4 г на кг) в гипоталамусе у особей разного пола изменений в активности КПМ не было обнаружено, в стриатуме у самцов активность фермента также оставалась на прежнем уровне, однако у самок через 0,5 часа в проэструсе наблюдалось увеличение активности, а в эструсе – снижение, через 4 часа на стадии диэструса активность КПМ возрастала по сравнению с контрольными цифрами.
Через 18 часов после инъекции этилового спирта в дозе 4 г/кг в гипоталамусе и стриатуме у самцов наблюдалось снижение активности КПМ, в то время как у самок изменения обнаруживались только в стриатуме на стадии диэструса, где активность фермента увеличивалась относительно контрольной группы животных.
Таким образом, введение этанола приводит к более существенным изменениям в активности КПМ у самок, чем у самцов. Причем изменения активности фермента у самцов и самок могли быть как одно-, так и разнонаправленными, что в свою очередь, определялось дозой вводимого этанола, стадией эстрального цикла, в которой находится животное, отделом, в котором определяется активность фермента и временем, через которое проводилось исследование.
ГЛАВА 4. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проблема алкоголизма на протяжении долгого времени остается и, видимо, еще долго будет оставаться актуальной для человечества в социальном, медицинском плане и даже в аспекте сохранения здорового генофонда людей. Отсюда понятен интерес к этой проблеме специалистов разных профилей, в том числе биохимиков. Данные экспериментальных исследований и клинические наблюдения не позволяют сделать однозначный вывод о том, какой пол более устойчив к действию этанола. Однако считается бесспорным, что алкоголизм у женщин приводит к нейроэндокринным расстройствам, нарушению генеративных функций и полового цикла [64, 81]. Несмотря на многочисленные работы отечественных и зарубежных авторов, посвященных изучению алкогольной интоксикации, патогенетический механизм вышеперечисленных нарушений и возможные пути их лечения изучены недостаточно [81].
Известно, что в этиологии и патогенезе алкоголизма важную роль играют такие регуляторные пептиды как энкефалины, β-эндорфин, АКТГ, ДСИП, нейротензин и ряд других [19, 61, 88]. Кроме того, острая алкогольная интоксикация изменяет уровень ГРФ и гонадотропинов [87, 207, 231], которые оказывают существенное воздействие на функционирование половой системы [11].
Уровень биологически активных пептидов зависит от активности ферментов, участвующих в их обмене [14, 52]. Изучение содержания уровня того или иного нейропептида в тканях не дает достаточно точных представлений о динамических процессах, происходящих в пептидэргической системе при острой алкогольной интоксикации. Более информативным является изучение процессов синтеза и утилизации нейропептидов [19]. Поэтому изучение активности КПН, ФМСФ-КП и КПМ при острой алкогольной интоксикации представляет значительный интерес как для понимания биологической роли самих ферментов, так и для понимания роли регуляторных пептидов в этиологии и патогенезе алкоголизма.
Максимальная активность КПН у интактных животных обоего пола показана в гипофизе, а также в гипоталамусе и стриатуме, то есть в тех отделах, которые характеризуются высоким уровнем нейропептидов [92]. Низкая активность фермента выявлена в надпочечниках и гонадах. Полученные данные о региональном и тканевом распределении КПН хорошо согласуются с литературными данными и подтверждают участие КПН в процессинге биологически активных пептидов [144, 233].
Наибольшая активность ФМСФ-КП отмечена в гипофизе, надпочечниках и половых железах. Установлено, что яичники продуцируют многие нейропептиды, в том числе окситоцин, релаксин, инсулиноподобные факторы роста, эндорфины и энкефалины [20, 84, 85, 109]. В надпочечниках синтезируется достаточно большое количество мет-энкефалина, однако активность КПН в этом органе невелика. Все это позволяет сделать предположение о возможном участии ФМСФ-КП, наряду с КПН в процессинге биологически активных пептидов.
Обнаружена примерно одинаковая активность КПН и ФМСФ-КП в гипоталамусе и стриатуме, некоторые отличия в активности ферментов в гипофизе и существенные в надпочечниках и гонадах, где активность ФМСФ-КП существенно выше, чем КПН. Высокая активность ФМСФ-КП в половых железах может, вероятно, указывать на причастность этого фермента не только к обмену нейропептидов, но и к катаболизму белков, тем более, что гонады характеризуются высоким уровнем катаболизма белка.
Следует отметить, что активность обеих карбоксипептидаз у самок, как правило, выше, чем у самцов. Полученные результаты согласуются с данными о половых отличиях в активности ряда протеолитических ферментов [44] и уровне нейропептидов [113, 132]. Не исключено, что выявленные различия связаны с половыми отличиями в функционировании ГГГС и ГГНС [44].
Согласно результатам эксперимента активность КПН в тканях интактных самок крыс зависела от стадии эстрального цикла в гипофизе, гипоталамусе, стриатуме и яичниках. Причем наиболее высокая активность фермента зафиксирована в гипофизе на стадии проэструса. Известно, что именно на этой стадии регистрируется наиболее высокий уровень ФСГ, ЛГ и пролактина в гипофизе и крови по сравнению с другими стадиями эстрального цикла [11, 17]. Кроме того, именно в проэструсе уровень эстрадиола в крови выше, чем в диэструсе и эструсе [17]. Установлено, что эстрадиол вызывал увеличение внутриклеточного уровня КПН в культуре клеток передней доли гипофиза – GH4C1 [150]. Вероятно, повышение уровня эстрадиола на стадии проэструса, может приводить к увеличению активности фермента в гипофизе. Эти данные позволяют предположить, что КПН, вероятно, участвует в регуляции уровня гонадотропных гормонов в гипофизе в ходе эстрального цикла, а активность фермента, по-видимому, регулируется уровнем половых стероидных гормонов в организме. Интересно отметить, что самая высокая активность аминопептидазо-В-подобных ферментов, которые наряду с основными карбоксипептидазами могут участвовать в биосинтезе этих гормонов, отмечается также в проэструсе [128].
В гипоталамусе повышение активности КПН на стадии эструса коррелирует с увеличением уровня опиоидных пептидов, однако не согласуется с изменением уровня люлиберина и окситоцина [11,106] в этом отделе мозга и сыворотке крови. Возможно, что в обмене этих нейропептидов принимают участие и другие основные карбоксипептидазы, в частности ФМСФ-КП.
Известно, что у крыс и мышей потребление этанола значительно уменьшается в период эструса [19, 45]. Возможно, что более высокая активность КПН в стриатуме на стадии эструса приводит к увеличению концентрации энкефалинов в этом отделе мозга. Предполагается, что повышение уровня мет-энкефалина в стриатуме соотносится с реализацией эйфоригенного эффекта с эмоционально положительно окрашенным восприятием [19], что, вероятно, может приводить к снижению добровольного потребления этанола.
В яичниках, где обнаружены циклические изменения в уровне ряда нейропептидов [18, 240], активность КПН на стадии проэструса достоверно выше, чем в диэструсе, что позволяет предположить возможность вовлечения фермента в циклические изменения уровня биологически активных пептидов в этом органе.
Активность ФМСФ-КП зависит от стадии эстрального цикла только в яичниках, где на стадии диэструса она почти в 2 раза ниже по сравнению с проэструсом и эструсом. Именно в проэструсе и эструсе происходит разрыв и деградация фолликула, а затем развитие прогестативного тела [17], возможно, что ФМСФ-КП вовлекается в эти процессы. Отсутствие изменений в активности ФМСФ-КП в других исследованных отделах, возможно, указывает на то, что в них фермент участвует в регуляции тонической секреции регуляторных пептидов в ходе эстрального цикла, но, очевидно, не влияет на циклическую секрецию гормонов.
Активность КПМ в гипоталамусе и стриатуме у самок крыс достоверно не отличается от активности фермента у самцов. Вероятно, различный уровень регуляторных пептидов, обнаруживаемый у особей разного пола в данных отделах обусловлен функционированием других протеолитических ферментов. Кроме того, активность КПМ в гипоталамусе и стриатуме самок не зависит от стадии эстрального цикла. Возможно, что в гипоталамусе и стриатуме КПМ участвует в регуляции базального уровня биологически активных пептидов, но, вероятно, не вовлекается в циклические изменения уровня нейропептидов в ходе полового цикла. Отсутствие достоверных половых отличий в активности КПМ и зависимости активности фермента от стадии эстрального цикла, очевидно, может свидетельствовать о разной биологической роли КПМ и ФМСФ-КП, а также КПН [27, 28, 29].
У самцов крыс введение физраствора вызывало увеличение активности КПН. Увеличение активности фермента в гипофизе коррелирует с увеличением уровня АКТГ [19, 86], являющимся важным компонентом стресс реализующих систем и является специфичным ответом на стресс, которым, по-видимому, является внутрибрюшинная инъекция физраствора. Эти данные хорошо согласуются с полученными ранее [38].
У самок крыс введение физиологического раствора приводило к снижению активности КПН в гипофизе через 0,5 и 4 часа в проэструсе и эструсе, такие же изменения регистрировались в гипоталамусе самцов и самок крыс через 4 часа после инъекции. Вероятно, это связано с особенностями воздействия внутрибрюшинной инъекции физраствора, при которой в организм поступает дополнительное количество жидкости. Понижение активности КПН может способствовать ускорению высвобождения жидкости из организма благодаря уменьшению образования вазопрессина [72]. У самок обнаружено снижение активности КПН в надпочечниках, чего не наблюдалось у самцов. Вероятно, это обусловлено половыми отличиями в ответной реакции организма на стресс [45]. Обнаруженное уменьшение активности фермента в надпочечниках у самок может являться косвенным доказательством включения надпочечников в ответ на стресс [19, 86]. Полученные нами данные об изменении активности КПН у самок крыс при внутрибрюшинном введении физраствора хорошо согласуются с полученными ранее по влиянию инъекции оливкового масла на активность фермента у самок мышей [43].
Интересно отметить, что у самцов и самок отсутствовали изменения в активности КПН в гонадах, что подтверждает тезис о ведущей роли ГГНС в ответе на стресс [19, 86]. Отсутствие изменений в активности КПН во всех исследуемых органах у самок крыс через 18 часов после инъекции физраствора, возможно, свидетельствует о более быстром угасании стресс-реакции, по сравнению с самцами.
У самок в гипофизе после введения физиологического раствора активность ФМСФ-КП уменьшалась на стадии эструса, оставаясь на прежнем уровне на других стадиях эстрального цикла, в то время как у самцов наблюдалось увеличение активности фермента в этом отделе. У самцов введение физраствора вызывает изменение активности ФМСФ-КП также в гипоталамусе через 0,5 часа после воздействия, а у самок – и в других исследованных отделах. Принимая во внимание то, что уровень нейропептидов зависит от активности ферментов их обмена, можно предположить, что выявленные половые отличия в изменении активности ФМСФ-КП способствуют различной секреции биологически активных пептидов у самцов и самок при стрессе [30, 33].
Наиболее значительно активность ФМСФ-КП при введении физраствора изменялась в яичниках, причем в подавляющем большинстве случаев она увеличивалась. Не исключено, что ФМСФ-КП может вовлекаться в процессинг регуляторных пептидов при стрессе и/или в деградацию избытка нейропептидов, которые образуются в ответ на стресс. Кроме того, эти данные, возможно, могут частично объяснить нарушения эстрального цикла, прекращение овуляции под действием стресса [61, 81, 86].
Интересно отметить, что на стадии диэструса в большинстве отделов после введения физраствора активность ФМСФ-КП увеличивалась, а в эструсе, напротив, снижалась. Так как этот фермент, по всей видимости, вовлекается в процессинг нейропептидов, а, следовательно, может определять их уровень, от чего, в свою очередь, зависит устойчивость организма к стрессу, можно предположить, что эти результаты указывают на различную устойчивость к стрессирующему воздействию крыс на разных стадиях эстрального цикла [45].
Следует отметить, что активность обоих ферментов у самок изменялась более существенно, чем у самцов, что хорошо согласуется с имеющимися в литературе сведениями о том, что ГГНС самок более подвержена воздействию стресса, чем самцов [6].
Введение физраствора приводит к снижению активности КПМ в гипоталамусе через 4 часа после воздействия у самок крыс на стадии проэструса и эструса и через 0,5 часа у самцов. Известно, что α-неоэндорфин, динорфин 1-13 в качестве С-концевой аминокислоты содержат лизин [72], следовательно, они могут выступать в качестве субстратов для КПМ [123, 248], которая локализуется на внешней стороне плазматической мембраны [123, 248]. Выявленное уменьшение активности КПМ, возможно приводит к замедлению разрушения этих пептидов, обладающих способностью проявлять седативное действие, снижать исследовательскую активность [19, 72]. Что коррелирует с данными о снижении подвижности крыс в тесте “открытое поле” через 4 часа после инъекции физраствора и частичном восстановлении активности через 24 часа после воздействия [38]. В стриатуме через 0,5 часа после инъекции активность КПМ на стадии диэструса повышалась, а в проэструсе снижалась; через 4 часа снижение активности наблюдалось только в диэструсе. Известно, что КПМ участвует в модуляции и инактивации нейропептидов, тем самым, влияя на их уровень в организме, от которого во многом зависит устойчивость к стрессу. Поэтому разнонаправленные изменения активности КПМ в стриатуме у самок могут свидетельствовать, о различной устойчивости к стрессу самок крыс на разных стадиях эстрального цикла [45]. Отсутствие изменений в активности фермента после инъекции физраствора у самцов и их наличие у самок, по-видимому, свидетельствует о различной устойчивости крыс разного пола к стрессирующему воздействию [2].
Введение этанола приводит к увеличению активности КПН в гипофизе на стадии эструса (доза 1 г на кг) и диэструса (доза 4 г/кг), что согласуется с представлениями об активации ГГНС и увеличении секреции и образования АКТГ, β-эндорфина, пролактина при острой алкогольной интоксикации [19, 86]. Однако в проэструсе и через 4 часа после инъекции этанола в диэструсе активность КПН была ниже по сравнению с контрольными животными. Вероятно, разнонаправленные изменения в активности КПН обусловлены различным физиологическим, а, следовательно, и гормональным статусом самок крыс на разных стадиях эстрального цикла [21, 60]. Принимая во внимание возможное участие КПН в биосинтезе гонадотропных гормонов [23], становятся понятными нарушения полового цикла за счет изменений в активности КПН, которые приводят к изменению уровня гонадотропинов. Особенно пагубным, вероятно, является снижение активности КПН на стадии проэструса по сравнению с контрольными и интактными группами животных, когда активность фермента, напротив, по результатам нашего эксперимента в норме увеличивается.
У самок введение этанола приводило к увеличению активности КПН в гипоталамусе через 0,5 часа в диэструсе и эструсе и через 4 часа в диэструсе, что также свидетельствует об увеличении активности ГГНС при острой алкогольной интоксикации и, в частности, коррелирует с данными о возрастании концентрации β-эндорфина в гипоталамусе, что связывают с проявлением эмоционально позитивных свойств этанола [19]. Однако введение этанола в дозе 4 г/кг приводит к снижению активности фермента в эструсе через 4 часа и в диэструсе через 18 часов, что, вероятно, ведет к уменьшению синтеза β-эндорфина и проявлению эмоционально негативных свойств этанола в больших дозах [19]. В проэструсе, когда в организме фиксируется высокий уровень эстрадиола, изменения активности КПН отсутствовали. Эти данные подтверждаются сведениями о снижении уровня опиоидных пептидов в гипоталамусе овариоэктомированных самок при совместном введении этанола и эстрадиола [107], что, по-видимому, свидетельствует о возможной модификации ответной реакции опиоидэргической системы на действие этанола эстрадиолом [107].
У самцов в гипоталамусе через 0,5 и 4 часа после инъекции этанола наблюдается повышение активности КПН, которое может быть связано с увеличением образования КРФ, β-эндорфина при острой алкогольной интоксикации [19, 86]. Однако через 18 часов после внутрибрюшинного введения этанола происходит снижение активности КПН по отношению к контрольной группе животных, что, возможно, является результатом действия компенсаторных механизмов, направленных на нормализацию функционального состояния пептидэргических систем гипоталамуса, а, следовательно, гипофиза и периферических желез внутренней секреции.
Введение этанола самцам вызывало в большинстве случаев менее существенные изменения активности КПН в гипофизе и гипоталамусе по сравнению с самками, что согласуется с данными о более существенном изменении уровня плазматических гонадотропинов, АКТГ и кортикостероидов у самок по сравнению с самцами [217, 231].
В стриатуме у самцов через 18 часов после введения этанола в дозе 1 г/кг и через 0,5 часа в дозе 4 г/кг обнаруживалось повышение активности КПН, что согласуется с данными об увеличении содержания мет-энкефалина [241], ДСИП в стриатуме [22]. Считается, что увеличение уровня метэнкефалина в стриатуме соотносится с реализацией эйфоригенного эффекта, а ДСИП приписывают, в том числе антистрессорные, анксиолитические свойства. Вероятно, именно такое действие этанола при однократном введении и связано с развитием влечения к этанолу, особенно у предрасположенных к алкоголизму индивидуумов [19].
Однако через 4 часа после инъекции этанола в любой из двух доз происходило снижение активности КПН в стриатуме у самцов, подобные изменения наблюдались также у самок на стадии эструса. Это, возможно, указывает на то, что в образование энкефалинов, ДСИП могут вовлекаться другие карбоксипептидазы, в том числе и ФМСФ-КП.
Введение этанола самкам крыс в дозе 1 г/кг на стадии диэструса и эструса приводит к увеличению активности КПН в надпочечниках, что согласуется с данными об активации ГГНС при острой алкогольной интоксикации [19]. При инъекции этанола в дозе 4 г/кг у самок в проэструсе и самцов происходит увеличение активности фермента через 0,5 часа после инъекции и снижение активности через 4 часа. Наши результаты согласуются с данными Беляева Н.А. и соавт. об усиленном образовании энкефалинов в промежутке между 15 и 60 минутами после внутрибрюшинного введения этанола и об угнетении синтеза через более длительный промежуток времени [15]. Что, вероятно, является результатом действия компенсаторных механизмов, направленных на нормализацию функционального состояния энкефалиновой системы надпочечников.
Введение этанола в дозе 1 г/кг приводит к возрастанию активности КПН в яичниках у самок на стадии диэструса через 4 часа после инъекции, в дозе 4 г/кг – к увеличению активности КПН в диэструсе через 0,5 часа и проэструсе через 4 часа и к уменьшению активности фермента в эструсе через 18 часов после инъекции – все это, вероятно, приводит к нарушению синтеза биологически активных пептидов в яичниках в ходе эстрального цикла.
В половых железах самцов через 0,5 часа после введения этанола в любой из двух доз активность КПН достоверно уменьшается по сравнению с контролем. Однако через 4 и 18 часов активность фермента достоверно не отличается от таковой у животных контрольной группы. Вероятно, это связано с тем, что этанол способен вызывать значительное снижение уровня тестостерона [98], экзогенное введение которого приводит к увеличению активности КПН в семенниках [78]. В то же время, после однократной инъекции алкоголя уровень тестостерона достаточно быстро нормализуется [98]. Следовательно, снижение уровня тестостерона и возвращение его к исходным значениям, вызванные инъекцией этанола, по-видимому, объясняет происходящие изменения в активности КПН.
Известно, что введение этанола является стрессом для самцов и самок [19, 88], об этом свидетельствуют сходные изменения активности КПН при введении этанола и физраствора в гипофизе по сравнению с интактными животными. Однако необходимо заметить, что введение этанола в дозе 1г/кг в гипофизе на стадии эструса, в гипоталамусе и в стриатуме и инъекция этанола в дозе 4 г/кг в стриатуме не приводит к изменению активности КПН относительно нормы, хотя при введении физиологического раствора сдвиги в активности фермента наблюдались. Это, вероятно, можно объяснить тем, что этанол в определенных условиях может выступать в роли антистрессорного фактора. Результаты нашего эксперимента указывают на то, что меньшая доза этанола нормализует активность фермента в большем числе органов. Эти данные находят свое подтверждение в литературе, где приводятся сведения о том, что более выраженный анксиолитический, антистрессорный эффект присущ малым дозам этанола, а при увеличении дозы этанола начинает преобладать депрессивный, наркотический компонент [19].
Интересно отметить, что введение этанола в дозе 1 г/кг у самок на стадии эструса не вызывает изменения активности КПН относительно нормы, а в надпочечниках она повышается. Это, вероятно, связано с тем, что в гипофизе и надпочечниках синтезируются качественно разные пептиды в ответ на острую алкогольную интоксикацию: из гипофиза в кровяное русло в числе прочих нейропептидов поступает АКТГ [158, 230], который способствует развитию стресс-реакции в организме, а из надпочечников в кровь выделяется мет-энкефалин, который обладает стресспротективным действием [15]. Таким образом, возможно, что введение этанола в малой дозе на стадии эструса подавляет развитие стресс-реакции благодаря совместному действию двух вышеназванных факторов и, по-видимому, обладает более выраженным стресспротекторным действием, чем на других стадиях эстрального цикла.
Более существенные изменения активности КПН в гипофизе у самцов, а у самок в гипофизе и яичниках по сравнению с другими органами свидетельствует о том, что введение этанола существенно изменяет гормон продуцирующую деятельность гипофиза и подтверждает данные о том, что этанол в первую очередь поражает гипофизарно-гонадальную систему [19].
Введение самкам крыс этанола в дозе 1 г/кг приводило к увеличению активности ФМСФ-КП в гипофизе на стадиях эструса и диэструса, что согласуется с данными об увеличении уровня АКТГ, β-эндорфина, пролактина после острой алкогольной интоксикации [66, 94, 158, 159, 206, 230, 257]. Введение этанола вызывало изменения активности ФМСФ-КП и у самцов, однако, как правило, эти изменения были менее выражены. При введении этанола в дозе 1 г/кг в гипофизе только через 18 часов наблюдалось увеличение активности фермента. Эти данные, по-видимому, могут подтверждать предположение о роли ФМСФ-КП как фермента, участвующего в процессинге регуляторных пептидов [28, 29, 42]. Однако введение этанола на стадии проэструса приводит к снижению активности фермента более чем в 2 раза (подобные изменения обнаруживаются и для КПН), что, возможно, приводит к уменьшению биосинтеза гонадотропных гормонов и отсутствию их пика в периовуляторный период [179]. Таким образом, по-видимому, возникают грубые дискоординационные нарушения механизмов обратной связи в функции гипофизарно-гонадальной системы, которые могут быть обусловлены как снижением чувствительности гипоталамических регуляторных центров, так, и, вероятно, связаны с уменьшением синтеза гонадотропинов [86], за счет уменьшения активности ферментов, участвующих в их биосинтезе.
Введение этанола в любой из двух доз приводит к увеличению активности ФМСФ-КП в гипоталамусе через 4 и 18 часов после воздействия, что, возможно, указывает на вовлечение этого фермента в биосинтез нейропептидов, уровень которых изменяется после острой алкогольной интоксикации (КРФ, β-эндорфин, энкефалины). Однако такое отсроченное во времени изменение активности ФМСФ-КП по сравнению с КПН, возможно, указывает на участие этих двух ферментов в биосинтезе различных нейропептидов. Эту же мысль подтверждают данные работы, в которой указывается, что КПН имеет большее сродство к субстратам, в которых перед остатком основной аминокислоты содержится остатки глицина или аланина, а ФМСФ-КП – к субстратам, содержащих в качестве предшествующей аргинину и лизину аминокислоту с гидрофобным радикалом [75].
В гипоталамусе у самцов через 4 и 18 часов после инъекции этанола в дозе 1 г/кг активность ФМСФ-КП повышается, увеличивается она и после инъекции этанола в дозе 4 г/кг через 4 часа после воздействия. Разнонаправленные изменения активности фермента в гипофизе и гипоталамусе у самцов, возможно, связаны с тем, что в этих отделах синтезируются различные биологически активные пептиды [38], которые выполняют разные функции при острой алкогольной интоксикации. Так, в гипофизе синтезируется АКТГ, который регулирует синтез и секрецию кортикостероидов надпочечниками [19, 86]. В гипоталамусе синтезируются нейропептиды (вазопрессин, КРФ, энкефалины, вещество Р), регулирующие синтез и секрецию АКТГ [43].
У самок в стриатуме при введении этанола в обеих дозах в подавляющем большинстве случаев активность ФМСФ-КП повышалась. В стриатуме у самцов также наблюдается увеличение активности фермента через 4 часа после введения этанола в дозе 4 г/кг. Это, по-видимому, подтверждает высказанное нами ранее предположение об участии этого фермента в биосинтезе ряда нейропептидов в стриатуме.
В надпочечниках при введении этанола у самок крыс на стадии проэструса наблюдается уменьшение активности ФМСФ-КП, на стадии эструса – разнонаправленные изменения активности фермента в зависимости от времени и дозы этанола, а на стадии диэструса активность фермента либо не изменялась, либо увеличивалась. Разнонаправленные изменения активности фермента, наблюдаемые не только в надпочечниках, но и в остальных изученных отделах на разных стадиях эстрального цикла, могут приводить к изменению уровня нейропептидов (некоторые из которых определяют развитие влечения к алкоголю). Это может свидетельствовать о различном уровне алкогольной мотивации крыс на разных стадиях эстрального цикла. Так в литературе имеются данные о дифференцированной динамике изменения уровня пролактина, АКТГ, β-эндорфина, мет-энкефалина при введении этанола у крыс с различной предрасположенностью к алкоголю [19]. Эта гипотеза согласуется с данными о том, что у мышей, предпочитающих этанол, обнаружено существенное повышение уровня мРНК АПФ в стриатуме после отмены этанола при хронической алкоголизации по сравнению с животными, отвергающими этанол [265].
Увеличение активности ФМСФ-КП у самцов при алкогольной интоксикации в надпочечниках, где этот фермент, возможно, участвует в биосинтезе энкефалинов, уровень которых увеличивается после введения этанола, подтверждает данные об активации ГГНС при острой алкогольной интоксикации [19, 74].
Обращает на себя внимание очень сильное изменение активности ФМСФ-КП в яичниках при введении этанола по отношению к контрольной группе животных, причем более выраженное в эструсе. В ряде случаев повышение активности фермента после инъекции этанола превышало на 400% контрольные значения, при сравнении активности ФМСФ-КП в яичниках самок крыс, испытавших острую алкогольную интоксикацию, с интактной группой животных это увеличение было еще большим и превосходило активность в последней группе почти на 1200%. Что, вероятно, принимая во внимание возможное участие ФМСФ-КП в процессах деградации фолликула и формировании, а затем и в регрессии желтого тела, а также роль фермента в биосинтезе нейропептидов, может объяснять нарушения эстрального цикла, ановуляцию и другие патологические процессы, наблюдаемые при алкоголизме [64, 81]. В настоящее время важное значение в возникновении гаметопатий придают изменению гормональной регуляции репродуктивного процесса и к вызываемым им нарушениям гаметогенеза и овуляции [73]. Одним из факторов, вызывающих изменение гормонального статуса является этанол. Известно, что введение этанола крысам из расчета 3,6 г/кг существенно увеличивает частоту анеуплоидных гамет (на 25% по сравнению с контролем) [73]. Введение этанола приводит, как правило, к снижению уровня половых стероидных гормонов [2, 64, 65], которые могут оказывать влияние на активность исследуемых карбоксипептидаз [78]. Так, вероятно, инъекция этанола, ведет к снижению уровня прогестерона в организме, что приводит к увеличению активности ФМСФ-КП, более выраженному на стадии эструса, чем на стадии диэструса. Вероятно, это связано с тем, что в диэструсе уровень прогестерона ниже, чем в эструсе [17], поэтому инъекция этанола вызывает более значительное изменение этого гормона именно в послеовуляторной фазе цикла и, как следствие, более существенное изменение активности фермента.
Введение этанола самцам крыс вызывало менее существенные изменения в активности ФМСФ-КП в гонадах: активность фермента возрастала только через 18 часов после инъекции этанола в дозе 4 г/кг. Вероятно, это может свидетельствовать о большей устойчивости пептидэргической системы половых желез самцов к действию этанола, по сравнению с самками.
Данные об изменении активности ФМСФ-КП подтверждают мнение о том, что инъекция этанола является стрессом для животных [19, 74, 86, 88]. Так как она вызывает, как правило, увеличение активности ФМСФ-КП, что может, видимо, приводить к усиленному образованию нейропептидов, запускающих и ограничивающих стресс-реакцию [71, 83]. Кроме того, после инъекции этанола в большинстве случаев происходят изменения, сходные с теми, которые наблюдаются при введении физраствора.
Однако в ряде случаев, например, в проэструсе при введении физраствора активность ФМСФ-КП уменьшается, но введение этанола нивелирует эти изменения, вероятно, нормализуя функционирование пептидэргических систем.
Интересно отметить, что введение физраствора на стадии эструса приводит к снижению активности ФМСФ-КП во всех исследованных тканях, кроме надпочечников. Однако инъекция этанола вызывает противоположные изменения (причем более выраженные) активности фермента по отношению к норме, что приводит к значительному повышению активности ФМСФ-КП относительно контроля. Это, вероятно, связано с особенностями гормонального статуса животных на данной стадии эстрального цикла [17, 45, 247], а также указывает на специфичность воздействия этанола [86].
Внутрибрюшинное введение этанола приводит к увеличению активности КПМ в гипоталамусе у самок на стадии диэструса и у самцов через 0,5 часа после введения этанола в дозе 1 г/кг. Увеличение активности фермента наблюдается также в стриатуме у самок в проэструсе через 0,5 часа после инъекции этанола в дозе 4 г/кг и на стадии диэструса при введении этанола в любой из двух доз. Эти данные согласуются со сведениями о том, что под влиянием острой алкогольной интоксикации увеличивается уровень многих нейропептидов, которые обладают эйфоризирующим, антистрессорным, анксиолитическим действием, а также нейропептидов, активирующих систему негативного подкрепления (проконвульсанты, пептиды, индуцирующие страх, агрессию, дисфорию) [19]. Вероятно, увеличение активности КПМ связано с инактивацией большого количества пептидов, секретируемых из клетки в ответ на введение этанола.
Кроме того, увеличение активности КПМ может усиливать деградацию эндозепина (эндогенный антагонист ГАМК-рецепторов, содержит С-концевой лизин, а, следовательно, может быть субстратом для КПМ), повышенный уровень которого вызывает беспокойство, проконфликтное поведение [72]. Таким образом, видимо, влияя на активность КПМ, этанол может понижать уровень этого нейропептида, что, вероятно, может частично объяснить анксиолитический, антистрессорный эффект этилового спирта [19, 88].
Однако в ряде случаев активность КПМ снижается под влиянием инъекции этанола, что, по-видимому, может способствовать проявлению таких свойств этанола, как анальгезирующий и седативный эффекты, способность вызывать чувство эйфории за счет уменьшения инактивации динорфина А 1-13 и α-неоэндорфина. Тем более, что в гипоталамусе и стриатуме отмечается тенденция к увеличению уровня этих нейропептидов при острой алкогольной интоксикации [243]. Вероятно, механизм, посредством которого этанол проявляет свои специфические эффекты, частично определяется стадией эстрального цикла, в которой пребывает животное.
Для определения особенностей ответной реакции организма на острую алкогольную интоксикацию интересно рассмотреть влияние стадии эстрального цикла и силы оказываемого воздействия на активность исследуемых карбоксипептидаз.
Таблица 19. Дисперсионный анализ влияния стадии эстрального цикла, силы воздействия и их взаимодействия на активность КПН, ФМСФ-КП и КПМ (значения критерия Фишера: FФ1– влияние стадии эстрального цикла, FФ2 – влияние силы воздействия FФ3 – взаимодействие влияния стадии эстрального цикла и силы воздействия).
| Фермент | Отдел | Самки | Самцы | ||
| FФ1 | FФ2 | FФ3 | FФ2 | ||
| КПН | Гипофиз | 0,48 | 1,46 | 10,87*** | 1,94 |
| Гипоталамус | 12,83*** | 3,40* | 0,47 | 3,41* | |
| Стриатум | 1,43 | 0,39 | 1,80 | 2,22 | |
| Надпочечники | 1,13 | 0,39 | 0,93 | 1,99 | |
| Яичники | 0,74 | 1,10 | 2,11 | 0,89 | |
| ФМСФ-КП | Гипофиз | 6,96** | 11,94*** | 3,80*** | 1,36 |
| Гипоталамус | 13,04*** | 7,45*** | 3,50** | 3,14 | |
| Стриатум | 16,10*** | 6,91** | 2,75* | 2,88 | |
| Надпочечники | 8,26**** | 6,69** | 1,46 | 4,89* | |
| Яичники | 3,13* | 6,87** | 4,78** | 2,48 | |
| КПМ | Гипоталамус | 3,63* | 2,37 | 0,97 | 0,64 |
| Стриатум | 3,11* | 0,49 | 2,31 | 0,74 | |
Таким образом, обнаружено достоверное влияние стадии эстрального цикла на активность ФМСФ-КП и КПМ во всех исследованных отделах при острой алкогольной интоксикации. Активность КПН зависела от стадии эстрального цикла только в гипоталамусе. Сила воздействия влияла на активность ФМСФ-КП у самок во всех изученных отделах, а у самцов – только в надпочечниках. На активность КПН сила воздействия влияла у особей обоего пола только гипоталамусе и не влияла на активность КПМ. Можно предположить, что отличия в ответной реакции организма самок на острую алкогольную интоксикацию на разных стадиях эстрального цикла в большей степени обусловлены изменением активности ФМСФ-КП и КПМ в исследуемых отделах, чем КПН. Кроме того, специфичность действия больших и малых доз этанола и различия ответной реакции особей разного пола на алкоголь, вероятно, в большей степени, также опосредуется ФМСФ-КП.
Стоит отметить, что зависимость активности КПН от времени у самцов прослеживается только в гипофизе и надпочечниках, а у самок в гипофизе и гипоталамусе, причем она имеет сходный характер у самцов и самок в диэструсе и эструсе, где активность в подавляющем большинстве случаев повышалась через 0,5 часа после инъекции, понижалась к 4 часам, а к 18 часам, как правило, увеличивалась. При внутрибрюшинном введении физраствора динамика в изменении активности фермента была другой. Эти данные подтверждают представление о том, что острая алкогольная интоксикация приводит к активации многих пептидэргических систем, в частности, опиоидной [86, 88]. Стадия активации затем сменяется стадией, на которой активность КПН уменьшается, что, вероятно, способствует нормализации пептидэргических систем. Однако далее активность фермента вновь подвергается изменениям, что согласуется с данными о долговременном изменении уровня нейропептидов после алкогольной интоксикации.
После введения физраствора или этанола также обнаруживалась зависимость активности ФМСФ-КП от времени, причем характер этих изменений, по-видимому, определялся полом животного, стадией эстрального цикла, а также органом, в котором проводилось определение активности фермента. В отличие от КПН, сходства в изменении активности ФМСФ-КП у особей разного пола, а также у самок на разных стадиях эстрального цикла, было меньше. Это позволяет предположить, что, возможно, ФМСФ-КП принадлежит более важная роль в дифференцированной реакции пептидэргических систем на острую алкогольную интоксикацию на различных стадиях полового цикла и в зависимости от пола. Обнаружено также наличие зависимости активности КПМ от времени после воздействия у самок крыс. Интересно отметить, что у самцов активность этого фермента не зависела от времени, вероятно, этим также можно частично объяснить половые различия в течении и развитии алкогольной интоксикации.
В норме в ходе эстрального цикла отмечается изменение содержания различных биологически активных пептидов как в мозге, так и в периферических тканях [11, 141, 257,]. Очевидно, что изменение уровня регуляторных пептидов во многом связано с изменениями в функционировании ферментных систем, участвующих в их синтезе и деградации [28, 41]. Острая алкогольная интоксикация вызывает изменение уровня различных нейропептидов, в том числе гонадотропных, опиоидных, нейропептида Y, адренокортикотропина, ДСИП и др. [22, 102, 137, 158, 159]. Возможно, что изменение активности КПН, ФМСФ-КП и КПМ, которые участвуют в обмене нейропептидов, у крыс с острой алкогольной интоксикацией отражает один из механизмов опосредованного нарушения содержания регуляторных пептидов на разных стадиях эстрального цикла, а также играет роль в этиологии и патогенезе алкоголизма.
Наблюдающееся в некоторых тканях при острой алкогольной интоксикации различное и/или разнонаправленное изменение активности КПН, ФМСФ-КП и КПМ или изменение активности только одного из ферментов, может быть одной из причин нарушения соотношения уровня разных нейропептидов в этих отделах. В частности, имеются сведения об избирательном изменении содержания энкефалинов в разных регионах мозга: снижение содержания уровня мет-энкефалина в стриатуме, таламусе и продолговатом мозге при неизменном уровне лей-энкефалина и снижение уровня мет-энкефалина в коре головного мозга при алкогольной интоксикации [19, 243]. При длительной алкоголизации наблюдается нарушение в соотношении АКТГ/β-эндорфин [157].
В норме наблюдаются половые отличия активности КПН и ФМСФ-КП и в мозге, и в периферических тканях. Острая алкогольная интоксикация, зачастую по-разному изменяя активность изучаемых ферментов, приводит к нарушению этого соотношения. Так активность КПН и ФМСФ-КП в гипофизе выше у самок, однако после алкогольной интоксикации активности ферментов у особей разного пола выравниваются, либо у самцов активность КПН и ФМСФ-КП становится выше. Кроме того, в тех тканях, в которых не было половых отличий, они появляются после инъекции этанола.
Интересно также отметить, что в тех отделах, где не наблюдалось зависимости КПН, ФМСФ-КП и КПМ от стадии эстрального цикла, она появлялась после инъекции этанола. Известно, что алкогольная интоксикация изменяет содержание половых гормонов и нейропептидов, регулирующих их секрецию [2, 87, 98]. Известно также, что активность КПН и ФМСФ-КП зависит от половых гормонов [78, 79]. Таким образом, изменение активности ферментов у алкоголизированных особей и изменение их соотношения у самцов и самок, вероятно, отражает один из механизмов нарушения функционирования половой системы, а также может носить этиопатогенетический характер для синдромологии алкоголизма.
Интересно отметить, что после введения этанола в дозе 1 г/кг и 4 г/кг активность исследуемых ферментов на стадии проэструса была, как правило, ниже, чем в эструсе и диэструсе, хотя в норме чаще наблюдалось обратное соотношение активности, что также можно рассматривать как один из механизмов негативного влияния этанола на половую систему самок крыс. Вероятно, это связано с тем что в ходе эстрального цикла меняется уровень половых стероидных гормонов, которые могут оказывать влияние на активность КПН, ФМСФ-КП и, возможно, КПМ [78, 79, 183].
Для более полного понимания биологической роли ФМСФ-КП, которая является менее изученным ферментом, чем КПН и КПМ, мы провели корреляционный анализ (табл. 20, 21).
Таблица 20. Коэффициенты корреляции между активностью основных КП в тканях и отделах мозга самок крыс при острой алкогольной интоксикации (* - р<0,05, ** - р<0,01, *** - р<0,001).
| Ткань, отдел мозга | КПН и ФМСФ-КП | КПН и КПМ | ФМСФ-КП и КПМ |
| Гипофиз | 0,202* (115) | - | - |
| Гипоталамус | 0,472*** (137) | 0,310***(146) | 0,083 (137) |
| Стриатум | 0,518*** (142) | 0,005 (144) | 0,009 (138) |
| Надпочечники | -0,063 (133) | - | - |
| Яичники | 0,137 (114) | - | - |
Таблица 21. Коэффициенты корреляции между активностью основных КП в тканях и отделах мозга самцов крыс при острой алкогольной интоксикации (** - р<0,01).
| Ткань, отдел мозга | КПН и ФМСФ-КП | КПН и КПМ | ФМСФ-КП и КПМ |
| Гипофиз | 0,246 (46) | - | - |
| Гипоталамус | 0,254 (53) | 0,383** (55) | -0,05 (55) |
| Стриатум | 0,017 (53) | 0,377** (54) | -0,139(54) |
| Надпочечники | 0,003 (55) | - | - |
| Семенники | 0,192 (49) | - | - |
У самок отмечена высокая положительная корреляция между активностью КПН и ФМСФ-КП в гипофизе, гипоталамусе и стриатуме, но не в надпочечниках и яичниках. Это может быть связано с тем, что ФМСФ-КП, вероятно, выполняет разные функции в мозге и периферических тканях, например, в мозге вовлекается в процессинг, а в тканях в деградацию нейропептидов. Возможно также существование нескольких форм фермента, различающихся тканевой и региональной локализацией. Не исключено, что в мозге и тканях ФМСФ-КП представлена разными ферментами с близкими физико-химическими свойствами. Свойства ФМСФ-КП очень сходны со свойствами ЛКПА [204, 226]. Возможно, что ФМСФ-КП и ЛКПА являются изоферментами, которые отличаются тканевой и субклеточной локализацией. В этом случае представляется вероятным, что изофермент, преобладающий в нервной ткани, выполняет функции, отличные от изофермента, преобладающего в периферических тканях. Однако у самцов положительной корреляции между активностью КПН и ФМСФ-КП не обнаружено ни в одном из изученных отделов. Известно, что активность ферментов, вовлекающихся в обмен нейропептидов различна у самцов и самок [44, 129, 225]. Поэтому, возможно, что ФМСФ-КП по-разному функционирует у самцов и самок и/или вовлекается в разные процессы, связанные с ответом на острую алкогольную интоксикацию. Интересно отметить, что между КПН и КПМ обнаруживается статистически значимая положительная корреляция в гипоталамусе, а у самцов в гипоталамусе и стриатуме. Возможно, что изменение интенсивности биосинтеза нейропептидов под действием КПН влечет за собой соответствующее изменение скорости их инактивации и модификации при участии КПМ.
Весьма важным является вопрос о механизмах изменения активности основных карбоксипептидаз под влиянием внутрибрюшинного введения этанола. Ген КПH содержит достаточно большое количество регуляторных участков, которые отличаются у разных типов клеток, что позволяет предположить возможность различной регуляции экспрессии гена фермента в разных типах клеток и возможность регуляции экспрессии различными агентами [177, 188, 253], которыми могут быть как сам этанол, так и продукты его метаболизма. Аналогичные механизмы регуляции можно предположить для ФМСФ-КП и КПМ. Для КПН и ФМСФ-КП показана зависимость активности от стероидных гормонов [78, 79]. Возможно, что этанол, изменяя уровень тестостерона, прогестерона, эстрадиола, кортикостерона приводит к изменению интенсивности транскрипции мРНК данных ферментов.
Известно также, что острое введение этанола стимулирует активность аденилатциклазы в ЦНС и периферических органах, а также в культуре нервных клеток [237, 262] (предполагается, что в разных структурах мозга алкоголь может взаимодействовать с разными функциональными компонентами аденилатциклазной системы) [259]. Поэтому, не исключено, что во влиянии этанола на активность исследуемых карбоксипептидаз могут быть задействованы цАМФ-зависимые механизмы.
Острая алкогольная интоксикация вызывает усиленное высвобождение в синаптическую щель опиоидных пептидов, кроме того, этанол и/или его метаболиты также могут взаимодействовать с опиоидными рецепторами (в основном δ-типа) [88], что, вероятно, приводит к оккупации большей части опиоидных рецепторов, это, в свою очередь, может вызывать по механизму обратной связи изменение уровня биосинтеза соответствующих нейропептидов [92], в образовании которых принимают участие КПН и, возможно, ФМСФ-КП, а в деградации – КПМ. По-видимому, изменение активности изучаемых ферментов в данном случае может происходить на уровне транскрипции их генов.
Известно, что острая алкогольная интоксикация приводит к понижению внутриклеточной концентрации Са2+ [10]. Несмотря на то, что ионы Са2+ непосредственно не влияют на активность КПН, в ее составе обнаружен участок связывания данных ионов [213]. Ионы Са2+ способствуют агрегации КПН и связыванию ее с мембраной [255]. Возможно, что биологическая роль растворимой и мембраносвязанной КПН отличается [32, 39, 97]. Предполагают, что обе формы принимают участие в процессинге, но мембраносвязанная, наряду с этим, способна принимать участие в сортировке пептидов [118, 119, 215, 244,]. Кроме того, имеются сведения о том, что активность прогормонконвертазы – фермента, участвующего в процессинге проКПН, регулируется ионами Са2+ [148]. Изложенное выше позволяет предположить, что действие этанола на активность КПН может быть опосредовано изменением внутриклеточной концентрации ионов Са2+. Это может приводить как к изменению уровня активности фермента, так и к изменению соотношения растворимой и мембраносвязанной форм, что в свою очередь влияет на процессинг и сортировку биологически активных пептидов. Возможно, что аналогичный механизм будет действовать и в отношении ФМСФ-КП, так как для нее также обнаружена мембраносвязанная форма.
В связи с тем, что КПН и ФМСФ-КП существуют в мембраносвязанной форме [34, 47, 122, 197], а КПМ является мембраносвязанным эктоферментом [123, 248], изменение активности вышеперечисленных ферментов можно объяснить изменением состояния мембран под действием этанола [112]. В опытах in vitro на синаптосомальных плазматических мембранах и миелиновых мембранах было показано, что уже в концентрации 1 мМ и выше этанол приводит к дозозависимому снижению упорядоченности мембраны, т.е. повышает ее текучесть, жидкостность, что вызывает изменение активности ряда ферментов, инкорпорированных в мембрану [199].
В проведенных нами опытах in vitro (данные не приводятся) этанол в концентрациях, соответствующих дозам при введении in vivo не влиял на активность ФМСФ-КП, КПН и КПМ. Однако не исключено, что активность изучаемых ферментов может изменяться за счет изменения конформации их молекул под влиянием продуктов метаболизма этанола, в частности ацетальдегида. Ацетальдегид благодаря наличию чрезвычайно реакционноспособного карбонила взаимодействует с аминогруппами аминокислот, входящими в состав полипептидов, модифицируя белки, что влечет за собой изменение функций молекул и структур клетки, в которые они входят. Существенно, что связывание ацетальдегида характеризуется отсутствием специфичности, так как осуществляется в результате неферментных реакций [16]. Известно, что ацетальдегид модифицирует белки сыворотки крови, белки и фосфолипиды клеточных мембран, нарушает биогенез ферментных систем мембран и сыворотки крови, приводит к образованию межмолекулярных сшивок, вызывает деградацию некоторых высокомолекулярных белковых структур [16, 99, 180]. Также, ацетальдегид неблагоприятно влияет на основные процессы посттрансляционной модификации белков: ацилирование, фосфорилирование, метилирование, из-за чего извращаются регуляторные эффекты гормонов и нейромедиаторов [16, 80].
Вероятно, активность КПН, ФМСФ-КП и КПМ регулируется на уровне экспрессии гена. Однако наличие существенных изменений в активности изучаемых ферментов уже через 0,5 часа после воздействия указывает на возможность и других способов регуляции активности фермента: на уровне процессинга проформы ферментов, который осуществляется эндопептидазами субтилизинового семейства, активируемых ионами Са2+, а также регуляция активности зрелой формы энзима за счет конформационных изменений молекулы, и как следствие, изменение свойств активного центра фермента.
Таким образом, полученные нами данные свидетельствуют о вовлечении основных карбоксипептидаз: КПН, ФМСФ-КП и КПМ в ответную реакцию организма на острую алкогольную интоксикацию. Эти ферменты участвуют в формировании и поддержании влечения к этанолу, развитию толерантности и зависимости. Кроме того, КПН и ФМСФ-КП, по-видимому, посредством измененения уровня нейропептидов, регулирующих содержание половых стероидных гормонов, вовлекаются в формирование полового диморфизма и в контроль эстрального цикла. В свою очередь, изменение гормонального статуса животных вследствие острой алкогольной интоксикации, осуществляемое отчасти исследуемыми ферментами, может приводить к нарушениям репродуктивного процесса.
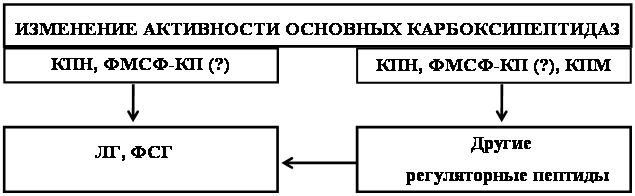
Можно предположить следующий механизм, объясняющий возникновение патологий под действием алкоголя (схема 2): этанол, влияя на активность ферментов обмена регуляторных пептидов напрямую или опосредованно, приводит к изменению уровня ЛГ, ФСГ, а также опиоидных пептидов, окситоцина, АКТГ и других нейропептидов. Последние могут также оказывать влияние на уровень гонадотропинов. Помимо этого алкоголь вызывает дисфункции ГАМК-ергической, дофаминергической, серотонинергической нейромедиаторных систем [19, 80, 88], что также может влиять на уровень ЛГ и ФСГ [46]. Снижение уровня ЛГ и ФСГ приводит к уменьшению образования половых стероидных гормонов, этому же способствует высокий уровень кортикостероидов, которые способны непосредственно действуя на гонады, угнетать их синтез [86]. Снижение уровня эстрогенов и прогестерона нарушает гормональную регуляцию эстрального цикла, а также вызывает возникновение различных аномалий: неадекватному протеканию фаз полового цикла, нарушению его ритма, ановуляции, нарушению нормального созревания фолликулов. В то же время изменение уровня опиодных пептидов, АКТГ, пролактина под действием КПН, ФМСФ-КП и КПМ может приводить к формированию влечения, зависимости, развитию толерантности к этанолу, что в свою очередь количество потребляемого этанола. Формированию алкогольной мотивации и толерантности способствует также и измененный уровень половых стероидных гормонов, которые влияют на активность ферментов, участвующих в метаболизме алкоголя [19, 80, 88].
 | |||||||||
 | |||||||||
 | |||||||||
 |  | ||||||||
Схема 2. Роль основных карбоксипептидаз в ответе организма на алкогольную интоксикацию.
На основании полученных нами данных, которые частично раскрывают роль основных карбоксипептидаз в патогенезе алкоголизма, могут быть, вероятно, определены основные пути поиска средств для профилактики и лечения алкоголизма и бесплодия путем целенаправленного поиска лекарственных средств среди регуляторов активности ферментов.
ВЫВОДЫ
1. Активность карбоксипептидазы Н у самок крыс зависит от стадии эстрального цикла в гипофизе, гипоталамусе, стриатуме и яичниках. Активность ФМСФ-ингибируемой карбоксипептидазы определяется стадией эстрального цикла только в яичниках. Зависимости активности КПМ от стадий полового цикла в гипоталамусе и стриатуме не обнаружено.
2. Введение физраствора приводило к изменению активности карбоксипептидазы Н и ФМСФ-ингибируемой карбоксипептидазы в гипоталамо-гипофизарно-надпочечниковой системе у самцов и самок, а также карбоксипептидазы М в гипоталамусе и стриатуме у самок. Активность исследуемых ферментов более значительно изменяется у самок по сравнению с самцами.
3. Инъекция физиологического раствора вызывала разнонаправленные изменения активности ферментов на разных стадиях эстрального цикла, что может указывать на различную устойчивость к стрессирующему воздействию крыс на разных стадиях эстрального цикла.
4. Введение этанола вызывало наиболее существенные изменения активности карбоксипептидазы Н и ФМСФ-ингибируемой карбоксипептидазы в гипофизе и половых железах у особей обоего пола и карбоксипептидазы М в стриатуме у самок. Более значительные изменения активности ферментов обнаружены у самок.
5. Механизм, посредством которого острая алкогольная интоксикация проявляет свои эффекты, частично определяется стадией эстрального цикла, в которой пребывает животное.
6. Более существенные изменения активности карбоксипептидазы Н и ФМСФ-ингибируемой карбоксипептидазы в гипофизе и половых железах свидетельствуют о том, что острая алкогольная интоксикация существенно изменяет функционирование гипофизарно-гонадальной системы.
7. При острой алкогольной интоксикации отмечается нарушение динамики изменения активности изучаемых ферментов в ходе эстрального цикла.
8. Различный характер изменений активности карбоксипептидазы Н, ФМСФ-ингибируемой карбоксипептидазы и карбоксипептидазы М у самок и самцов свидетельствует о половых отличиях в ответной реакции организма на острую алкогольную интоксикацию.
9. Динамика изменения активности КПН у самок в мозге при острой алкогольной интоксикации коррелирует с динамикой изменений активности ФМСФ-КП, у самцов такой закономерности не обнаружено.
Литература
1. Азарян А.В. Пептидгидролазы нервной системы и их биологические функции. – Ереван: Айастан, 1989. – 208 с.
2. Аккер Л.В. Гормональные изменения и биологически активные вещества у женщин репродуктивного возраста, страдающих алкголизмом // Акушерство и гинекология. – 1991. – № 10. – С. 50-52.
3. Алиев И.А. Нейрогормоны и алкоголизм // Патол. физиология и эксп. терапия. – 1989. – № 5. – С. 85-90.
4. Аминджанов С.А., Барашкова Г.М. Содержание пептидов при хронической алкогольной интоксикции // Клиническая медицина. – 1987. – № 3. – С. 134-136.
5. Андронова Л.М. Биологические механизмы и фармокотерапия экспериментального алкоголизма в зависимости от половых отличий // дис. на соиск. степени докт.мед.наук. – Москва, 1989.
6. Анищенко Т.Г., Буршина С.Н., Шорина Л.Н. К анализу факторов, детерминирующих половые различия в стрессовых реакциях у белых крыс // Бюлл. эксперим. биол. медицины. – 1989. – Т. 108, № 11. – С. 616-618.
7. Арушанян Э.Б., Боровкова Г.К., Конеев С.В., Терешкин О.В. Зависимость переобучения крыс в У-образном лабиринте и их чувствительности к галоперидолу от фазы эстрального цикла // Журн. высш. нерв. деятельности им. И.П. Павлова. – 1988. – Т. 38, № 6. – С. 1093-1097.
8. Афендикова А.П., Боднар П.Н. Влияние алкоголя на развитие эндокринных нарушений: обзор литературы // Врачебное дело. – 1987. – № 6. С. 16-20.
9. Ашмарин И.П., Каменская М.А. Нейропептиды в симпатической передаче // Итоги Н. и Т. (ВИНИТИ. Сер. Физиология человека и животных). – 1988. – 34. – 184 с.
10. Бабич Л.Г., Шлыков С.Г., Борисова Л.А. Влияние этанола на внутриклеточный обмен Са2+ // Укр. биохим. журн. – 2002. – Т. 74, № 1. – С. 19-26.
11. Бабичев В.Н. Нейро-гуморальная регуляция овариального цикла. – М.: Медицина, 1984. – 240 с.
12. Балбатун О.А., Слободская Н.С., Троян Э.И. Р50 и уровень эстрадиола в различные фазы эстрального цикла у крыс. Материалы международной научной конференции, посвященной 35-летию Гродненского медицинского института. – Гродно, 1993. - ч.1. – С.9-10.
13. Балыкова Н.В., Мухина Е.С. Влияние хронического эмоционально-болевого стресса на активность основных карбоксипептидаз в гипоталамо - гипофизарно-надпочечниковой системе пренатально стрессиованных крыс // Вестник молодых ученых ПГПУ им. В.Г. Белинского. – 2003. - №2. – С. 8-10.
14. Беляев Н.А., Генгин М.Т., Годына С.В., Калихевич В.Н., Панченко Л.Ф. Активность энкефалинконвертазы в отделах мозга крыс при алкогольной интоксикации // Вопр. мед. химии. – 1988. – Т. 34, № 4. – С. 118-122.
15. Беляев Н.А., Колесанова Е.Ф. Динамика содержания мет-энкефалина в надпочечниках и плазме крови крыс при острой алкогольной интоксикации // Вопросы мед. химии. – 1990. – Т. 36, № 3. – С.86-87.
16. Божко Г. Х., Волошин П. В. Действие этанола на белки тканей и сыворотки крови человека и животных. // Усп. совр. биол. – 1989. – Т. 108, № 1 (4). – С. 52-65.
17. Боровая Т.Г., Назаренко А.И., Волкова О.В., Адамская Е.И. Математическая модель физиологического эстрального цикла беспородных крыс. //Морфология. – 1993. – Т. 105, № 11-12, - С. 114-125.
18. Боярский К.Ю. Фолликулогенез и современная овариальная стимуляция (обзор литературы) // Проблемы репродукции. – 2002. – № 3. – С. 36-43.
19. Буров Ю.В., Ведерникова К.М. Нейрохимия и фармакология алкоголизма. – М.: Медицина, 1985. – 240 с.
20. Бэйрд Д.Т. Яичник / Гормональная регуляция размножения у млекопитающих. – М.: Мир,1987. – С. 118-144.
21. Васильева Ю.В., Макарова Т.М. Независимость некоторых форм поведения самок крыс от фаз эстрального цикла // Журн. высш. нерв. деятельности им. П.И. Павлова. – 1994. – 44, № 2. – С. 368-369.
22. Ведерникова Н.Н., Майский А.И. Опиаты и эндогенные морфиноподобные пептиды: системный подход к оценке их роли в интеграции нервной и эндокринной регуляции в организме // Усп. совр. биол. – 1981. – 19, № 3. – С. 380-382.
23. Вернигора А.Н., Бардинова Ж.С., Сметанин В.А., Генгин М.Т. Активность основных карбоксипептидаз в тканях самок крыс на разных стадиях эстрального цикла // Укр. биохим. журн. – 2003. – 75, № 5. – С. 99-102
24. Вернигора А.Н. Карбоксипептидаза Н мозга животных в норме и при действии стресс-факторов // дис. на соиск. степени канд. биол. наук. – Днепропетровск, 1991.
25. Вернигора А.Н., Генгин М.Т. Влияние эмоционально-болевого стресса и этанола на карбоксипептидазо-Н-подобную активность в гипофизе и сыворотке крови крыс // Вопр. мед. химии. – 1994. – Т. 40, № 1. – С. 54-56.
26. Вернигора А.Н., Генгин М.Т. Влияние этанола на активность карбоксипептидазы Н в гипофизе и некотрых отделах головного мозга крыс при различных стрессирующих воздействиях // Физиологический журнал им. И.М. Сеченова. – 1993. – Т. 79, № 3. – С. 34-38.
27. Вернигора А.Н., Генгин М.Т. Механизмы регуляции активности и биологическая роль карбоксипептидазы H – фермента процессинга нейропептидов // Биохимия. – 1995. – Т. 60, № 12. – С. 1491-1497.
28. Вернигора А.Н., Генгин М.Т. Основные (Отщепляющие остатки аргинина и лизина) металлокарбоксипептидазы тканей млекопитающих: структура, свойства и функции // Укр. биохим. журн. – 1998. – Т. 70, № 4. – С. 16-24.
29. Вернигора А.Н., Генгин М.Т. Протеолитические ферменты: субклеточная локализация, свойства и роль в обмене нейропептидов // Биохимия. – 1996. – Т. 61, № 5. – С. 771-785.
30. Вернигора А.Н., Генгин М.Т., Макарова В.В. Влияние стрессовых факторов на активность карбоксипептидазы Н в отделах головного мозга крыс // Укр. биохим. журн. – 1992. – Т. 64, № 2. – С. 45-49.
31. Вернигора А.Н., Генгин М.Т., Никишин Н.Н. Влияние этанола, диазепама и резерпина на активность ангиотензинпревращающего фермента и карбоксипептидазы Н в норме и при стрессе // Вопр. мед. химии. – 1996. – Т. 42, № 2. – С. 127-130.
32. Вернигора А.Н., Генгин М.Т., Никишин Н.Н. Множественность молекулярных форм растворимых карбоксипептидазо-В-подобных ферментов головного мозга кошки // Укр. биохим. журн. – 1993.– Т. 65, № 4. – С. 17-21.
33. Вернигора А.Н., Генгин М.Т., Никишин Н.Н. Об участии некоторых ферментов обмена нейропептидов в механизмах эмоционального стресса // Физиол. журн. – 1995. – Т. 81, № 5. – С. 103-112.
34. Вернигора А.Н., Генгин М.Т., Никишин Н.Н. Очистка и физико-химические свойства растворимой карбоксипептидазы Н из серого вещества головного мозга кошки // Биохимия. – 1992. – Т. 57, № 11. – С. 1712-1719.
35. Вернигора А.Н., Генгин М.Т., Салдаев Д.А., Щетинина Н.В. Распределение активности фенилметилсульфонилфторид-ингибируемой карбоксипептидазы в нервной ткани котов // Нейрохимия. – 1997. – Т. 14, № 4. – С. 423 - 425.
36. Вернигора А.Н., Михайлова О.Е., Генгин М.Т., Рыжкова Ю.А., Мухина Е.С. Влияние хронического потребления этанола на активность основных карбоксипептидаз в отделах мозга крыс // Укр. биохим. журн. – 2002. – Т. 74, № 6. – С. 128-130.
37. Вернигора А.Н., Мухина Е.С., Балыкова Н.В., Генгин М.Т. Влияние хронического потребления этанола на активность основных карбоксипептидаз в отделах мозга пренатально алкоголизированных крыс // Нейрохимия. – 2003. – Т. 20, № 1. – С. 56-59.
38. Вернигора А.Н., Никишин Н.Н., Генгин М.Т. Влияние внутрибрюшинного введения физиологического раствора на поведение крыс в тесте “открытое поле” и активность ферментов обмена нейропептидов // Физиол. журн. – 1995. – Т. 81, № 12. – С. 121-125.
39. Вернигора А.Н., Никишин Н.Н., Генгин М.Т. Влияние глюкортикоидов на активность растворимой и мембраносвязанной форм карбоксипептидазы Н in vivo // Укр. биохим. журн. – 1995. – Т. 67, № 6. – С. 93-98.
40. Вернигора А.Н., Никишин Н.Н., Генгин М.Т. Влияние этанола, диазепама и резерпина на активность ангиотензинпревращающего фермента и карбоксипептидазы H в норме и при стрессе // Вопр. мед. химии. – 1996. – Т. 42, № 2. – С.127-130.
41. Вернигора А.Н, Никишин Н.Н, Генгин М.Т. Протеолитические ферменты и регуляция уровня активности нейропептидов // Биохимия. – 1995. – Т. 60, № 10. – С.1575-1579.
42. Вернигора А.Н., Никишин Н.Н., Генгин М.Т. Частичная характеристика основной фенилметилсульфонилфторид-ингибируемой карбоксипептидазы из головного мозга кошки // Биохимия. – 1995. – Т. 60, № 11. – С. 1860-1866.
43. Вернигора А.Н., Салдаев Д.А., Генгин М.Т. Влияние внутрибрюшинной инъекции оливкового масла на активность карбоксипептидазы Н и ФМСФ-ингибируемой карбоксипептидазы в гипоталамусе, гипофизе и надпочечниках мышей // Нейрохимия. – 2001. – Т. 18, № 4. – С.290-294.
44. Вернигора А.Н., Щетинина Н.В., Генгин М.Т. Исследование активности основных (отщепляющих остатки аргинина и лизина) карбоксипептидаз у крыс разного возраста // Биохимия – 1996. – Т. 61, № 10. – С. 1848-1856.
45. Виноградова Е.П., Чаадаева Е.В. Изменение уровня тревожности у самок белых крыс в течение эстрального цикла и в зависимости от хэндлинга // Журн. высш. нервн. деят. им. И.П. Павлова. – 1994. – Т. 44, № 2. – С. 277-282.
46. Вундер П.А. О механизмах тормозного и стимулирующего влияния женского полового гормона на секрецию гонадотропинов // Успехи современной биологии. – 1992. – Т. 112, № 4. – С. 609-626.
47. Генгин М.Т. Особенности структурно-функциональной организации и физико-химические свойства нелизосомальных пептидгидролаз мозга животных//дис. на соискание ученой степени д.б.н. – Москва, 2002.
48. Генгин М.Т., Вернигора А.Н. Влияние эмоционально-болевого стресса на активность карбоксипептидазы Н - фермента процессинга нейропептидов головного мозга крыс // Физиол. журн. – 1994. – Т. 80, № 3. – С. 23-27.
49. Генгин М.Т., Вернигора А.Н. Влияние этанола на активность карбоксипептидазы Н в мозге крыс // Укр. биохим. журн.- 1993. – Т. 65, № 1. – С. 100-103.
50. Генгин М.Т., Вернигора А.Н. Ферменты процессинга опиоидных пептидов и методы определения их активности // Укр. биохим. журн. – 1994. – Т. 66, № 2. – С. 3-17.
51. Гойло Т.А., Костроминова Т.Ю., Турилова В.И., Плескач В.А. Аутокринная регуляция пролиферации в культурах клеток. I. Исследование гепаринсвязывающих факторов с ростостимулирующей активностью, содержащихся в средах, кондиционированных трансформированными фибробластами крысы // Цитология. – 1991. – Т. 33, № 1. – С. 57-63.
52. Гомазков О.А. Функциональная биохимия регуляторных пептидов.-М: Наука. 1993. – 160 с.
53. Гомазков О.А. Энзимологические основы физиологического действия регуляторных пептидов // Биол. науки. – 1986. – № 2. – С. 13-23.
54. Гомазков О.А., Григорьянц О.О. Регуляция биосинтеза энкефалинов: биохимические и физиологические аспекты // Усп. совр. биол. – 1989. – Т. 108, № 1(4). – С. 109-124.
55. Гомазков О.А., Панфилов А.Д., Комиссарова Н.В., Ростовцев А.П. Влияние длительного потребления этанола на физиологическое состояние и изменения активности пептидаз мозга у мурицидных (агрессивных) крыс // Журн. высш. нервн. деятельность. – 1992. – Т. 42, № 4. – С. 771-778.
56. Гомазков О.А., Панфилов А.Д., Ростовцев А.П., Комиссарова Н.В., Фомин В.В., Григорьянц О.О. Регионарная активность энкефалин- и ангиотензин II-образующих пептидаз мозга у крыс с различным влечением к этанолу // Вопр. мед. химии. – 1991. – Т. 37, № 4. – С. 33-37.
57. Гормонотерапия: Пер. с нем. / Под ред. Шамбаха Х., Кнаппе Г., Карола В. – М.: Медицина, 1988. – 416 с.
58. Држевецкая И.А. Основы физиологии обмена веществ и эндокринной системы. – М.: Высш. шк., 1994. – 256 с.
59. Дыбан А.П., Пучков В.Ф., Баранов В.С. // Объекты биологии развития. – М.: Наука, 1975. – С. 505-566.
60. Замятнин А.А. Общие функциональные особенности эндогенных регуляторных олигопептидов // Физиол. ж. – 1992. – Т. 78, № 9. – С. 39-49.
61. Зилов В.Г., Рогачева С.К., Иванова Л.И. Субстанция и устойчивость биологических мотиваций к этанолу // Физ. журнал. – 1992. – Т. 78, № 12. – С. 22-29.
62. Каюшева И.В. Алкоголизм и эндокринная система: (обзор) // Сов. медицина. – 1979. – № 7. – С. 87-91.
63. Келешева Л.Ф. Ренин-ангиотензиновая система в механизмах алкогольной мотивации // Вестник Российской АМН. – 1994. – № 10. – С. 40-45.
64. Кирпиченко Ан.А., Кирпиченко А.А. Алкогольная зависимость у женщин // Мед. новости. – 2002. – № 11. – С. 23-28.
65. Ковалев А.А. Это интересно: Особенности алкоголизма у женщин // Глав. Врач. – 2000. – № 5. – С.77-83.
66. Колупаев Г.П., Яковлев В.А. Гормональные нарушения при хронической интоксикации алкоголем // Журн. невропатологии и психиатрии им. Корсакова. – 1984. – Т. 84, № 11. – С.1712-1714.
67. Колупаев Г.П., Яковлев В.А. Функциональное состояние гипоталамо-гипофизарно-гонадных систем у больных с хронической алкогольной интоксикацией // Журнал невропатологии и психиатрии им. Корсакова. – 1987. – Т. 87, № 11. – С. 1723-1725.
68. Лакин Г.Ф. Биометрия. – М.: Высш. шк., 1990. – 352 с.
69. Локшина Л.А., Былинкина В.С. Протеолитические ферменты в процессинге белков // Успехи совр. биол. – 1990. – Т. 109, № 2. – С. 219-237.(19)
70. Медведев В.И., Миролюбов А.В. Проблема управления функциональным состоянием // Физиология человека. – 1984. – Т. 10, № 5. – С. 761-765.
71. Меерсон Ф.З., Пшенников М.Г. Адаптация к стресс-ситуации и физиологической нагрузке. – М.: Медицина,1988. – 25 c.
72. Нейрохимия / Под ред. Ашмарина И.П., Стукалова П.В. – М.: Изд-во Института биомед. химии РАМН, 1996. – 470 с.
73. Никитин А.И., Китаев Э.М., Слозина Н.М., Неронова Е.Г. Нарушение формирования женских гамет и пренатальная патология // Акушерство и гинекология. – 1990. – № 1. – С. 45-48.
74. Новиков Алкоголизм и гипофизарно-надпочечниковая система. – М.: “Антидор”, 2001. – 290 с.
75. Оболенская Н.Е. Некоторые особенности образования нейропептидов // Успехи совр. биол. – 1989. – Т. 108, № 3(5). – С. 337-341.
76. Панченко Л.Ф., Брусов О.С., Беляев Н.А. Исследование механизма действия этанола на активность энкефалиназы А мозга крыс // Бюллетень экспериментальной биологии и медицины. – 1984. – № 6. – С.691-692.
77. Раевский К.С. Эндогенные опиоидные пептиды как возможные нейропередатчики // Итоги науки и техники ВИНИТИ. Фармакол. химиотерапевт. средства. – 1982. – № 43. – С. 185-213.
78. Салдаев Д.А. Активность основных карбоксипептидаз в тканях мышей при введении тестостерона и прогестерона // дис. на соискание ученой степени канд. биол. наук. – СПб. , 2001.
79. Салдаев Д.А., Вернигора А.Н. Активность карбоксипептидазы Н в гипофизе и гипоталамусе самок мышей при введении тестостерона // Физиология и биомедицина, клеточная биология: Мат.IV Пущинской конф. Молодых ученых (Пущино, 1999). – Пущино, 1999. – С.13.
80. Семке В.Я., Мельникова Т.Н., Бохан Н.А. Нейробиологические механизмы алкоголизма // Журнал неврологии и психиатрии им. Корсакова. – 2002. – Т. 102, № 8. – С.61-66.
81. Скосырева А.М., Балика Ю.Д., Кочиева С.К., Рудницкая С.Я. Влияние злоупотребления алкоголем на состояние здоровья женщин и их потомства // Акушерство и гинекология. – 1993. – № 2. – С. 48-52.
82. Степанов М.Г., Секретарева Е.В., Проймина Ф.И., Савченко О.Н. Отрицательная и положительная фазы реакции гипоталамо-гипофизарно-гонадной системы самок крыс на введение половых гормонов // Физиол. журн. – 1991. – Т. 77, № 3. – С. 108-115.
83. Тигранян Р.А. Гормонально-метаболический статус организма при экстремальных воздействиях. – М.: Наука, 1990. – 228 с.
84. Физиология человека / Под ред. Косицкого Г.И. – М.: Медицина, 1985. – 544 с.
85. Хип Р., Флинт А. Беременность / Гормональная регуляция размножения у млекопитающих. – М.: Мир, 1987. – С. 193-244.
86. Хоха А.М. Угнетение этанолом биосинтеза половых гормонов и гипоталамо-гипофизарно-надпочечниковая система // Успехи современной биологии. – 1994. – Т. 114, № 5. – С. 573-580.
87. Цыганков Б.Д., Яковлев В.А. Значение исследований гипоталамо-гипофизарно-гонадной системы в изучении патогенеза и прогноза алкогольной зависимости // Профилактика и реабилитация в наркологии. – 2002. – № 1. – С .30-35.
88. Шабанов П.Д., Калишевич С.Ю. Биология алкгоголизма. – СПб.: “Лань”, 1998. – 272 с.
89. Щетинина Н.В. Активность основных карбоксипептидаз в тканях и отделах мозга крыс в онтогенезе // дис. на соиск. ученой степени кандидата биол. наук. – Спб., 1997.
90. Щетинина Н.В., Вернигора А.Н., Генгин М.Т. Активность основных карбоксипептидаз у крыс разного пола // Укр. биохим. журн. – 1997. – Т. 70, № 3. – С. 110-113.
91. Щетинина Н.В., Вернигора А.Н., Генгин М.Т., Фирстова Н.В. Тканевое и региональное распределение активности фенилметилсульфонилфторид-ингибируемой карбоксипептидазы и других карбоксипептидаз у крыс // Укр. биохим. журн. – 1997. – Т. 70, № 3. – С. 23-28.
92. Эндорфины: пер. с англ./ Под ред. Э. Коста, М. Трабукки. Перевод Панова М.А.; под ред. и с предисл. Розена В.Б. – М.: Мир, 1981. – 368с.
93. Юхананов Р.Ю., Рожанец В.В., Майский А.И. // Бюллетень эксп. биол. и мед. – 1989. – Т. 108, № 10. – С.455-457.
94. Adams M.L., Cicero T.J. Effects of alcohol on beta-endorphin and reproductive hormones in the male rat // Alcohol. Clin. Exp. Res. – 1991. – V. 15, № 4. – Р. 685-92.
95. Angelogianni P., Gianoulakis C. Chronic ethanol alters proopiomelanocortin gene expression in the rat hypothalamus // Alcohol.Clin. and Exp.Res. – 1992. – V. 16, № 2. – P. 411.
96. Azaryan A.V., Hook V.Y.H. Distinct properties of prohormone thiol protease compared to cathepsin B, cathepsin L, and cathepsin H - evidence for Ptp as a novel cysteine protease // Arch. Biochem. Biophys. – 1994. – V. 314, № 1. – P. 171-177.
97. Azaryan A.V., Hook V.Y.H. Unique cleavage specificity of prohormone thiol protease related to proenkephalin processing // FEBS Lett. – 1994. – V. 341, № 2-3. – P. 197-202.
98. Badr F.M., Smith M., Dalterio S., Bartke A. Role of pituitary and the adrenals in mediating the effects of alcohol on testicular steroidogenesis in mice. // Steroids. – 1979. – V. 34, № 4. – Р.477-482.
99. Barry R. E., McGivan J.D. Acetaldehyde alone may initiate hepatocellular damage in acute alcoholic liver disease // Gut. – 1985. – V. 26, № 10. – P. 1065-1069.
100. Baumann M.N., Rabii J. Inhibition of suckling-induced prolactin release by mu- and k-opioid antagonists // Brain Res. – 1991. – V. 567, № 2. – P. 224-230.
101. Befler R.L., Snader R.K. Premenstrual factors as determinants of alcoholism in women. In M. Greenblatt, Schucki M.A. “Alcoholism problems in women and children”, N.Y., Grune,Stratton, 1976.
102. Blum K., Briggs A.U., Elston S.F. Reduced leucine-enkephalinlike immunoreactive substance in hamster basal ganglia after long-term ethanol exposure. // Science. – 1982. - № 216. – Р.1425-1427.
103. Bondy C.A., Whitnall M.H., Brady L.S. Regulation of carboxypeptidase H gene expression in magnocellular neurons: response to osmotic stimulation // Mol. Endocrinol. – 1989. – V. 3, № 12. – P. 2086-2092.
104. Boyadjieva N., Dokur M., Advis J.P., Meadows G.G. , Sarkar D.K. Chronic ethanol inhibits NK cell Cytolytic activity: role of opioid peptide
, Sarkar D.K. Chronic ethanol inhibits NK cell Cytolytic activity: role of opioid peptide  – β-endorphin // The Journal of Immunology. – 2001, – № 167. – Р. 5645-5652.
– β-endorphin // The Journal of Immunology. – 2001, – № 167. – Р. 5645-5652.
105. Brooks A.N., Lamming G.E., Lees P.D., Haynes N.B. Opioid modulation of LH secretion in the ewe // J. Reprod. Fertil. – 1986. – V. 76, № 2. – Р. 693-708.
106. Caligioni C.S., Franci C.R. Oxytocin secretion induced by osmotic stimulation in rats during the estrous cycle and after ovariectomy and hormone replacement therapy // Life Sci. – 2002. – V. 71, № 24. – Р. 2821-2831.
107. Carter A., Soliman M.R. Estradiol alters ethanol-induced effects on beta-endorphin and met-enkephalin levels in specific brain regions of ovariectomized rats // Pharmacology. – 1996. – V. 53, № 3. – Р.143-150.
108. Chapin R.E., Breese G.R., Mueller R.A. Possible mechanisms of reduction of plasma luteinizing hormone by ethanol // J. Pharmacol. Exp. Ther. – 1980. – V. 212, № 1. – Р. 6-10.
109. Charnning C.P., Andersen L.D., Hoover D.J. Hormonal control of granulosa cell secretion of oocyte maturation inhibitor and inhibin-F activity // Follicular maturation and ovulation: Exp. Med. Intern. Congr. Amsterdam. – 1982. – P. 219-236.
110. Cheng S.S., Tseng L.F. Chronic administration of ethanol on pituitary and hipotalamic β-endorphin in rats and golden hamsters // Pharmacol. Res. Commun. – 1982. – V. 14, № 10. – Р. 1001-1008.
111. Chesselet M.F., Hook V.Y.H. Carboxypeptidase H-like immunoreactivity in the striatum of cats and monkeys // Regul. Pept. – 1988.- V. 20, № 2. – P. 151-159.
112. Chin J., Goldstein D. Effects of low concentrations of ethanol on the fluidity of spin-labeled erythrocyte and brain membranes // Mol. Pharmacol. – 1977. – № 13. – Р. 435-441.
113. Chisari A.., Carino M., Perone M., Gaillard R.C., Spinedi E. Sex and strain variability in the rat hypothalamo-pituitary-adrenal axis function // J. Endocrinol. Invest. – 1995. – V. 18, № 1. – P. 25-33.
114. Chretien M., Seidah N.G. Precursor polyproteins in endocrine and neuroendocrine systems // Int. J. Peptide Protein Res. – 1984. – № 23. – P. 335-341.
115. Cicero T.Y., Bernard Y.D., Newman K. Effects of castration and chronic morphine administration on liver alcohol dehidrogenase and the metabolism of ethanol in the male, Spraque-Dawley rat // J. Pharmacol. exp. ther. – 1980. - № 215. – Р. 317-324.
116. Cicero T.J., Bernstein D., Badger T.M. Effects of acute alcohol administration on reproductive endocrinology in the male rat // Alcohol. Clin. Exp. Res. – 1978. – V. 2, № 3. – Р. 249-254.
117. Cicero T.J., Meyer E.R., Bell R.D. Effects of ethanol on the hypothalamic-pituitary-luteinizing hormone axis and testicular steroidogenesis // J. Pharmacol. Exp. Ther. – 1979. – V. 208, № 2. - 210-215.
118. Cool D.R., Loh Y.P. Carboxypeptidase E is a sorting receptor for prohormones – binding and kinetic studies // Mol. Cell. Endocrinol. – 1998. – V. 139, № 1-2. – P. 7-13.
119. Cool D.R., Normant E., Shen F.S., Chen H.C., Pannell L., Zhang Y., Loh Y.P. Carboxypeptidase E is a regulated secretory pathway sorting receptor: genetic obliteration leads to endocrine disorders in Cpe(Fat) mice // Cell. – 1997. – V. 88, № 1. – P. 73-83.
120. Crews F., Morrow A.L., Criswell H., Breese G. Effects of ethanol on ion channels // Int.Rev.Neurobiol. – 1996. – №39. – Р. 283-367.
121. Daud A.I., Bumpus F.M., Husain A. Characterization of angiotensin I-converting enzyme (ACE)-containing follicles in the rat ovary during the estrous cycle and effects of ACE inhibitor on ovulation // Endocrinology. – 1990. – 126, № 6. – Р. 2927-2935.
122. Davidson H.W., Hutton J.C. The insulin-secretory-granule carboxypeptidase H. Purification and demonstration of involvement in proinsulin processing // J. Biochem. – 1987. – V. 245, № 2. – P. 575-582.
123. Deddish P.A., Skidgel R.A., Kriho V.B., Li X.Y., Becker R.P., Erdos E.G. Carboxypeptidase M in Madin-Darby canine kidney cells. Evidence that carboxypeptidase M has a phosphatidylinositol glycan anchor // J. Biol. Chem. – 1990. – V. 265, № 25. – P. 15083-15089.
124. De Gandarias J.M., Echevarria E., Irazusta J., Casis L. Cyclic changes of exopeptidase activities in the rat brain: a regional study // Exp Clin Endocrinol. – 1992. – V. 99, № 2. – Р. 64-67.
125. De Gandarias J.M.; Irazusta-J.; Echevarria-E.; Casis-L. Neutral aminopeptidase activity levels during the estrous cycle and the pregnancy in the hypothalamus and the pituitary of the rat // Life Sci. – 1993. – V. 52, № 20. – Р. 1629-1632.
126. De Gandarias J.M., Irazusta J., Gil J., Fernandez D., Casis L. Brain soluble and membrane-bound Tyr-aminopeptidase activities during the stages of estrous and proestrous in the female rat // Brain Res. – 1993. – V. 620, № 1. – Р. 146-148.
127. De Gandarias J.M., Irazusta J., Fernandez D., Echevarria E. Casis L. Brain Lys-Aminopeptidase Activity - Changes During Cycle and Pregnancy // European journal of endocrinology. – 1994. – V. 130, № 4. – Р. 373-377.
128. De Gandarias J.M., Ramirez M., Echevarria E., Irazusta J., Casis L. Serum and brain aminopeptidase activities in cyclic rat //. Gen. Physiol. Biophys. – 1990. – V. 9, № 4. – Р.385-389.
129. De Gandarias J.M., Ramirez M., Zulaica J., Casis L. Aminopeptidase (arylamidase) activity in discrete areas of the rat brain: sex differences // Horm. Metab. Res. – 1989. – V. 5, № 21. – P. 285-286.
130. De Vito E., Guardia D.C., Cabrera R.R. Cyclical changes in plasma renin during the oestrous cycle in the rat: synchronized effect of oestrogen and progesterone // J. Endocrinol. – 1989. – V. 121, № 2. – Р. 261-267.
131. Devi L. Tissue distribution of a dynorphin-processing endopeptidase // Endocrinology. – 1993. – V. 132, № 3. – P. 1139-1144.
132. Dies-Guerra F.J., Bicknell R.J., Mansfield S. Effect of neonatal testosterone upon opioid receptors and the content of beta-endorphin, neuropeptide Y and neorotensin in the medialbasal areas in the rat brain // Brain Res. – 1987. – V. 44, № 2. – P. 225-230.
133. Dochetry K., Hutton J.C. Carboxypeptidase activity in the insulin secretory granule // FEBS Lett. – 1983. – V. 162, № 1. – P. 137-141.
134. Eipper B.A., Green C.B., Mains R.E. Expression of prohormone processing enzymes in neuroendocrine and non-neuroendocrine cells // Monogr. Natl. Cancer. Inst. – 1992. - № 13. – P. 163-168.
135. Ellingboe J. Acute effects of ethanol on sex hormones in non-alcoholic men and women // Alcohol. – 1987. - № 1. – Р. 109-116.
136. Ehlers C.L., Li T.K., Lumeng L. Neuropeptide Y (NPY) levels in ethanol-naive alcohol preffering and nonpreferring rats in Wistar rats following ethanol exposure // Alcohol Clin. Exp. Res. – 1998. - № 22. – Р. 1778-1782.
137. Ehlers C.L., Somes C., Clontier D. Are some of the effects of ethanol mediated through NPY? // Pscychopharmacology. –1998. – № 139. – P. 136-144.
138. Fernandez-Pardal J., Chaud M., Viggiano M., Gimeno M.F., Gimeno A. L. Converting enzyme activity in sow oviducts at different stages of the sex cycle. Influence of inhibitors of prostaglandin synthesis and its possible role in the inotropic effects of bradykinin // Pharmacol. Res. Commun. – 1986. – V. 18, № 1. – Р. 49-60.
139. Ferriero D.M., Sheldon R.A., Messing R.O. Somatostatin enhances nerve growth factor induced neurite outgrowth in PC12 cells // Dev. Brain Res. – 1994. – V. 80, № 1-2. – P. 13-18.
140. Fiedorek F.T.Jr., Parkinson D. Carboxypeptidase H processing and secretion in rat clonal beta-cell lines // Endocrinology. – 1992. – V. 131, № 3. – P. 1054-1062.
141. Figueroa C.D., Chacon C., Corthorn J., Ehrenfeld P., Muller-Esterl W., Valdes G. Temporospatial changes of kinin b2 receptors during the estrous cycle and pregnancy in the rat uterus // Pharmacol. Res. Commun. – 1986. – 18, № 1. – Р. 49-60.
142. Frette C., Pezet S., Nabout R.A., Bertrand J.P., Pham Q.T., Kauffmann F., Lafuma C. Relationship of serum neutral endopeptidase E.C.3.4.24.11 activity to alcohol consumption // Alcohol. Clin. Exp. Res. – 1998. – V. 22, № 7. – Р. 1405-1408.
143. Fricker L.D. Activation and membrane binding of carboxypeptidase E // J. Cell. Biochem. – 1988. – № 38. – P. 279-289.
144. Fricker L.D. Carboxypeptidase E // Ann. Rev. Physiol. – 1988. – № 50. – P. 309-321.
145. Fricker L.D. Neuropeptide biosynthesis: focus on carboxypeptidase processing enzyme // Trends Neurosci. – 1985. – V. 8, № 5. – P. 210-214.
146. Fricker L.D., Das B., Angeletti R.H. Identification of the pH-dependent membrane anchor of carboxypeptidase E (EC 3.4.17.10) // J. Biol. Chem. – 1990. – V. 265, № 5. – P. 2476-2482.
147. Fricker L.D., Das B., Klein R.S., Greene D., Jung Y.K. Regulation of carboxypeptidase E (enkephalin convertase) // NIDA Res. Monogr. – 1991. – № 111. – P. 171-187.
148. Fricker L.D., Devi L. Posttranslational processing of carboxypeptidase E, a neuropeptide processing enzyme, in AtT 20 cells and bovine pituitary secretory granules // J. Neurochem. – 1993. – V. 61, № 4. – P. 1404-1415.
149. Fricker L.D., Plummer T.H., Snyder S.H. Enkephalin convertase: potent, selective and irreversible inhibitors // Biochem. and Biophys. Res. Commun. – 1983. – V. 11, № 3. – P. 994-1000.
150. Fricker L.D., Reaves B.J., Das B., Dannies P.S. Comparison of the regulation of carboxypeptidase E and prolactin in GH4C1 cells, a rat pituitary cell line. // Neuroendocrinology. – 1990. – V. 51, № 6. – P. 658-663.
151. Fricker L.D., Rigual R.J., Diliberto E.J.Jr., Viveros O.H. Reflex splanchnic nerve stimulation increases levels of carboxypeptidase E mRNA and enzymatic activity in the rat adrenal medulla // J. Neurochem. – 1990. – V. 55, № 2. – P. 461-467.
152. Fricker L.D., Snyder S.H. Enkephalin convertase: purification and charasterization of a specific enkephalin-synthesizing carboxypeptidase localized to adrenall chromaffin granules // Proc. Natl. Acad. Sci. USA. – 1982. – № 79. – P. 3886-3890.
153. Fricker L.D., Snyder S.H. Purification and characterization of enkephalin convertase, an enkephaline-synthesizing carboxypeptidase // J. Biol. Chem. – 1983. – V. 258, № 18.- P. 10950-10955.
154. Fricker L.D., Supattapone S., Snyder S.H. Enkephalin convertase: a specific enkephalin synthesizing carboxypeptidase in adrenal chromaffin granules, brain and pituitary gland // Life Sci. – 1982. – V. 31. – P. 1841-1844.
155. Funabashi T., Brooks P.J., Kleopoulos S.P., Grandison L., Mobbs C.V., Pfaff D.W. Changes in preproenkephalin messenger RNA level in the rat ventromedial hypothalamus during the estrous cycle // Brain. Res. Mol. Brain Res. – 1995. – V. 28, № 1. – Р. 129-134.
156. Gainer H., Russel J.T., Loh Y.P. The enzymology and intracellular organization of peptide precursor processing: The secretory vesicle hypothesis // Neuroendocrinology – 1985. – № 40. – P. 171-184.
157. Genazzani A.R., Faechinetti F., Petraglia F., Pintor C., Bagnoli F., Puggioni R., Corda R. Correlations between plasma levels of opioid peptides and adrenal androgens in prepuberty and puberty // J. Steroid. Biochem. – 1983. – V. 19, № 1. – P. 891-895.
158. Gianoulakis C. The effect of ethanol on the biosynthesis and regulation of opiod peptides // Experentia. – 1989. –V. 45, № 5. – P. 428-435.
159. Gianoulakis C., Barcomb A. Effect of acute ethanol in vivo and in vitro on the β-endorphin system in the rat // Life Sci. – 1987. – V. 40, № 1. – P. 19-28.
160. Guest P.C., Pipeleers D., Rossier J., Rhodes C.J., Hutton J.C. Co-secretion of carboxypeptidase H and insulin from isolated rat islets of Langerhans // J. Biochem. – 1989. – V. 264, № 2. – P. 503-508.
161. Guest P.C., Ravazzola M., Davidson H.W., Orci L., Hutton J.C. Molecular heterogeneity and cellular localization of carboxypeptidase H in the islets of Langerhans // Endocrinology. – 1991. – V. 129, № 2. – P. 734-740.
162. Hammer R.P. Jr. Mu-opiate receptor binding in the medial preoptic area is cyclical and sexually dimorphic // Brain Res. – 1990. – V. 515, № 1-2. – Р. 187-192.
163. Hammer R.P. Jr., Zhou L., Cheung S. Gonadal steroid hormones and hypothalamic opioid circuitry // Horm. Behav. – 1994. – V. 28, № 4. – Р.431-437.
164. Harmar A.J. Neuropeptides // Transmitter Molecules in the Brain. – 1987. – № 1. – P. 17-26.
165. Ho K.S., Rossi N. Suppression of ethanol consumption by metenkephalin in rats // J. Pharm. Pharmacol. – 1982. – V. 34, № 2. – Р .118-119.
166. Hollt V. Multiple endogenous opioid peptide // Trend. Neurosci. – 1983, – V. 6, № 1. – Р.24-26.
167. Hook V.Y. Carboxypeptidase B-like activity for the processing of enkephalin precursors in the membrane component of bovine adrenomedullary chromaffin granules // Neuropeptides. – 1984. – V. 4, № 2. – P. 117-126.
168. Hook V.Y.H., Affolter H.U. Identification of zymogen and mature forms of human carboxypeptidase H. A processing enzyme for the synthesis of peptide hormones // FEBS Lett. – 1988. – V. 238, № 2. – P. 338-342.
169. Hook V.Y.H., Affolter H.U., Palkovits M. Carboxypeptidase H in the hypothalamo-neurohypophysal system: evidence for processing of a prohormone-processing enzyme during axonal transport // J. Neurosci. – 1990. – V. 10, № 10. P. 3219-3226.
170. Hook V.Y.H., Eiden L.E., Pruss R.M. Selective regulation of carboxypeptidase peptide hormone-processing enzyme during enkephalin biosynthesis in cultured bovine adrenomedullary chromaffin cells // J. Biol. Chem. – 1985. – V. 260, № 10. – P. 5991-5997.
171. Hook V.Y.H., Eiden L.E. (Met)-enkephalin and carboxypeptidase processing enzyme are co-released from chromaffin cells by cholinergic stimulation // Biochem. Biophys. Res. Commun. – 1985. – №128. – P. 563-570.
172. Hook V.Y., Loh Y.P. Carboxypeptidase B-like convertasing enzyme activity in secretory granules of rat pituitary // Cell Biol. – 1984. – № 81. – P. 2776-2780.
173. Hwang B.H., Zhang J.K., Ehlers C.L. Innate differences of neuropeptide Y in hypotalamic nuclei and central nucleus of the amigdala between selectively bred rats with high and low alcohol preference // Alcohol Clin. Exp. Res. – 1999. – V. 23, № 6. – Р. 1023-1030.
174. Jin D.F., Muffly K.E., Okulicz W.C., Kilpatrick D.L. Estrous cycle- and pregnancy-related differences in expression of the proenkephalin and proopiomelanocortin genes in the ovary and uterus // Endocrinology. – 1988. – V. 122, № 4. – Р. 1466-1471.
175. Johansson G.B., Skidgel R.A. Carboxypeptidase M converts epidermal growthfactor to Des-Arg53-EGF // FASEB J. – 1994. – V. 8, № 5. – P. 930.
176. Joshi D., Billiar R.B., Miller M.M. Modulation of hypothalamic mu-opioid receptor density by estrogen: a quantitative autoradiographic study of the female C57BL/6J mouse // Brain Res. Bull. – 1993. – V. 30, № 5-6. – Р .629-634.
177. Jung Y.K., Kunczt C.J., Pearson R.K., Fricker L.D., Dixon J.E. Expression of the rat carboxypeptidase-E gene in neuroendocrine and nonneuroendocrine cell lines // Mol. Endocrinol. – 1992. – V. 6, № 12. – P. 2027-2037.
178. Kaminski J., Kozuchowski J., Malinowska L. The activity of cathepsin A and cathepsin D in the serum of persons acutely intoxicated with ethanol and chronic alcoholics // Rocz. Akad. Med. Bialymst. – 1995. – V. 40, № 1. – Р. 209-212.
179. Ogilvie К.М., Rivier С. Effect of Alcohol on the Proestrous Surge of Luteinizing Hormone and the Activation of LH-Releasing Hormone Neurons in the Female Rat // Society for Neuroscience. – 1997. – V. 17, № 7. – Р. 2595-2604.
180. Kenney W. C. Formation of Schiff base adduct between acetaldehyde and rat liver microsomal phosphatidylethanolamine. // Alcohol. Clin. Exp. Res. – 1984. – V. 8, № 6. – P. 551-555.
181. Khanna A.S., Waisman D.M. Metabolism and intracellular processing of protein hormones // Hormon. Act. - 1988. – № 1. – P. 117-132.
182. Klein R.S., Das B., Fricker L.D. Secretion of carboxypeptidase E from cultured astrocytes and from AtT-20 cells, a neuroendocrine cell line: implications for neuropeptide biosynthesis // J. Neurochem. – 1992. – V. 58, № 6. – P. 2011-2018.
183. Klein R.S., Fricker, L.D. Differental effects of a phorbol ester on carboxypeptidase E in cultured astrocytes and AtT-20 cells, a neuroendocrine cell line // J. Neurochem. – 1993. – V. 60, № 5.- P. 1615-1625.
184. Kimura A, Takahashi T. cDNA cloning of rat prolyl oligopeptidase and its expression in the ovary during the estrous cycle // J. Exp. Zool. – 2000. – V. 286, № 6. – Р. 656-665.
185. Knox R.V., Vatzias G., Naber C.H., Zimmerman D.R. Plasma gonadotropins and ovarian hormones during the estrous cycle in high compared to low ovulation rate gilts // J. Anim. Sci. – 2003. – V. 81, № 1. – Р. 249-260.
186. Kopelman M.D. The Korsakoff syndrome // Brit. J. Psychiatry. – 1995. – V. 166, № 2. – Р. 154-173.
187. Kuhl H., Rosniatowski C., Taubert H.D. Effect of sex hormones on LН-RH-degrading hypothalamic enzyme system during estrus cycle in rats // Endocrinol. Exp. – 1979. – V. 13, № 1. – Р. 29-38.
188. Laslop A., Tschernitz C. Effects of nerve growth factor on the biosynthesis of chromogranin A and B, secretogranin II and carboxypeptidase H in rat PC12 cells // Neuroscience. – 1992. – V. 49, № 2. – P. 443-450.
189. Leppaluoto J., Rapeli M., Varis R., Ranta T. Secretion of anterior pituitary hormones in man: effects of ethyl alcohol // Acta Physiol. Scand. – 1975. – V. 95, № 4. – 400-406.
190. Lew R.A., Cowley M., Clarke I.J., Smith A.I. Peptidases that degrade gonadotropin-releasing hormone: influence on LH secretion in the ewe // J. Neuroendocrinol. – 1997. – V. 9, № 9. – Р. 707-712.
191. Li X.F., Ahmed A. Compartmentalization and cyclic variation of immunoreactivity of renin and angiotensin converting enzyme in human endometrium throughout the menstrual cycle // Hum. Reprod. – 1997. – V. 12, № 12. – Р. 2804-2809.
192. Lipperheide C., Otto K. Improved purification and some properties of bovine lysosomal carboxypeptidase B // Biochim. Biophys. Acta. – 1986. – V. 880, № 2-3. – P. 171-178.
193. Loh Y.P., Birch N.P., Castro M.G. Pro-opiomelanocortin and pro-vasopressin converting enzyme in pituitary secretory vesicles // Biochimie. – 1988 . – V. 70, № 1. – P. 11-16.
194. Loh Y.P., Parish D.C., Tuteja R. Purification and charasterization of a paired basic residue-specific pro-opiomelanocortin converting enzyme from bovine pituitary intermediate lobe secretory vesicles // J. Biol. Chem. – 1985. – V. 260, № 12. – P. 7194-7205.
195. Lowry O.H., Rosebrought N.J., Farr A.G., Randall R.J. Protein measurement with Folin phenol reagent // J. Biol. Chem. – 1951. – V. 193, № 1. – P. 265-275.
196. Lynch D.R., Braas K.M., Hutton J.C., Snyder S.H. Carboxypeptidase E: immunocytochemical localization in the rat central nervous system and pituitary gland // J. Neurosci. – 1990. – V. 10, № 5. – P. 1592-1599.
197. Lynch D.R., Venable J.C., Snyder S.H. Enkephalin convertase in the heart: similar disposition to atrial natriuretic factor // Endocrinology. – V. 122, № 6. – P. 2683-2691.
198. Lynch D.R., Venable J.C., Strittmatter S.M., Snyder S.H. Enkephalin convertase: charasterization and localization using [3H] guanidinoethylmercaptosuccinic acid // Biochimie. – 1988. – V. 70, № 1. – P. 57-64.
199. Lyon R., Goldstein D. Changes in synaptic membrane order associated with chronic ethanol treatment in mice // Molec. Pharmacol. – 1982. - № 23. – Р.86-91.
200. Mahata S.K., Mahata M., Steiner H.J., Fischer-Colbrie R., Winkler H. In situ hybridization: mRNA levels of secretogranin II, neuropeptides and carboxypeptidase H in brains of salt-loaded and Brattleboro rats // Neurosci. – 1992. – V.48, № 3. – P. 669-680.
201. Mains R.E., Eipper B.A. Secretion and regulation of two biosyntetic enzyme activities, peptidyl-glycine a-amidating monooxygenase and a carboxypeptidase, by mouse pituitary corticotropic tumor cells // Endocrinology. – 1984. – V. 115, № 5. – P. 1683-1690.
202. Mateo A.R., Hijazi M., Hammer R.P. Jr. Dynamic patterns of medial preoptic mu-opiate receptor regulation by gonadal steroid hormones // Neuroendocrinology. – 1992. – V. 55, № 1. – С.51-58.
203. Matsumoto-H., Mori T. Changes in сystine aminopeptidase (oxytocinase) activity in mouse serum, placenta, uterus and liver during pregnancy or after steroid-hormone treatments // Zoological Science. – 1998, - V. 15, № 1. – Р. 111-115.
204. Matsuzaki H., Ueno H., Hayashi R., Liao T.H. Bovine spleen cathepsin A – characterization and comparison with the protective protein // J. Biochem. – 1998. –V. 123, № 4. – P. 701-706.
205. Mayas M.D., Ramirez-Exposito M.J., Garcia M.J., Ramirez M., Martinez-Martos J.M. Influence of alcohol on brain aminopeptidases. An in vitro study // Rev Neurol. – 2001. – V. 32, № 11. – Р. 1031-1040.
206. Mello N.K., Mendelson J.H., Bree M.P., Skupny A.S. Alcohol effects on luteinizing hormone-releasing hormone-stimulated luteinizing hormone and follicle-stimulating hormone in female rhesus monkeys // J. Pharmacol. Exp. Ther. – 1986. – V. 236, № 3. – Р. 590-595.
207. Mendelson J. Н., Mello N. К., Ellingboe J. Effects of acute alcohol intake on pituitary-gonadal hormones in normal human males // J. Pharmacol. Exp. Ther. – 1977. – V. 202, № 3. – Р. 676-682.
208. Mendelson J.H., Mello N.K., Teoh S.K., Ellingboe J. Alcohol effects on luteinizing hormone releasing hormone-stimulated anterior pituitary and gonadal hormones in women // J. Pharmacol. Exp. Ther. – 1989. – V. 250, № 3. – Р. 902-909.
209. Mitra A., Song L.X., Fricker L.D. The C-terminal region of carboxypeptidase E is involved in membrane-binding and intracellular routing in Att-20 cells // J. Biol. Chem. – 1994. – V. 269, № 31. – P. 19876-19881.
210. Morley J.E. Neuropeptide, behavior and aging // Ger. Biosci. – 1986. – V. 34, № 1. - P. 52-62.
211. Muffly K.E., Jin D.F., Okulicz W.C., Kilpatrick D.L. Gonadal steroids regulate proenkephalin gene expression in a tissue-specific manner within the female reproductive system // Mol. Endocrinol. – 1988. – V. 2, № 10. – Р. 979-985.
212. Nagae A., Deddish P.A., Becker R.P., Anderson C.H., Abe M., Tan F., Skidgel R.A., Erdos E.G. Carboxypeptidase M in brain and peripheral nerves // J. Neurochem. – 1992. – V. 59, № 6. – P. 2201-2212.
213. Nalamachu S.R., Song L.X., Fricker L.D. Regulation of carboxypeptidase E - effect of Ca2+ on enzyme-activity and stability // J. Biol. Chem. – 1994. – V. 269, № 15. – P. 11192-11195.
214. Norenberg U., Richter D. Processing of the oxytocin precursor: isolation of an exopeptidase from neurosecretory granules of bovine pituitaries // Biochem. Biophys. Res. Commun. – 1988. – V. 156, № 2. – P. 898-904.
215. Normant E., Loh Y.P. Carboxypeptidase E acts as a sorting receptor for routing proinsulin and proenkephalin but not chromogranin A to the regulated secretory pathway // FASEB Journal. – 1997. – V. 11, № 9. – P. 431.
216. O’Conner J.L., Lapp C.A., Mahesh V.B. Peptidase activity in the hypothalamus and pituitary of the rat: fluctuations and possible regulatory role of luteinizing hormone releasing hormone-degrading activity during the estrous cycle // Biol. Reprod. – 1984. – V. 30, № 4. – Р. 855-862.
217. Ogilvie K.M., Rivier C. Gender difference in alcohol-evoked hypothalamic-pituitary-adrenal activity in the rat: ontogeny and role of neonatal steroids // Alcohol. Clin. Exp. Res. – 1996. – V. 20, № 2. – Р. 255-261.
218. Orskov C., Buhl T., Rabenhoj L., Kofod H., Holst J.J. Carboxypeptidase-B-like processing of the C-terminus of glucagon-like peptide-2 in pig and human small intestine // FEBS Lett. – 1989. – V. 247, № 2. – P. 193-196.
219. Ostrowski N.L., Hill J.M., Pert C.B., Pert A. Autoradiographic visualization of sex differences in the pattern and density of opiate receptors in hamster hypothalamus // Brain. Res. – 1987. – V. 421, № 1-2. – Р.1-13.
220. Parkinson D. Two soluble forms of bovine carboxypeptidase H have different NH2-terminal sequences // J. Biol. Chem. – 1990. – V. 265, № 28. – P. 17101-17105.
221. Parkinson D. Carboxypeptidase H in bovine pituitary gland: soluble forms are not processed at the C-terminus // Mol. Cell. Endocrinol. – 1992. – V. 86, № 3. – P. 221-233.
222. Patel V.A., Pohoresky L.A. Acute and chronic ethanol treatment on β-endorphin and catecholamin levels // Alcohol. – 1989. – V. 6, №1. – Р. 59-63.
223. Porcelli G., Raffaelli R., Sacchi A., Volpe A.R., Miani C. Localization and characterization of human salivary kininases // Agents Actions Suppl. – 1992. – V. 38, № 1. – P. 401-406.
224. Potargowicz E., Traczyk W.Z. Role substance P in central control of ovulation in female rats // Endocrine regulations. – 1999. - № 33. – Р. 161-167.
225. Prieto I., Arechaga G., Ramirez-Exposito M.J., De Gasparo M., Martinez-Martos J.M., Ramirez M. Aminopeptidases in the gonads of male and female rats // Fertil. Steril. – 2002. – V. 77, № 4. – Р. 802-804.
226. Proteinases in Mammalian Cells and Tissues / Barrett A.J. (ed.). – Amsterdam: Elsevier/North Holland Biomedical Press, 1977.
227. Redei E., Brunch B.J., Gholami S., Lin Y.R., Taylor A.N. Effects of ethanol on CRF-release in vitro // Endocrinology. – 1988. – V. 123, № 6. – Р. 2736-2743.
228. Redei E., Brunch J.B., Taylor A.N. Direct effect of ethanol on adrenocorticotropin (ACTH) release in vitro // J. Pharmac. Exp. Ther. – 1986. – № 237. – Р. 59-64.
229. Rettori V., Skelley C.W., McCann S.M., Dees W.L. Detrimental effects of short-term ethanol exposure on reproductive function in the female rat // Biol. Reprod. – 1987. – V. 37, № 5. – Р.1089-1096.
230. Rivier C. Female rats release more corticosterone than males in response to alcohol: influence of circulating sex steroids and possible consequences for blood alcohol levels // Alcohol Clin. Exp. Res. – 1993. – V. 17, № 4. – Р. 854-859.
231. Rivier C., Rivest S., Vale W. Alcohol-induced inhibition of LH secretion in intact and gonadectomized male and female rats: possible mechanisms // Alcohol Clin. Exp. Res. – 1992. – V. 16, № 5. – Р. 935-941.
232. Rosman P.M., Farag A., Benn R., Tito J., Mishik A., Wallace E.Z. Modulation of pituitary-adrenocortical function: decreased secretory episodes and blunted circadian rhythmicity in patients with alcoholic liver disease // J. Clin. Endocrinol. Metab. – 1982. – V. 55, № 4. – Р. 709-717.
233. Roth W.W., Mackin R.B., Spiess J., Goodman R.H., Noe B.D. Primary structure and tissue distribution of angelerfish carboxypeptidase H // Mol. Cell Endocrinol. – 1991. – V. 78, № .3. – P.171-178.
234. Rouille Y., Chauvet J., Acher R. Partial conversion of vasopressinyl-Gly-Lys-Arg into pharmacologically active vasopressin through secretory granule carboxypeptidase E and alpha-amidating processing enzymes // Biochem. Int. – 1992. – 26, № 4. – P.739-746.
235. Rubattu S., Quimby F.W., Sealey J.E. Tissue renin and prorenin increase in female cats during the reproductive cycle without commensurate changes in plasma, amniotic or ovarian follicular fluid. // J. Hypertens. – 1991. – V. 9, № 6. – Р. 525-535.
236. Ryder S., Straus E., Lieber C.S., Yalow R.S. Cyolecystocinin and enkephalin levels following ethanol administration in rats // Peptides. – 1981. - № 2. – Р.223-226.
237. Saito T., Lee J.M., Tabacoff B. Ethanol’s effects on cortical adenilate cyclase activity // J. Neurochem. – 1985. – № 44. - Р. 1037-1044.
238. Salonen I., Huhtaniemi I. Effects of chronic ethanol diet on pituitary-testicular function of the rat // Biology of Reproduction. – 1990. - № 42 – Р. 55-62.
239. Schauser K.H., Nielsen A.H., Dantzer V., Poulsen K. Angiotensin-converting enzyme activity in the bovine uteroplacental unit changes in relation to the cycle and pregnancy // Placenta. – 2001. – V. 22, № 10. – Р. 852-862.
240. Schauser K.H., Nielsen A.H., Winther H., Dantzer V., Poulsen K. Localization of the renin-angiotensin system in the bovine ovary: cyclic variation of the angiotensin II receptor expression // Biol. Reprod. – 2001. – V. 65, № 6. – Р. 1672-1680.
241. Schulz R., Wuster M., Duka D., Herz A. Acute and chronic ethanol treatment changes endorphine levels in brain and pituitary. – Psychopharmacologia (Berl.), 1980. – P. 221-227.
242. Seidah N.G., Chretien M. Proprotein and prohormone convertases of the subtilisin family – recent developments and future perspectives // Trends Endocrinol. Met. – 1992. – 3, № 4. – P. 133-140.
243. Seizinger B. R., Bovermann K., Maysinger D. Differential effects of acute and chronic ethanol treatment on particular opioid peptide systems in discrete regions of rat brain and pituitary // Pharmacol. Biochem. Behav. – 1983, – V.18, № 1. – Р. 1-9.
244. Shen F.S., Loh Y.P. Intracellular Misrouting and Abnormal Secretion of Adrenocorticotropin and Growth Hormone in Cpe (Fat) Mice Associated with a Carboxypeptidase E Mutation // Proc. Nat. Acad. Sci. USA. – 1997. – V. 94, № 10. – P. 5314-5319.
245. Shimamori Y., Kumagai Y., Watanabe Y., Fujimoto Y. Human placental carboxypeptidase M is anchored by a glycosyl-phosphatidylinositol moiety // Biochem. Int. – 1990. – V. 20, № 3. – P. 607-613.
246. Simerly R.B., Young B.J., Carr A.M. Co-expression of steroid hormone receptors in opioid peptide-containing neurons correlates with patterns of gene expression during the estrous cycle // Brain Res. Mol. Brain Res. – 1996. – V. 40, № 2. – Р. 275-284.
247. Simpson K.B., May D. Some effects of the oestric cicly in the female rats // J.of the Institute of Animal Technicions. – 1973. - № 24. - Р. 25.
248. Skidgel R.A., Davis R.M., Tan F. Human carboxypeptidase M. Purification and characterization of a membrane-bound carboxypeptidase that cleaves peptide hormones // J. Biol. Chem.– 1989.– V. 264, № 4.– P. 2236-2241.
249. Skidgel R.A., Erdos E.G. Cellular carboxypeptidases // Immunol. Rev. – 1998. – V. 161, № 2. – P. 129-141.
250. Skidgel R.A., McGwire G.B., Li X.Y. Membrane anchoring and release of carboxypeptidase M: implications for extracellular hydrolysis of peptide hormones // Immunopharmacology. – 1996. – V. 32, № 1-3. – Р. 48-52.
251. Skidgel R.A., Tan F.L., Deddish P.A., Li X.Y. Structure, function and membrane anchoring of carboxypeptidase M // Biomed. Biochim. Acta. – 1991. – V. 50, № 4-6. – P. 815-820.
252. Slamecki C.J., Somes C., Ehlers C.L. Effects of chronic ethanol exposure on neurophysiological responses to corticotropinreleasing factor and neuropeptide Y // Alcohol and Alcoholism. – 1999. - № 34. – Р. 289-299.
253. Smith D.R., Pallen C.J., Murphy D., Lim L. Pituitary-specific transcriptional initiation sites of the rat carboxypeptidase-H gene and the influence of thyroid hormone status // Mol. Endocrinol. – 1992. – V. 6, № 5. – P. 713-722.
254. Smyth D.G., Maruthainar K., Darby N.J., Fricker L.D. Catalysis of slow C terminal processing reactions by carboxypeptidase H // J. Neurochem. – 1989. – V. 53, № 2. – P. 489-493.
255. Song L., Fricker L.D. Calcium- and pH-dependent aggregation of carboxypeptidase E // J. Biol. Chem. – 1995. – 270, № 14. – P. 7963-7967.
256. Steiner D.F. The biosynthesis of biologically active peptides: a perspective // Peptide Biosynthesis and Processing (Fricker L.D., ed.).- CRC Press, Boca Raton, Florida, 1991. – P. 1-16.
257. Suda M., Nakao K., Sakamoto M., Morii N., Sugawara A., Imura H. Changes in the immunoreactivities of an opioid peptide leumorphin in the hypothalamus and anterior pituitary during the estrous cycle of the rat and their relation to sexual behavior // Brain Res. – 1986. – V. 374, № 2. – Р. 236-243.
258. Supattapone S., Fricker L.D., Snyder S.H. Purification and characterization of membrane-bound enkephalin-forming carboxypeptidase, “enkephalin convertase” // J. Neurochem. – 1984. – V. 42, № 4.- P. 1017-1023.
259. Tabakoff B., Hoffman P.L. Biochemical pharmacology of alcohol // Psychopharmacology: The third generation of progress/Ed. By H.Y. Meltzer. New.York: Raven Press. – 1987. – Р.1521-1526.
260. Tan F., Chan S.J., Steiner D.F., Schilling J.W., Skidgel R.A. Molecular cloning and sequencing of the cDNA for human membrane-bound carboxypeptidase M. Comparison with carboxypeptidases A, B, H, and N // J. Biol. Chem. – 1989. – V. 264, № 22. – P. 13165-13170.
261. Thiagarajan A.B., Mefford I.N., Eskay R.L. Single dose ethanol administration activities the hypotalamus-pituitary-adrenal axis:exploration of the mechanism of action // Neuroendocrinology. – 1989. – V. 50, № 4. – Р .427-432.
262. Uhleman E.R., Robberecht P., Gardner J.D. Effects of alcohols on the actions of VIP and secretin on acinar cells from guinea pig pancreas // Gastroenterology. – 1979. - № 76. – Р.917-925.
263. Walsh J.P., Rao A., Thompson R.C., Clarke I.J. Proenkephalin and opioid mu-receptor mRNA expression in ovine hypothalamus across the estrous cycle // Neuroendocrinology. – 2001. – V. 73, № 1. – Р. 26-36.
264. Wardlow S.L. Regulation of b-endorphin, corticotropin-like intermediate lobe peptide, and a-melanotropin-simulating hormone in the hypothalamus by testosterone // Endocrinology. – 1986. – V. 119, № 1. – P. 19—24.
265. Winkler A., Buzas B., Siems W.E., Heder G., Cox B.M. Effect of ethanol drinking on the gene expression of opioid receptors, enkephalinase, and angiotensin-converting enzyme in two inbred mice strains // Alcohol Clin. Exp. Res. – 1998. – V. 22, № 6. – Р. 1262-1271.
266. Yamamoto T., Nishiyama M., Naka A. Role of epidermal grouwth factor in reproduction // Acta Obstetr. Gynaecol. Jap. – 1988. – V. 40, № 5. – P. 649-654.
267. Yoshioka S., Fujiwara H., Yamada S., Nakayama T., Higuchi T., Inoue T., Mori T., Maeda M. Membrane-Bound Carboxypeptidase M is expressed on human ovarian follicles and corpora-lutea of menstrual-cycle and early-pregnancy // Molecular Human Reproduction. – 1998. – V. 4, № 7. – Р. 709-717.
268. Zhou Y., Franck J., Spangler R., Maggos C.E., Ho A., Kreek M.J. Reduced hypothalamic POMC and anterior pituitary CRF1 receptor mRNA levels after acute, but not chronic, daily “binge” intragastric alcohol administration // Alcohol Clin. Exp. Res. – 2000. – V. 24, № 10. – Р. 1575-1582.
Похожие работы
... о динамике изменения активности ферментов. ГЛАВА 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 3.1. Исследование активности основных карбоксипептидаз в тканях крыс разного возраста, испытавших пренатальное воздействие этанола 3.1.1. Исследование активности карбоксипептидазы Н в тканях пренатально алкоголизированных крыс разного возраста Согласно данным дисперсионного анализа пренатальное воздействие ...
0 комментариев