Навигация
6. БЕЛКИ МИЕЛИНА
Белковый состав миелина своеобразен, но существенно проще, чем в нейронах и глиальных клетках.
В миелине велика доля катионного белка – КБМ. Он представляет собой относительно небольшой полипептид с Мг = 16–18 кД. КБМ содержит значительную долю диаминокислот и в то же время около половины составляющих его аминокислот – неполярные. Это обеспечивает, с одной стороны, тесный контакт с гидрофобными компонентами липидов миелина, а с другой стороны, определяет его способность к образованию ионных связей с кислыми группировками липидов.
Необычайно высокой гидрофобностью характеризуются так называемые протеолипидные белки Фолча, составляющие большую часть остальных белков миелина. В свою очередь, главный из этих белков – липофилин, в котором 2/3 составляющих аминокислот – неполярные. Интересна определенная избирательность контактов липофилина с липидами, например, вытеснение холестерина из его окружения. Полагают, что это связано с особенностями вторичной структуры липофилина.
Довольна велика также доля так называемого белка Вольфграма – кислого протеолипида, довольно богатого остатками дикарбоновых аминокислот, и, в то же время, содержащего около половины остатков неполярных аминокислот.
Наконец, из нескольких десятков других белков миелина отметим миелинассоциированный гликопротеин, расположенный на экстраделлюлярной поверхности мембран; он встречается, кроме того, в олигодендроцитах до миелинизации и в миелине периферической нервной системы. В ЦНС человека он представлен тремя полипептидными цепями с Мг=92, 107, 113 кД, а в периферической нервной системе – одним белком с Мг=107 кД. МАГ относится к гликопротеинам с относительно низким содержанием углеводных остатков – около 30% от массы молекулы, но содержит характерный для гликопротеинов набор углеводов: N‑ацетилглюкозамин, N‑ацетилнейраминовая кислота, фукоза, манноза и галактоза. Для белковой части молекулы характерно высокое содержание глутаминовой и асларагиновой кислот.
Функции белка Вольфграма и МАГ неизвестны, если не считать общих соображений об их участии в организации структуры миелиновых оболочек.
7. НЕЙРОСПЕЦИФИЧЕСКИЕ БЕЛКИ ГЛИИ
Белок S‑100 содержится и в нейронах, и в глиальных клетках, причем доля его в последних велика – около 85%.
В 1967 г. из а2-глобулинов мозга был выделен нейроспеци-фический а2-гликопротеин с молекулярной массой 45 кД. В мозге человека он появляется на 16‑й неделе эмбрионального развития. Углеводные компоненты его включают глюкозамин, маннозу, глюкозу, галактозу, галактозамин и N‑ацетилнейраминовую кислоту. а2-гликопротеин локализован только в астроцитах, но отсутствует в нейронах, олигодендроцитах и в клетках эндотелия. Поэтому его можно рассматривать как один из специфических маркеров астроцитов.
Другой белок опять-таки характерен только для клеток глии. Он был выделен из богатых фиброзными астроцитами областей головного мозга человека, а впоследствии – в значительно больших количествах – из мозга больных множественным склерозом. Это вещество было названо глиальным фибриллярным кислым белком. Он специфичен только для ЦНС, а в ПНС он не обнаружен. Содержание его в белом веществе головного мозга превышает таковое в сером веществе. В онтогенезе мышей максимальное содержание GFA наблюдается между 10‑м и 14‑м днями постнатального развития, т.е. совпадает по времени с периодом миелинизации и пиком дифференцировки астроцитов. Молекулярная масса белка составляет 40–54 кД. Глиальная локализация этого белка также позволяет использовать его как «маркерный» белок для этих клеток.
Функции а2-гликопротеина и белка GFA неизвестны.
Что касается белков микроглии, то следует иметь в виду участие этих клеток в построении миелина. Многие из белков миелина, выявлены в микроглии.
В глии представлены также многие рецепторные и ферментные белки, участвующие в синтезе вторичных мессенджеров, предшественников нейромедиаторов и других регуляторных соединений, которые могут быть отнесены к нейроспецифическим.
8. ИНТЕНСИВНОСТЬ МЕТАБОЛИЗМА БЕЛКОВ В РАЗЛИЧНЫХ ОТДЕЛАХ НЕРВНОЙ СИСТЕМЫ
Современное представление о динамическом состоянии белков в нервной ткани было установлено благодаря применению изотопов А.В. Палладиным, Д. Рихтером, А. Лайтой и другими исследователями. Начиная с конца 50‑х и в течение 60‑х годов при изучении метаболизма белка использовались различные предшественники их биосинтеза, меченые С, Н, S. При этом было показано, что белки и аминокислоты в головном мозге взрослого животного метаболируют, в общем, более интенсивно, чем в других органах и тканях.
Например, в опытах in vivo при применении в качестве предшественника равномерно меченой С‑1–6‑глюкозы оказалось, что по интенсивности образования аминокислот за счет глюкозы ряд органов можно расположить в следующем порядке:
головной мозг > кровь > печень > селезенка и легкие > мышца.
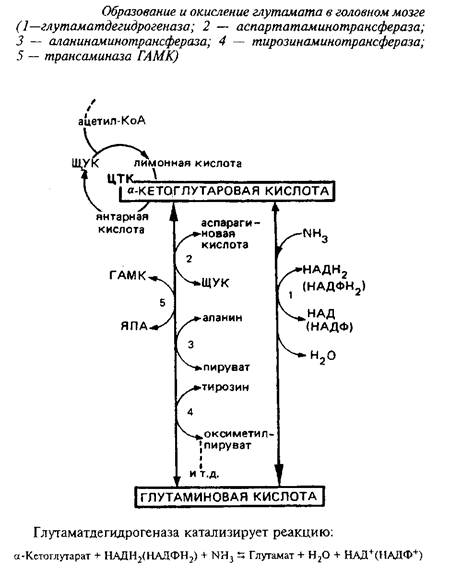
Аналогичная картина наблюдалась при использовании и других меченых предшественников. Показано, что из С-ацетата в головном мозге интенсивно синтезируется углеродный скелет аминокислот, особенно моноаминодикарбоновых кислот и прежде всего глутамата; из моноаминомонокарбновых кислот достаточно интенсивно образуются глицин, аланин, серии и др. Следует отметить, что особое место в метаболизме аминокислот занимает глутамат. В опытах in vitro с использованием меченого глутамата показано, что если в реакционную среду гомогената мозга добавить только одну глутаминовую кислоту, то она может быть источником образования 90–95% аминокислот.
Были проведены многочисленные исследования по изучению различий в интенсивности метаболизма суммарных и индивидуальных белков с помощью меченых предшественников. В опытах in vivo при использовании С-глутамата было показано, что он включается в 4–7 раз интенсивнее в белки серого вещества, чем белого. Во всех случаях интенсивность обмена суммарных белков серого вещества больших полушарий мозга и мозжечка оказалась значительно выше, чем белого вещества тех же отделов мозга, какой бы предшественник ни применялся при исследовании. При этом различие интенсивности обмена суммарных белков серого вещества по сравнению с белками белого вещества имеет место не только в норме, но, как правило, и при различных функциональных состояниях организма.
Проводились также исследования по изучению различий в интенсивности включения меченых предшественников в суммарные белки центральной и периферической нервной систем. Оказалось, что несмотря на существенные различия в составе, метаболизме и функциональной деятельности различных отделов ЦНС и ПНС, а также на сложность и гетерогенность белков, входящих в их состав, суммарные белки ЦНС взрослых животных обновляются значительно интенсивнее, чем суммарные белки ПНС.
Много исследований посвящено метаболизму белков в различных отделах головного мозга. Например, при изучении распределения радиоактивности в головном мозге после введения С-глутамата оказалось, что на долю серого вещества больших полушарий приходится 67,5 радиоактивности, мозжечка – 16,4, продолговатого мозга – 4,4, на долю других отделов головного мозга – около 11,7. В опытах in vivo при введении взрослым животным различных предшественников, а именно С-глутамата, С‑1–6‑глюкозы, С‑2‑ацетата, оказалось, что по интенсивности включения метки в суммарные белки различные отделы нервной системы располагаются в такой последовательности: серое вещество больших полушарий и мозжечка > таламус > зрительный бугор > средний и промежуточный мозг > Варолиев мост > продолговатый мозг > белое вещество больших полушарий и мозжечка > спинной мозг > седалищный нерв > миелин.
Проводились также исследования, посвященные изучению интенсивности обмена белков в различных отделах ЦНС с использованием авторадиографического метода. Получена аналогичная картина: наиболее интенсивное включение метки имело место в белках серого вещества больших полушарий и мозжечка, медленное – в спинном мозге и еще более медленное – в белках седалищного нерва. Что же касается подкорковых образований, то интенсивность обмена их белков была средней между скоростью обновления белков серого и белого вещества больших полушарий и мозжечка. Между отдельными подкорковыми образованиями наблюдаются менее существенные различия, чем между метаболической активностью белого и серого вещества.
Исследовались также суммарные белки различных областей коры больших полушарий – лобной, височных, теменной и затылочной. По данным Вэлша и ВАПалладина, более высокой обновляемостью обладают белки сенсорной области коры, а более низкой – белки височной доли коры больших полушарий. Эти же авторы показали, что более высокая обновляемость белков характерна для филогенетически более молодых и функционально более активных структурных образований мозга.
На фоне, в общем, высокой обновляемое белков мозга особого упоминания заслуживают немногие довольно инертные белки. К ним относятся гистоны нейронов неокортекса-катионные белки хроматина этих клеток. Во взрослом организме нейроны-неокортекса не размножаются. В соответствии с этим темп обновления гистонов очень незначителен. Среднестатистические сроки обновления половины молекул некоторых фракций гистонов измеряются десятками суток.
В головном мозге отсутствуют абсолютно инертные белки, а индивидуальные белки и белковые комплексы нейронов претерпевают непрерывную перестройку, связанную с их участием в функциональной деятельности нейронов и нейроглии. Помимо синтеза и распада целых белковых молекул происходят изменения в их структуре, происходящие, в частности, при аминировании и дезаминировании белков мозга. Их следует рассматривать как частичное обновление отдельных фрагментов белковой молекулы.
ВЫВОДЫ
1. В нервной ткани обнаружены характерные только для нее нейроспецифические белки. По химической природе они могут быть кислыми или основными, простыми или сложными, часто они представляют собой гликопротеины или фосфопротеины. Многие нейроспецифические белки имеют субъединичную структуру. Число открытых нейроспецифических белков уже превысило 200 и быстро возрастает.
2. Нейроспецифические белки прямо или косвенно участвуют в осуществлении всех функций нервной системы – генерации и проведении нервного импульса, процессах переработки и хранении информации, синаптической передаче, клеточном узнавании, рецепции и др.
3. По локализации в ткани нервной системы различают исключительно или преимущественно нейрональные и глиальные нейроспецифические белки. По субклеточной локализации они могут быть цитопяазматическими, ядерными или мембрано-связанными. Особое значение имеют нейроспецифические белки, локализованные в мембранах синаптических образований.
4. Многие кислые кальиий связывающие нейроспецифические белки участвуют в процессах транспорта ионов. Предполагается, что, в частности, они играют значительную роль в формировании памяти.
5. Особую группу нейроспецифических белков представляют сократительные белки нервной ткани, которые обеспечивают ориентацию и подвижность цитоструктурных образований, активный транспорт ряда компонентов нейрона и участвуют в нейромедиаторных процессах в синапсах.
6. К группе нейроспецифических белков, связанных с гуморальной регуляцией, осуществляемой головным мозгом, относятся некоторые гликопротеины гипоталамуса, а также нейрофизины и подобные им белки, являющиеся носителями пептидных регуляторов.
7. Разнообразные нейроспецифические гликопротеины участвуют в формировании миелина, в процессах клеточной адгезии, нейрорецепции и взаимном узнавании нейронов в онтогенезе и при регенерации.
8. Ряд нейроспецифических белков представляет собой мозговые изоэнзимы известных ферментов, например енолазы, альдолазы, креатинкиназы и др.
9. Многие нейроспецифические белки весьма активно метаболируют в головном мозге животных, причем интенсивность метаболизма различна в разных отделах мозга и зависит от функционального состояния нервной системы. В целом по интенсивности обновления белки мозга значительно превосходят белки других тканей и органов.
Похожие работы
... и инозитолтрифосфат подвергаются химическим превращениям, требующим АТФ и ЦТФ и приводящим к восстановлению три-фосфоинозитида. Таким образом, цикл замыкается и уровень полифосфоинозитидов в мембране восстанавливается. 7. МИЕЛИН В ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЕ Мозг человека содержит 120 г миелина, что составляет одну треть его сухой массы. Миелин – уникальное образование, организация которого ...
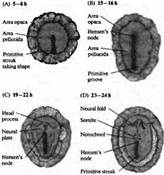
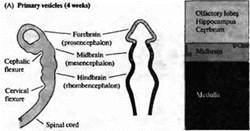
... уровне направленные мутации, что открывает дорогу к обнаружению важных генов позвоночных, которые могут иметь гомологов у некоторых видов более просто устроенных беспозвоночных. Развитие нервной системы в раннем периоде В раннем периоде морфогенеза позвоночных область гаструлы, из которой в дальнейшем формируется нервная система, представляет собой простую полоску эктодермы (рис. 1). ...
... видов животных. Региональные различия в концентрации метионина невелики. Влияние диеты на концентрацию метионина в мозге также незначительно из-за конкурентных отношений с нейтральными аминокислотами за транспортные системы. Метионин в пуле свободных аминокислот утилизируется на 80% для синтеза белка. Метаболизм свободного метионина до цистеина начинается с образования S-аденозилметионина, ...
... в синапсах вызывают деполяризацию или гиперполяризацию постсинаптической клетки. Потенциалы действия, представляющие собой короткие деполяризационные сигналы большой амплитуды, проводят по отросткам нейрона информацию из одного отдела нервной системы в другой. Все эти изменения мембранного потенциала вызваны движением ионов через клеточную мембрану. Например, направленное внутрь клетки движение ...




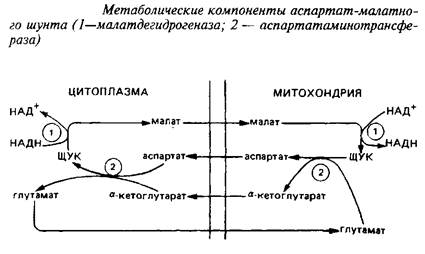
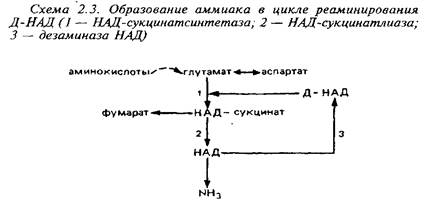
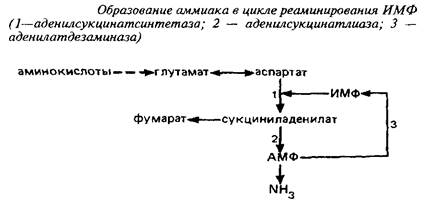
0 комментариев